复方中草药进入欧洲市场的关键成功因素
王 梅,孙朋悦,梁 文,戴苑苑,蔡 晟
(1.LU-European Center for Chinese Medicine,Sylviusweg 72,2333 BE,Leiden,The Netherlands;2.SU BioMedicine,Post Bus 546,2300 AM,Leiden,The Netherlands;3.深圳华开中药与天然药物研究中心,广东 深圳 518114)
中药在我国有悠久的药用历史,我国历史上第一部药学专著《神农本草经》始见于公元前2世纪的汉代,其后历朝历代本草佳作不断,如世界上第一部药典《新修本草》(公元659年)共收药850种,它比欧洲最早的《佛罗伦萨药典》(1498年出版)早839年,比1535年颁发的世界医学史上有名的《纽伦堡药典》早876年,比俄国第一部国家药典(1778年颁行)早1119年。《本草纲目》是一部集16世纪以前我国历史上本草学大成的著作,举世闻名,其作者是明朝(1368-1644年)著名的医学家、药学家和博物学家李时珍,该著作于1578年定稿,1596年在南京正式刊行,从完稿至刻印经历了10多年时间。由于中医药使用的悠久历史和对人类健康的作用,所以世界各地都广泛地使用中医药。从20世纪90年代起,西方国家开始关注中医药的质量及其安全性,北美和欧洲对中药的管理也开始纳入当地的管理机构。从表面上看,貌似是对中医药建立了壁垒,其实这也给中医药以药品身份进入其市场提供了机会。
中药是指在中医药理论指导下,用于预防、治疗、诊断疾病并具有康复与保健作用的物质。中药主要来源于天然药及其加工品,包括植物药、动物药和矿物药。由于中药以植物药居多,故有“诸药以草为本”的说法[1]。基于本文是讨论中药国际化的问题,欧盟已经有明确的植物药管理法律法规,所以本文讨论的中草药是指中药里的植物药部分。
植物药不仅我国在使用,欧洲也有很长的使用历史。早在公元前400年欧洲已经进入植物药使用的时代,此后罗马帝国通过贸易将植物药传播到整个欧洲地区。西方医祖希腊人希波克拉底指出,植物药在人类医疗健康方面拥有不可或缺的作用[2]。对于植物药的管理,欧盟各成员国在过去很长的时期里是不一致的。如德国和法国对植物药监管严格,按药品管理;在英国、荷兰还在按保健品管理[3]。2004年欧盟出台了传统植物药注册指令2004/24/EC(也称为欧盟植物药“简化注册”指令),统一了欧盟对植物药的管理[3]。
在欧盟,植物药的管理依据药品2001/83/EC的修订指令分为欧盟传统植物药、固有应用植物药和创新植物药3大类。这3大类植物药注册要求的区别主要在非临床和临床这2部分,在药学质量方面它们的要求是一致的[4-5]。我们通常讲的欧盟中药简化注册是指欧盟传统植物药注册,它的适用条件是这个药品在欧盟至少有15年使用历史,在世界其他地方有>30年的使用历史。这样可以免除临床试验和大部分的非临床实验。这样整体的注册费用会大大降低,大部分药品生产企业是可以承担的。当然,传统植物药在欧盟注册的适应证有一定限制,具体见图1。关于欧盟创新植物药和传统植物药在注册中涉及的适应证、应用历史、药物剂型和申报资料方面的差异见表1。
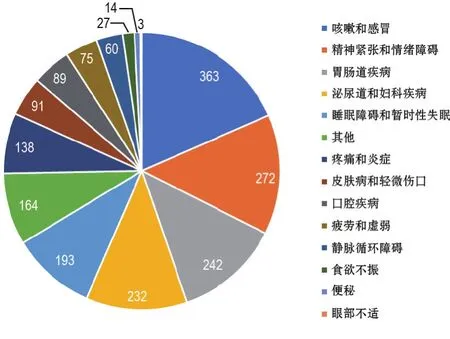
图1 欧盟传统植物药注册的适应证.
欧盟传统植物药指令2004/24/EC是药品2001/83/EC的修订指令的一部分,专门为欧盟传统植物药设计。自2004年出台以来,到目前为止已经15年。在这期间,中药制剂申请欧盟传统植物药注册已经有实质的突破,但是还未全面提升。有突破是指2012年成都地奥集团的地奥心血康于荷兰取得欧盟传统植物药注册成功,其后又有天津天士力的丹参胶囊、香雪制药的板蓝根和同仁堂的葛根等单方中药制剂相继在荷兰和英国申请欧盟传统植物药注册成功。
虽然这些是单方中草药制剂,但它们在欧洲传统植物药的成功注册意义很大,让我们了解到欧洲植物药是怎样的水平,在质量、安全性和功效上有哪些具体要求。例如,成都地奥集团在2008年2月申报地奥心血康欧盟传统植物药注册时,对植物药全产业链质量控制尚无足够的认识,是否能够通过欧盟的良好的生产制造规范(Good Manufacturing Practices,GMP)检查是一道难题。其实,对许多中国企业目前依然如此。地奥集团内部经过多次企业改造,按照欧盟GMP要求进行自检,同时聘请欧盟GMP专家协助检查,不断地发现问题、解决问题,不断地提升完善企业的质量体系,终于于2010年1月通过欧盟GMP检查,获得欧盟GMP证书,为2012年地奥心血康胶囊在荷兰成功通过欧盟传统植物药注册打下坚实的基础。植物药/中药全产业链质量控制包括从药材种植、采收和加工开始,经过药材原料在工厂的提取加工,到提取物进一步加工成药物制剂,再到药物经过储存、运输和进入市场交到消费者手中,至此,产业链质量控制还未结束,后面还有药物警戒系统全面监督药物的使用情况,对于可能出现的毒副作用给予密切监控。实事求是地讲,我们谈论中药国际化、中药现代化已经多年,可是我们对国外关于植物药管理的法律法规的了解还是很有限的。通过注册实战,可以直观地与有关植物药各种法律法规、指南与欧盟成员国负责药品注册的主管机构正面对接,进行沟通和讨论[6]。通过这种直接的方式,可以带动我们对欧洲植物药认识的提升,加强我们自己的中药生产企业质量体系的完善,带动我国整体中药行业在质量观念上的进步,从而促进整个行业的发展,增强我国中药企业参与国际竞争的自信心[7]。

表1 欧盟创新植物药注册与简化注册的对比
然而我们也清楚,中医临床用药是以复方为主,所以单方中草药欧盟传统植物药注册成功还只能算中医药国际化前进的一小步,更大的考验是复方中草药在欧盟的注册。目前有国内中药先锋企业在这方面进行积极的努力。与此同时,我们的邻国日本,一汉方制药企业经过8年的努力在德国将六君子汤加减方(YamatoGast)申请欧洲传统植物药注册成功。这对我们是一个启示,同时也是一种激励。启示是复方中草药制剂在欧盟注册是完全可行的;激励是我们复方中草药的生产和质量控制与世界先进水平还有一定的距离,还需要我们努力追赶。因此,中药进入欧盟市场既是机遇也是挑战。以质量控制为基础、用科学证据来支持产品的安全性和有效性是中药全球化的关键(图2)。下面就复方中草药进入欧洲市场的关键成功因素进行详细讨论。
1 质量标准和控制
根据欧洲药品管理局(European Medicines Agency,EMA)统计,在2004-2016年的12年间,欧盟各成员国传统植物药注册共1719种,其中单方1089种,复方630种,复方占总数的36.65%[8]。虽然在欧盟市场上单方植物药依然占多数,但是复方占的比例也很高,说明欧盟各成员国有使用复方植物药的传统,对于复方植物药的接受度还是很高的。
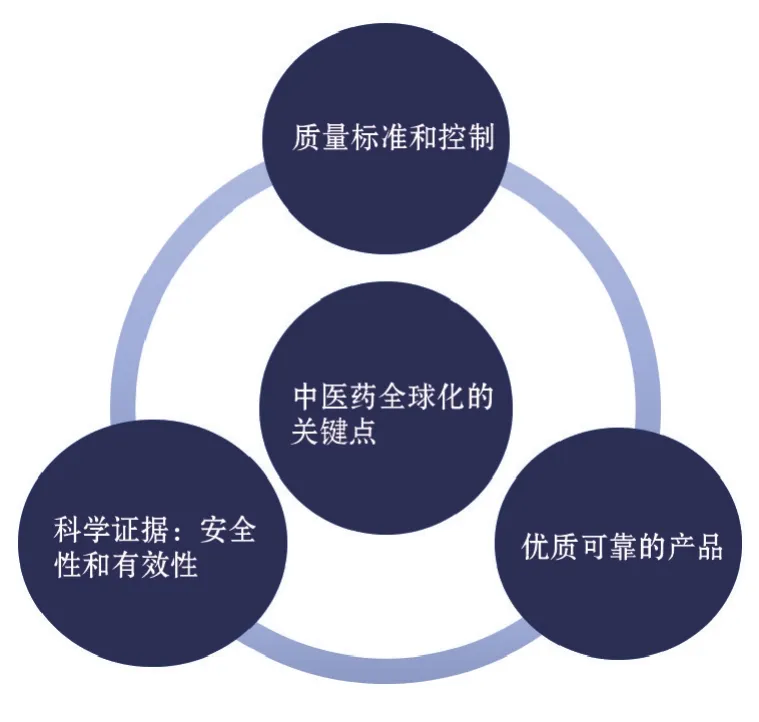
图2 进入欧盟市场的机遇和挑战:中药全球化的关键——有科学证据和安全可靠的产品.
复方中草药进入欧洲市场的关键是质量。只有质量过硬,才能够通过欧盟传统植物药注册,以药品的身份进入欧盟市场[5]。
质量要想过硬一定要标准先行。欧盟对植物药质量非常重视,欧洲药品质量管理局(European Directorate for the Quality of Medicines,EDQM)通过《欧洲药典》以通用原则和专论的形式对每一味植物药材的质量要求进行规范。欧洲药物标准被公认为全世界的药物质量的标杆。但是《中国药典》的中药标准是有中医药特色的,我们的目标是建立与国际质量标准接轨但是又不丢失中医药特色的质量标准。因此,其质量标准和制定原则与《中国药典》一起,可用于建立国际统一的中药材质量标准的参考。EDQM通过推动对药物质量标准的开发、支持对标准的实施以及监督标准的使用情况来保护公共健康。有一点需要指出的是,植物药的质量标准并不是对植物药里所有成分定性定量分析、以及证明每一个成分的有效作用和它们的作用机制。这个理想也许在未来科学发展的基础上会实现。目前欧盟对植物药的质量控制主要是要求展示生产过程的可重复性和产品质量的稳定性。如果已经确认在植物药里的有效化学物质,控制其成分的稳定性也是质量控制的一部分。所以欧盟的植物药的质量控制对中药并不是一个技术壁垒,而是相互学习和借鉴的对象。
《欧洲药典》在所有欧盟成员国中均具有法律约束力。从2005年开始,为使中药材的质量标准符合欧盟药学质量要求,《欧洲药典》委员会决定在《欧洲药典》中增加中药质量专论[9]。根据这一决定,《欧洲药典》的专家组13A和13B(植物化学)收到《欧洲药典》委员会秘书处的说明,将中药材质量专论纳入其工作计划。到2008年,《欧洲药典》委员会专门成立了一个中药委员会,在原有工作基础上,所有的有关中药的质量标准工作均由这个新成立的委员会完成。因此,《欧洲药典》收载中药材质量专论的速度大大加快。到目前为止,《欧洲药典》已经建立了80多种中药材专论(表2)。
复方中草药处方里的单味药材的质量控制可以借鉴《欧洲药典》的方法和标准;对于复方中草药制剂的质量控制则需要在单味药材的基础上,建立切实可行的质量控制方法[10-11]。理想的情况是每一味药材或提取物都能够进行定性定量检测。然而在现实的技术条件下,复方中草药处方里的每一味药材或提取物都能够进行定性定量检测有时候是困难的,或者说是不可能的。如果某一组分无法进行定性或定量检测,为了说明情况,一定要把适用于植物药定性定量的分析方法都试验一遍(比如《欧洲药典》通论第二章“分析方法”里介绍的方法),然后再结合复方中草药的情况对分析方法和结果进行讨论。如果确实无可行的分析方法,那么就要有其他替代的、能保证产品质量的方法或策略,比如采取联合含量检测方法,或减少处方的药味数,或者在药品生产的时候加强GMP管理,如生产过程验证、批记录,以确保药品的质量。简单地省略质量检测是不允许的。

表2 进入《欧洲药典》的中药清单(截至2019年12月)

续表2
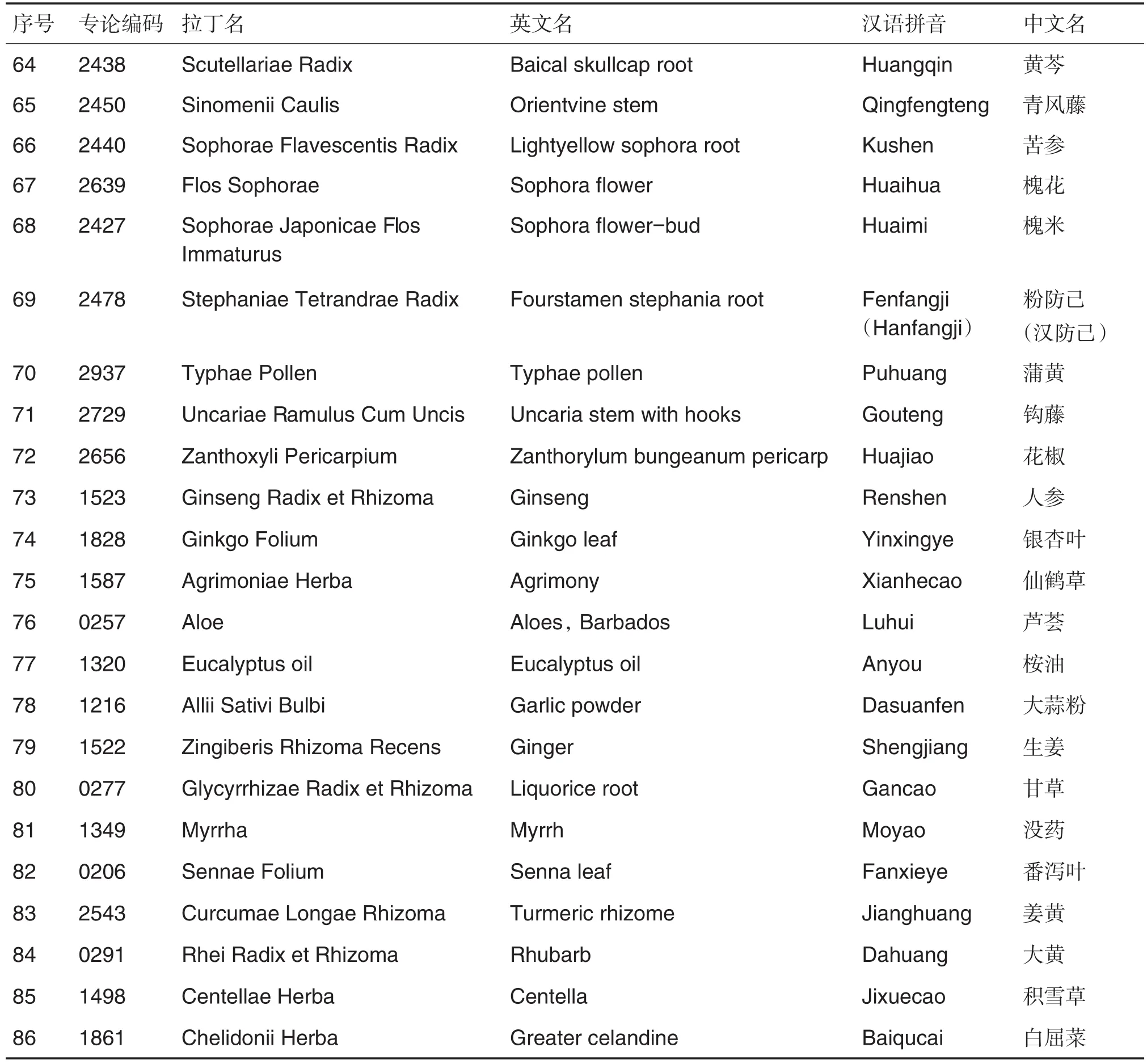
续表2
另外,随着技术的进步,近年来一些以前难以检测的微量成分如吡咯里西啶生物碱(pyrrolizidine alkaloids,PA)现在也能够定性定量检测[12-13]。PA是公认的具有致癌和基因毒作用的物质。总体来说,已经发现并确定结构的PA有数百种,数千种植物含有这类成分,绝大多数是杂草类植物。所以,减少或避免杂草的污染是目前控制PA的主要方法。目前,对于申请欧洲传统植物药注册的产品,对PA检测的要求会逐渐加强;《欧洲药典》植物药PA专论尚未出台,不过经过长时间的准备,也是呼之欲出,让我们拭目以待[14]。目前常用的分析方法是LC-MS/MS[15]。EMA要求定性定量检测的28种PA见表3。
标准的建立很重要,但是更重要的是标准的落实。不同类型的良好的质量管理(GXP)执行包括良好的农业和采集规范(Good Agricultural and Collection Practices,GACP)、GMP和良好的运输分配规范(Good Distribution Practice,GDP)等是标准落实的关键,是保证产品质量的关键。对于中药来讲,地道药材的概念对于保障药材质量非常重要[16]。地道药材意味着在特定的地理区域和气候条件下生长的且遵守严格的收获时间和加工条件的植物药,质优效佳[17-18]。因此,地道药材的概念与GACP,GMP和GDP的现代管理理念不谋而合。然而,如何将这样的理念完全落实在实际生产过程中,即使是EMA也仍未在它的GACP指导原则(2002年)中,对植物药种植管理、采收、加工等提供可以操作的标准化规则[14,19]。这表明尽管现实是迫切需要建立国际统一的质量标准,但是合适的质量控制方法或工具依然缺乏。所以,这也是目前中药企业的难点。另外,中药的炮制是传统中医药独有的药材处理方法,对于中药的质量、安全性和有效性有非常重要的影响。因此,在讨论中药复方进入欧洲的同时,怎样让中药的炮制概念从传统经验到科学理论、并且用科学语言表述出来,也是中药国际化和推广中国软实力的重要内容。

表3 欧洲药监局要求定性定量检测的28种吡咯里西啶生物碱
2 传统使用的安全性和疗效
欧盟对药品的管理区别于中国的药政。《中国药典》是展示上市药品的质量控制、安全性和有效性的法定文件,而欧盟药品安全性和有效性是EMA管理负责,质量控制是《欧洲药典》负责(图3)。对于植物药,EMA的植物药产品委员会根据欧盟传统植物药指令2004/24/EC,从安全性和药效2个角度建立起植物药专论,这个专论具有法律约束力。欧盟植物药专论通常包括产品名称、定性定量组成、药用形式、临床适应症、服用方法和药物剂量学、禁忌症、使用注意事项、与其他药物的相互作用、对于妇女生育、怀孕和哺乳的影响、对汽车驾驶和机器操作能力的影响、药物副作用以及药理方面的数据等等。

图3 中医药进入欧盟必经的2个管理机构:《欧洲药典》和欧洲药监局(包括成员国药监机构).《欧洲药典》为产品提供质量证据(《欧洲药典》专论);欧洲药监局为产品提供安全性和有效性证据(欧盟专论).
欧盟植物药专论与《欧洲药典》植物药专论一起为欧洲的植物药产品监管提供了完整的技术标准,定义了欧洲草药产品的基本标准。欧盟是少数同时建立植物药质量、安全性和有效性专论的国家和地区之一,它的总体目标是通过确保植物药质量、安全性和有效性来维护消费者的根本利益。
包括复方在内的中药安全性是一个非常重要的课题。中国最早药学专著《神农本草经》就有中药安全性的记录。《神农本草经》共记录药物365种,它们分别源自植物、动物和矿物质,被分类为优质、普通和劣等3个类别。在劣等类别中,125种药物被认为有毒或有副作用[20-21]。建议对这些药物的使用采取谨慎态度,比如仅与其他特定的医疗方法结合用于治疗特定疾病;在配方之前要进行处理;逐渐增加剂量以避免强烈的毒性作用;请勿单独或长时间使用。在中医药的长期传统使用中发展出一个“炮制”概念,炮制有许多功能,但是增效减毒是一个重要方面,也是中医药特色。近年来,由于自然资源的限制,假药以各种形式出现,包括用其他材料代替正宗的草药;掺杂造假以及使用不适当的加工方法(例如,硫熏蒸和染色)[22-23]等不一而足,这些不当的做法都会影响到中药使用的安全性和有效性。
在世界范围内,随着植物药越来越受欢迎,包括中药在内的植物药安全性和有效性越来越受到关注,相关的专论也不断地发布。例如,德国Commission E、欧洲植物疗法联合会(European Scientific Cooperative on Phytotherapy,ESCOP)和世界卫生组织(World Health Organization,WHO)分别对植物药的安全性和有效性进行了研究,并出版了相关专论[4]。这些专论虽然不具备法律约束力,但是已经被很多国家作为草药安全性和有效性的重要信息来源。与这些专论不同,欧盟草药专论具有法律约束力,已经被很多国家视为考查植物药安全性和有效性的重要参考依据。欧盟草药专论与《欧洲药典》一起为欧洲的草药产品的监管提供了完整的标准体系,定义了欧洲草药产品的基本规范(图3)。
复方中草药申请欧盟传统植物药注册,欧盟植物药专论会起到非常大的帮助作用。如果某个产品的欧盟植物药专论已经建立,该中草药申请注册的应用范围又包括在欧盟植物药专论以内,那么该产品在申请欧盟传统植物药注册时,它的传统使用证据便不再需要。所以,整个药品注册过程会被极大地简化。
总之,欧洲传统植物药指令为传统植物药的科学评估和市场销售提供了强有力的法律保护。这个植物药管理制度的设计对我们来说有许多值得借鉴的地方。对于制药工业,尤其是欧盟以外的制药工业,在其欧盟注册程序中合理地使用欧盟植物药专论会带来巨大好处。同样,对欧盟植物药法律法规了解较少的来自非欧洲地区的监管机构和政策研究人员,可能会受益于本文系统和深入的分析,有助于全球范围内传统草药的安全使用,使消费者、医疗保健从业人员以及植物药生产行业受益。
3 系统生物学为中医诊断和中医治疗提供科学证据
本文主题讨论的是复方中草药进入欧盟的关键因素。前面提到,欧盟植物药的管理分为欧盟传统植物药、固有应用植物药和创新植物药3大类。除了我们已经讨论过的欧盟传统植物药注册,另外2类植物药注册/市场准入许可申请也是进入欧洲市场的重要路径。据EMA统计,在2004-2016年期间,欧盟各成员国发放固有应用植物药市场准入许可859种,其中复方155种[8]。另有报道,欧盟已经有3种单方新植物药按照完整注册申请方式通过新药审批获准上市[24]。这3种新植物药分别是茶多酚软膏(veregen)、大麻喷剂(sativex)和桦树皮胶(episalvan)。复方植物药按完整注册方式申请欧盟新植物药还有待突破。总之,除了欧盟传统植物药注册途径之外,其他2类植物药注册申请方式也是复方中药进入欧盟市场的途径。只是这个途径与欧盟传统植物药注册要求不同,它们需要更完整的更准确的非临床和临床研究的科学证据。
西方制药业往往倾向于从单一靶点的角度来研究植物药,寻找具有某一生物活性的化合物。他们的基本想法是分离和确定活性化合物的结构,并将其用作为先导化合物和进一步研究药物的模板。多年来,西方制药业使用这种方法已经取得了巨大的成功。因为大多数药物的基础都是来自天然产物[25]。但是,这种药物活性筛选方法消除了多组分的协同作用,而协同作用是中医整体方法的基础[26-28]。
系统生物学是一个多学科的综合研究领域,它使用的技术平台包括处于不同水平的转录组学、蛋白质组学和代谢组学;不同水平的研究是指在细胞水平、组织水平、器官水平和生物系统水平(图4)。此外,要特别注意对身体体液生理和病理状态的研究,这些反映身体健康状况的数据或反映身体健康状况的生化指标是观察药物作用和患者使用情况的重要信息来源。体液的研究为人类生理学病理学开辟了新的认知领域,尤其适合评估治疗效果。典型的液体是尿液、血液、脑脊液、唾液、淋巴液和滑液等,特别是尿液和血液[29-30],它们是蛋白质组学和代谢组学测量的重要部分[31-33]。在某些情况下,转录组学也可用于监测研究[30]。至于传统中医药,临床应用情况复杂,存在着各种已知的和未知的变量。系统生物学能够在拥有足够多的患者临床数据和传统中医药质量数据的情况下成为一个“转化平台”[34],为中医诊断和治疗奠定现代生物学基础(图4)。
系统生物学的研究方法通常包括如下几个方面。首先对目标生物系统的所有组分进行分析检测,描绘出该系统的基本结构,包括基因和蛋白的相互作用网络、细胞内和细胞间的作用机制以及机体整体代谢物水平等,以此构造出一个初步的系统轮廓。接下来通过各种干预,如基因敲除和药物干预等改变目标系统的内部组成结构,然后观测在这些情况下系统组分或结构在基因、蛋白或代谢物水平上所发生的相应变化,并把得到的有关信息进行整合。第三步是把通过实验得到的数据与根据模型预测的情况进行比较,并对初始模型进行修订。第四步是根据修正后的模型的预测或假设,设定和实施新的改变系统状态的实验,实现系统论和实验、计算方法整合的系统生物学概念。由此得到一个理想的模型来预测生物系统的动态变化。
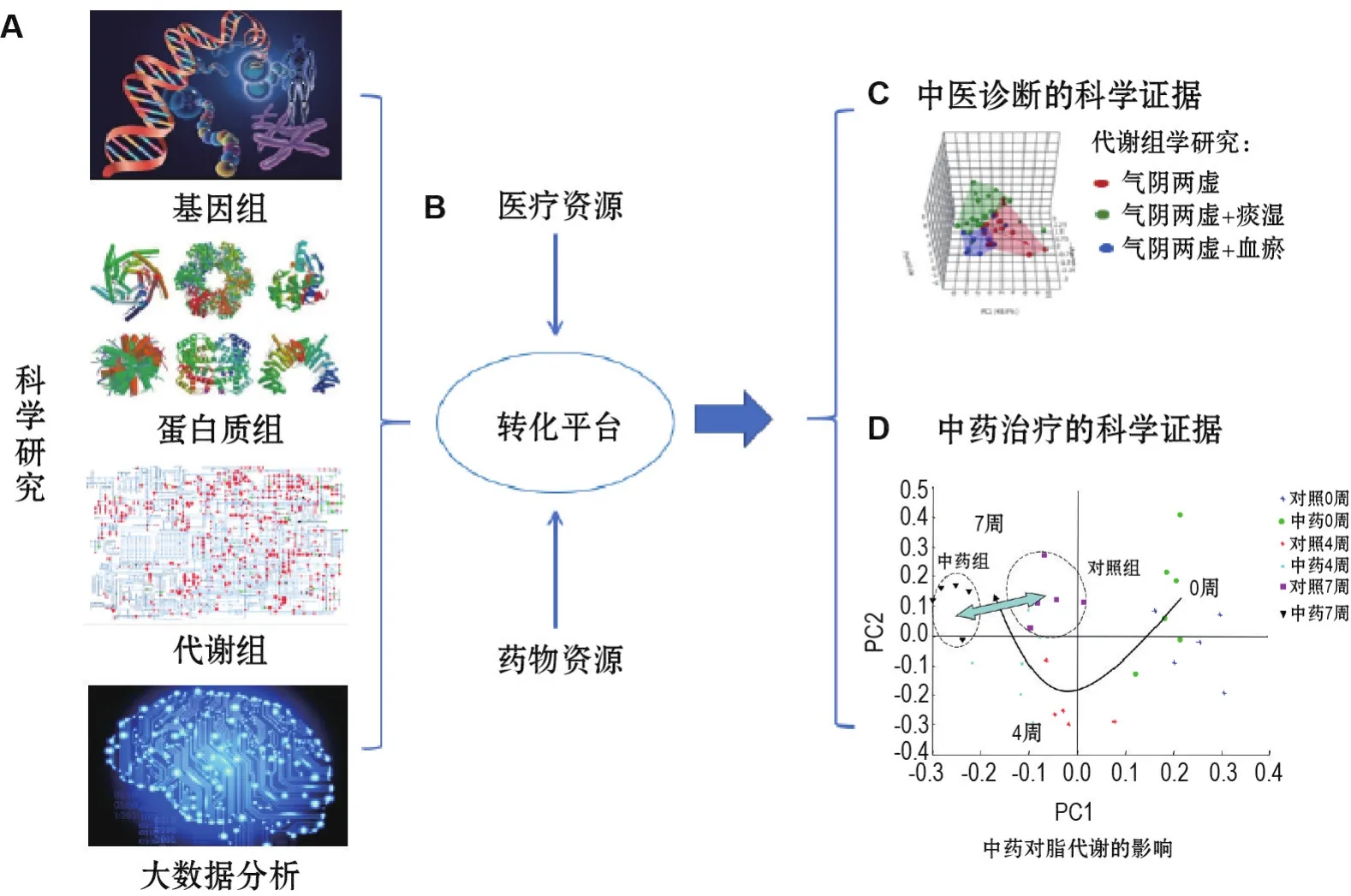
图4 系统生物学为中医药国际化提供科学证据.A:系统生物学的技术平台(包括基因组学、蛋白组学和代谢组学);B:转化平台,利用系统生物学技术平台的数据,整合医疗和药物资源的信息,将中医诊断与系统生物学的组学技术平台结合起来,形成转化平台;C:为中医诊断提供科学证据,例如,代谢组学平台把早期糖尿病患者血清中的代谢物按照中医理论分为3个亚证型(气阴两虚、气阴两虚+痰湿和气阴两虚+血瘀);D:为中药治疗提供科学证据,例如,复方中药治疗早期糖尿病.动物实验显示,第7周脂代谢图谱的变化,治疗组和非治疗组有显著性差异.
系统生物学可为中医药国际化提供科学证据[29,35-40]。现举例说明,图4A是描述系统生物学的技术平台(基因组学、蛋白组学和代谢组学);图4B利用系统生物学技术平台的数据,整合医疗和药物资源的信息,将中医诊断与系统生物学的组学技术平台结合起来,形成转化平台,其目的是为中药的诊断和治疗提供科学证据;图4C介绍代谢组学平台把早期糖尿病患者血清代谢物按照中医理论分为3个亚证型(气阴两虚、气阴两虚+痰湿和气阴两虚+血瘀),为中医诊断提供现代医学的物质基础;图4D介绍复方中药治疗早期糖尿病,动物实验显示第7周脂代谢图谱的变化,治疗组和非治疗组有显著性差异。显然,系统生物学可以在中药和西药的2种不同而又互补的学科之间发挥重要的桥梁作用[34]。因为它既可以揭示单一成分的药物活性,又能够解释复杂的成分之间的协同作用[41]。
科学地诠释中医药对疾病的治疗作用是当今生命科学研究中最复杂的挑战之一。用系统生物学研究中医药对人类健康的作用机制是非常有前景的。用科学语言解释复方中草药的安全性和有效性,为中药申请欧盟固有应用植物药和创新植物药市场准入许可提供科学证据,到那时,中药国际化和现代化水平将会得到极大的跃升。系统生物学的技术平台,不但可以为创新中药提供科学证据,而且可以把西医的病和中医的证候结合起来。这样在适应证和治疗疾病方面也对传统植物药欧盟注册成功提供了科学证据,为产品国际化打下科学基础。
4 中药的欧洲市场前景
当今社会,健康生活的概念发生了巨大变化,人们越来越追求自然和生活质量。中医药的独特作用不仅受到国内的重视,而且在国际上也引起了广泛的关注。欧盟拥有全面完整的植物药法律法规管理体系,植物药在欧盟分为欧盟传统植物药、固有应用植物药和创新植物药3大类。中草药欧盟注册后,也是属于这3类植物药其中的1种。不同的申报途径决定了它们在分类上属于哪一类。无论在法规上它们属于哪一类,在市场上它们有1个统一的名称,即植物药。
人们经常会问欧盟的中草药市场有多大,但是往往很难得到一个准确的答案。其实,中药欧盟注册以后才可进入欧盟OTC药物市场,这个市场包括化药和注册后的植物药/中药,这是主流药物市场,与在欧洲的传统中医诊所以医带药的销售方式不同。所以,想具体了解注册中药的欧盟市场有多大,需要将欧盟主流药物市场进一步细化分析。
关于2017年欧洲OTC市场治疗咳嗽和感冒的产品信息见图5。德国是欧盟咳嗽和感冒药的市场领导者,销售额约为15.57亿欧元;紧随其后的是意大利,咳嗽和感冒药销售额为7.178亿欧元;咳嗽和感冒产品销量最低的国家是拉脱维亚,为630万欧元(图5)[42]。2017年欧洲OTC市场治疗胃肠道疾病产品的销售额见图6。2017年,在欧洲的胃肠道疾病产品市场德国也是领导者,销售额为7.12亿欧元;紧随其后的意大利,销售额是4.39亿欧元;克罗地亚销售额最低,为1400万欧元(图6)[42]。2017年欧洲OTC市场治疗皮肤病产品的销售额(图7)。德国在欧盟治疗皮肤病产品市场上居于领先地位,销售额为5.63亿欧元;紧随其后的是意大利,销售额是2.36亿欧元;法国、波兰和西班牙分列第3,4和5位,销售额分别是2.21亿、1.87亿和1.51亿欧元(图7)[42]。2017年欧洲OTC市场止痛药的销售额见图8。意大利是欧盟治疗皮肤病产品市场的领导者,销售额为5.15亿欧元;德国紧随其后,销售额是4.76亿欧元;法国、波兰和西班牙分列第3,4和5位,销售额分别是4.72亿、3.56亿和3.18亿欧元(图8)[42]。

图5 2017年欧洲OTC市场治疗咳嗽和感冒产品销售额[42].

图6 2017年欧洲OTC市场治疗胃肠道疾病产品销售额[42].

图7 2017年欧洲OTC市场治疗皮肤病产品销售额[42].

图8 2017年欧洲OTC市场止痛药销售额[42].
5 结语与展望
中药不同于西药,它有自己的药性理论,如四气五味、升降浮沉、归经、有毒无毒、配伍和禁忌等。但是,无论中医药还是西医药,都是研究人体的生命科学,它们只是从不同的角度,运用不同的概念、不同的理论体系和方法,研究的是同一生命体。因此,在我们认知它们不同的时候,其实它们还有很多共同点,比如药物的疗效概念、安全性概念和质量概念,无论是中药、西药还是其他现代或传统植物药都是如此。我们想特别强调地指出,中医药从其产生开始,便是一个开放的体系,经过2000多年不断的发展,兼收并蓄,从单味药到配伍应用,是通过很长的实践与认识过程逐渐积累丰富起来的,它已经是成熟和完善的治疗体系,为中华民族的健康和繁衍昌盛做出巨大贡献。
中医用药的主要形式是配伍应用,即复方。这符合中医药理论体系的整体观念和辨证施治。通过药性之间的相须、相使、相畏、相杀、相恶和相反的性质进行合理调配,达到个性化治疗和精准治疗的目的。单方和复方的应用,主要决定于病情和药性。
中医作为一种独立于西方医学之外的医疗体系,因其疗效确切已经为广大民众所接受;中药与中医相伴相生,随着中医的脚步已经遍布了世界各地。但是,在西方的主流医药界,中医药还没有被完全接受。尽管有各种困难和各种质疑,但中医药国际化的脚步从来未停止过。目前,单方中草药欧盟传统植物药注册已经有突破,但复方中草药的欧盟传统植物药注册我们还没有进展,这方面我们落后于我们的邻居日本,他们已将复方中药六君子汤成功完成欧盟传统植物药注册。
复方中草药欧盟传统植物药注册最主要的影响因素就是质量。复方中草药的质量控制与单方中草药相比更复杂、技术条件要求更高,对中医药国际化现代化也更有意义。中药质量的提高,一定要标准先行。因此,《欧洲药典》、《德国药品法典》和其它欧盟成员国药典的植物药专论以及EMA的欧盟植物药专论,包括质量、安全性和疗效方面的内容,都是非常好的参考和借鉴的样本。另外,除了标准之外,良好的生产管理GXP的落实,对于保证产品质量具有举足轻重的作用。EMA颁布实施的植物药生产涉及到的GACP,GMP,GDP和GLP等管理规范对完善中药的生产质量管理、保障产品质量提供了管理的参考范本,也为复方中草药进入欧盟市场创造了有利条件。
对于复方中草药欧盟传统植物药注册,由于不需要提供临床试验数据和大部分的非临床实验数据,因此,欧盟至少15年使用证据和欧盟以外至少30年使用证据极为关键。不过随着时间的推移,欧盟成员国中医诊所越来越注意保留使用证据,海关管理也越来越完善。所以,寻找欧盟中药使用证据的难度也逐渐变小。另外,如果EMA已经建立了欧盟植物药专论,这种情况下申请欧盟传统植物药注册则不再需要使用证据。对于复方中草药欧盟固有应用植物药和创新植物药的市场准入申请,则需要提供非临床和临床的科学证据。
系统生物学方法是一种多维的化学和药理学方法,能够将植物药复杂代谢特征与生物学效应联系起来。过去20年在生命科学领域中诞生的基因组学、蛋白质组学和代谢组学等系统生物学方法,为疾病诊断和治疗更加侧重于整体性的观点提供了强大支持,个体化医学日益受到关注。尤其是对中医药的科学性进行更加准确的评价成为可能[29,34],并且也能够为复方中草药申请欧盟固有应用植物药和创新植物药的市场准入提供非临床和临床的科学证据。
从消费者角度来看,药品是用来治病救人的,植物药也是药,所以疗效和安全性是消费者必然要考虑的内容。通常中药是在中医理论指导下用药,但是,在欧盟的OTC药物市场里,怎样指导欧洲消费者合理地使用中药?我们认为,系统生物学可以桥接传统中医药理论与现代医学理论,帮助西方消费者合理地使用中药,这对保证中药的有效性和安全性至关重要。系统生物学可为中医药治疗提供科学证据,从而使西方消费者也能够正确使用中草药。
中药欧盟注册之后将进入欧盟的OTC市场。所以,当我们研究欧盟中药市场规模的时候,应该细化分析欧盟OTC药物市场的规模,这样的结果会对评估中药在欧盟市场的规模更有意义。本文分别对2017年的欧洲OTC市场治疗咳嗽和感冒、治疗胃肠道疾病、治疗皮肤病和止痛药的销售额进行了介绍,希望这些数据为正确分析评估中药注册之后的欧盟OTC相应的药品市场提供帮助。
近年来,我国中药事业发展取得了巨大进步,对中药质量研究越来越深入,建立和实施了各种与国际接轨的中药质量标准,中药工业质量管理体系进一步完善,国家相关的法律法规对中药企业起着规范和引导作用。在这样的形势下,中药的单方制剂欧盟传统植物药注册取得突破已是必然,中药复方制剂以药品的身份进入欧盟也只是时间问题。它山之石可以攻玉。我们在这里介绍一些欧洲的植物药发展情况,就是希望我国的中药界能够了解、借鉴和学习别人的长处,促进自身的发展。我们对中药的未来充满信心。

