339株非结核分枝杆菌临床分离株菌种鉴定及耐药性分析
秦中华 景晔 杜岩青 宋晓梅 张丽霞
非结核分枝杆菌(non-tuberculous mycobacteria,NTM)指除结核分枝杆菌复合群和麻风分枝杆菌以外的分枝杆菌,迄今已发现170多种[1],同时还有新的种别不断被发现。与专性致病菌结核分枝杆菌和麻风分枝杆菌不同,绝大多数NTM是环境微生物,通常作为机会性病原体,引起局部(皮肤和软组织、淋巴结、骨骼、肺)或播散性感染[2]。从我国结核病流行病学调查资料显示,NTM分离率由1979年的4.3%上升至2000年的11.1%,到2010年的21.0%,反映了我国的NTM病呈明显上升的态势[3]。有研究显示,NTM对常用的治疗药品耐药,导致NTM病的治疗较为困难,且治疗效果不理想[4]。因此,笔者了解天津海河医院NTM病流行状况及耐药性特征,为临床NTM病的诊断和治疗提供参考。
资料和方法
一、 研究对象
天津市海河医院2014年3月至2019年3月应用“DNA微阵列芯片技术”进行菌种鉴定确定的339株NTM。菌株来源于同一患者多次送检样本不重复计算,且选择初次实验室结果纳入统计分析。其中包括痰271份,肺泡灌洗液49份,胸腔积液13份、肺组织穿刺研磨标本6份。
二、实验方法
(一)分枝杆菌培养及初步菌种鉴定
分枝杆菌培养采用BACTEC MGIT 960 系统及配套基础培养基(美国BD公司),阳性培养物采用对硝基苯甲酸(PNB)鉴别培养基(杭州创新生物技术有限公司)进行初步NTM鉴定。初步鉴定为NTM的菌株进行药物敏感性试验(简称“药敏试验”)及分枝杆菌菌种鉴定试验。
(二)药敏试验
药敏试验采用比例法,药品种类和浓度分别是异烟肼(0.2 μg/ml)、利福平(40 μg/ml)、链霉素(4 μg/ml)、乙胺丁醇(2 μg/ml)、对氨基水杨酸(1 μg/ml)、卡那霉素(30 μg/ml)、卷曲霉素(40 μg/ml)、氧氟沙星(3 μg/ml)。
(三)分枝杆菌菌种鉴定
1.方法:DNA微阵列芯片法。
2.仪器:PCR扩增仪、芯片杂交仪、芯片洗干仪(北京博奥生物有限公司);微型高速离心机(Eppendorf, 5424)。
3.试剂:分枝杆菌菌种鉴定试剂盒(北京博奥生物有限公司)。
4.操作步骤:参照说明书进行。
结 果
一、 NTM菌种的分布情况
临床分离的339株NTM菌株经菌种鉴定,排在前3位者分别为:胞内分枝杆菌131株,占38.6%;龟-脓肿分枝杆菌72株,占21.2%;堪萨斯分枝杆菌62株,占18.3%(表1)。
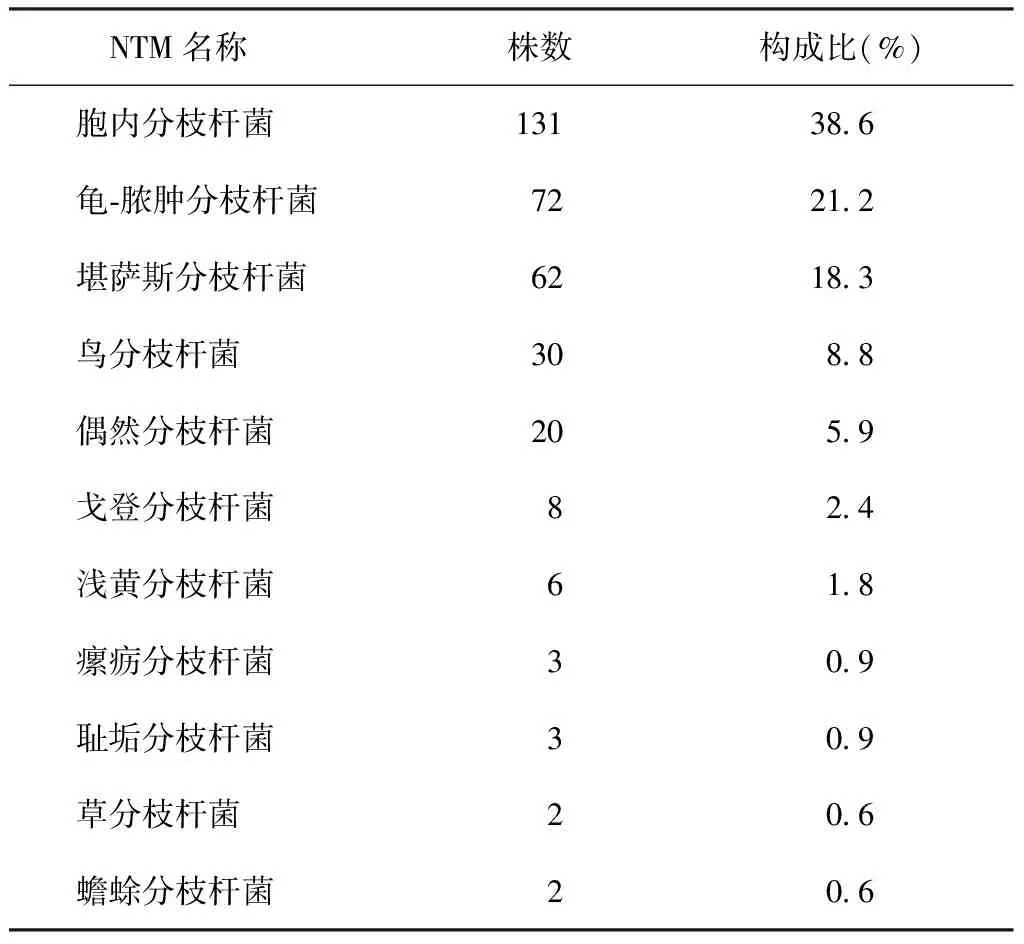
表1 339株NTM 菌种鉴定结果
二、不同NTM菌种的药敏试验结果
对罗氏培养出的菌株经“DNA微阵列芯片技术”进行菌种鉴定,并对鉴定出的NTM菌株用比例法对8种抗结核药品(异烟肼、利福平、链霉素、乙胺丁醇、对氨基水杨酸、卡那霉素、卷曲霉素、氧氟沙星)进行药敏试验,结果:胞内分枝杆菌对上述药品的耐药率分别为95.6%、82.3%、94.7%、54.0%、92.0%、81.3%、85.3%、87.5%;堪萨斯分枝杆菌对上述药品的耐药率分别为100.0%、3.7%、98.1%、11.1%、95.0%、90.0%、27.5%、13.8%;龟-脓肿分枝杆菌对上述药品的耐药率分别为96.9%、93.8%、95.3%、92.2%、88.4%、86.0%、88.4%、87.1%(表2)。
讨 论
NTM广泛存在于水、土壤和灰尘等自然环境中,某些NTM(如鸟分枝杆菌、蟾蜍分枝杆菌、偶然分枝杆菌和龟分枝杆菌)对消毒剂及重金属耐受,使其生存于饮水系统中,其大部分为腐物寄生菌。在供热、供水管道中可分离到嗜热的蟾蜍分枝杆菌、耐热分枝杆菌和缓黄分枝杆菌等。NTM病以潮热地带为多见,人和某些动物均可感染。目前尚未发现动物传染人以及人与人之间传播的证据。现在普遍认为,人可从环境中感染NTM而致病,水和土壤是重要的传播途径[12]。迄今已发现170余种 NTM,其中 37 种已见致病报道[5]。随着检测手段的提高NTM的分离率逐年上升[3],同时NTM病患者在临床症状、影像学表现等方面与肺结核都十分相似,往往导致临床医生错误判断;使得需要很长的治疗时间,但是治疗效果较差。所以,如何快速准确地检测确定是否为NTM感染就显得尤为重要。目前,国内外大多数实验室采对用硝基苯甲酸/噻吩-2-羧酸肼(PNB/TCH)生长实验作为初步鉴别NTM的方法,操作简单,费用低廉[6],但其报告时间长,且只能初步筛选NTM,无法满足临床的需求。本研究采用DNA微阵列芯片法进行NTM菌种鉴定,可在短时间提供临床菌种信息,从而使经验用药改为目标用药,为临床精准治疗提供依据。
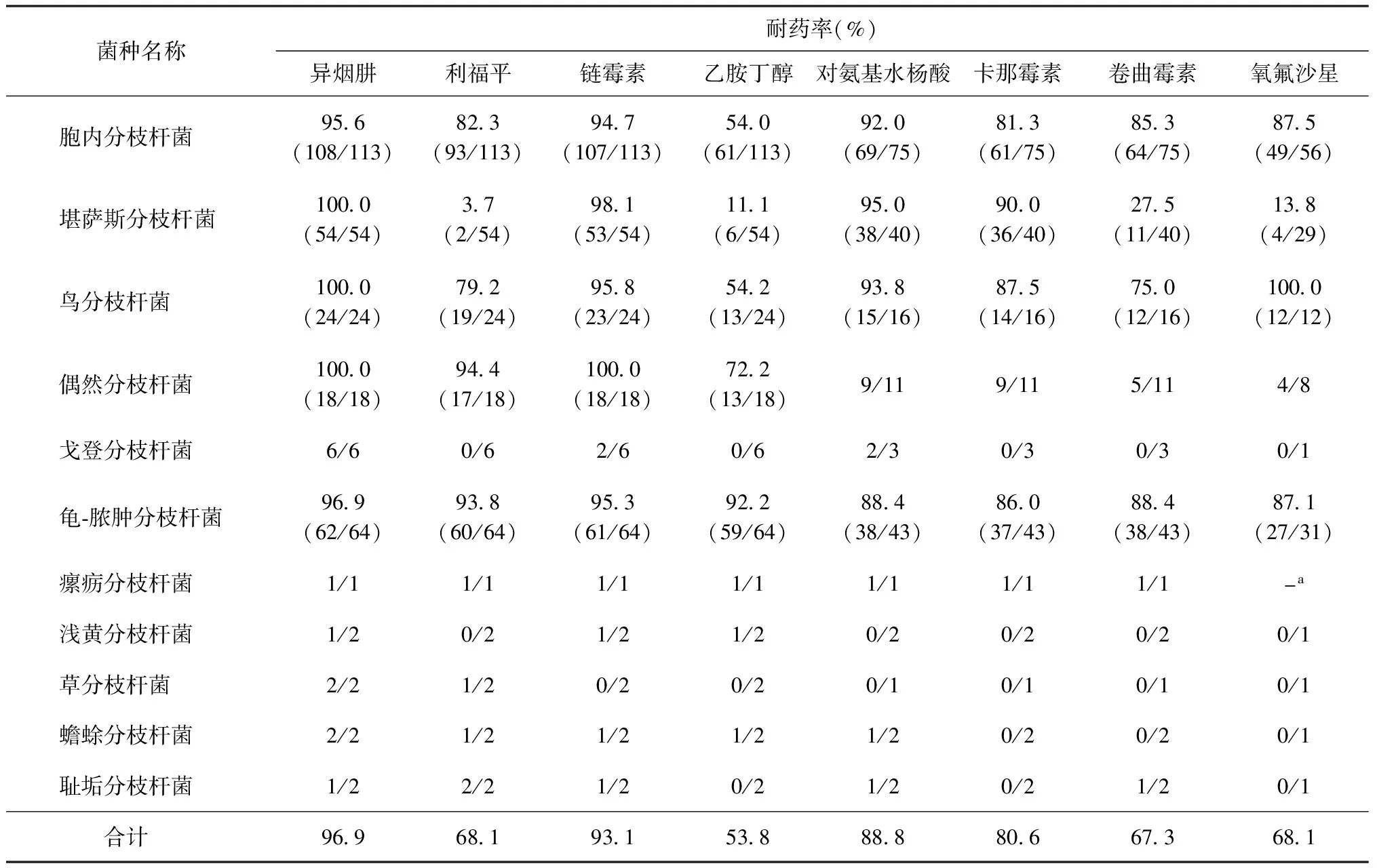
表2 339株NTM临床分离株中不同菌种对常用药品的耐药率
注表中小括号内数值分子为 “耐药菌株数”,分母为“检测菌株数”。菌株数<15株的菌种采用“耐药菌株数/检测菌株数”表示;a:未检测
本研究发现临床分离出的339株NTM主要是胞内分枝杆菌(38.6%)、龟-脓肿分枝杆菌(21.2%)、堪萨斯分枝杆菌(18.3%),与吴海良等[7]统计的山东地区NTM菌种病原谱分布情况一致,与广东地区[8]、上海地区[9]报告的 NTM菌种分布资料不同。这可能是地区性差异或临床分离株数量少[9]、病种分布不同所造成。
多数NTM对抗结核药品耐药,用抗结核药品治疗疗效不佳。而NTM细胞表面的高疏水性及细胞壁通透屏障是其广谱耐药的生理基础,是有效化疗的障碍。为了克服药品进入细胞的屏障,主张应用破坏细胞壁的药品(如乙胺丁醇)与抑制细菌蛋白质(酶)的合成的药品(如链霉素)、阻碍细菌mRNA合成的药品(如利福平)联用。其原因为链霉素和利福平都是杀菌药,链霉素的主要作用机制是通过阻止氨基酰tRNA与细菌核糖体30S亚单位的结合,从而抑制蛋白质合成时肽链的移位;利福平亲脂性高,很容易通过分枝杆菌的细胞膜,通过与DNA依赖的RNA聚合酶β亚基的rpoB基因结合从而抑制转录。乙胺丁醇是一个抑菌药,对分枝杆菌细胞壁的破壁作用,有效地促进了其他药品进入细菌体内的速度,提升了胞内的药品浓度,与其他的抗结核药品有协同的作用,而且可以延缓其他药品耐药性的产生。大多数 NTM 对常用的抗分枝杆菌药品耐药,因此,NTM病的治疗较为困难,且疗效大多不理想[10]。本研究数据显示,临床分离的NTM菌株对一线、二线抗结核药品总的药耐率在50%以上,这与吴海良等[7]报道的山东地区和张娟等[11]报道的沈阳地区NTM临床耐药情况基本一致。
本研究数据显示,作为主要临床NTM分离株的堪萨斯分枝杆菌对乙胺丁醇、利福平、卷曲霉素、氧氟沙星具有很好的敏感性,这与中华医学会结核病学分会《非结核分枝杆菌病诊断和治疗》[12]专家共识推荐,对未经治疗的堪萨斯分枝杆菌病患者,仅需进行利福平药敏试验的指导意见一致;但胞内分枝杆菌和龟-脓肿分枝杆菌对上述药品均具有较高的耐药性,提示临床进行经验治疗过程中应该注意药品的选择和菌种的鉴定。
综上所述,随着临床重视度及实验室诊断技术的不断提高,NTM临床分离率呈现逐年增高趋势,同时感染后临床表现与结核分枝杆菌临床表现极为相似,但对常用抗结核药品又大部分具有耐药性,因此对NTM进行快速准确的鉴定和药敏试验有助于精准地对NTM病实施临床治疗。

