2015—2019年西安市680例耐多药结核病患者耐药情况分析
马进宝 任斐 曾令城 陈明伟
世界卫生组织(WHO)《终止结核病策略》提出到2035年要将因结核病死亡率降低95%,而耐药结核病将是我们面对的挑战之一[1]。耐多药结核病(MDR-TB)治愈率较低,国内文献报道MDR-TB治疗成功率为50%~65%左右[2-4]。制定合理的化疗方案是MDR-TB治疗成功的基础,在制定MDR-TB化疗方案时,应掌握本地区耐药监测资料,充分评估本地区耐药患者的例数、类型和发展趋势,以便有把握地挑选用于耐药结核病治疗的药品[5]。西安市胸科医院是西安市14个区(县)耐药结核病定点收治医院,承担着西安市地区耐药结核病的筛查、治疗和管理工作。笔者对西安市2015—2019年确诊的MDR-TB患者对乙胺丁醇(EMB)、链霉素(Sm)、丙硫异烟胺(Pto)、阿米卡星(Am)、卷曲霉素(Cm)、对氨基水杨酸钠(PAS)、左氧氟沙星(Lfx)、莫西沙星(Mfx)等药品的耐药率及其变化情况进行分析,为制订MDR-TB患者的抗结核药品治疗方案提供依据。
资料和方法
一、 研究对象
收集2015年1月至2019年12月西安市14个区(县)和西安市胸科医院诊断为MDR-TB的患者共680例为研究对象,其中男472例(69.4%),女208例(30.6%);年龄7~84岁,中位年龄32岁;初治346例,复治334例。
二、 液体培养及药物敏感性试验(简称“药敏试验”)
1.具体方法:采用BACTEC MGIT 960培养系统(美国BD公司产品;简称“MGIT 960”)进行液体培养,参照《结核分枝杆菌药物敏感性试验标准化操作程序及质量保证手册》[6]操作。取处理好的痰标本0.5 ml加入MGIT 960液体培养管中,放入MGIT 960中进行培养,培养阳性标本,进一步用MPB64单克隆抗体(杭州创新生物检控技术有限公司)进行测定,对鉴定为MTB菌株进行表型药物敏感性试验(简称“药敏试验”)。一线抗结核药物INH、RFP、EMB、Sm的耐药性应用MGIT 960液体药敏试验检测,INH的浓度为0.1 μg/ml,RFP的浓度为1.0 μg/ml,Sm的浓度为4 μg/ml,EMB的浓度为2 μg/ml;二线抗结核药品耐药性应用比例法药敏试验检测,Lfx的浓度为2 μg/ml,Mfx的浓度为2 μg/ml,Am的浓度为30 μg/ml,Cm的浓度为40 μg/ml,Pto的浓度为40 μg/ml,PAS的浓度为1 μg/ml。
2.质量控制(简称“质控”):(1)MGIT 960液体药敏试验使用1麦氏单位标准菌株(H37Rv,来自每年度MTB药物敏感性试验熟练度测试时中国CDC发放的菌株)稀释10倍后做工作液,接种0.5 ml工作液到对照培养基,工作液稀释100倍后接种到含药培养基;若药敏试验结果均为敏感,则质控合格。(2)比例法药敏试验检测使用1麦氏单位标准菌株(同上),将工作液菌悬液按1∶100稀释得到10-2菌悬液,将10-2菌悬液按1∶100稀释得到10-4菌悬液,分别接种于含药培养基及中性培养基,若药敏试验结果均为敏感,则质控合格。实验室室内质控合格后进行正常试验。本院实验室2015—2019年度全国MTB药敏试验熟练度测试(室间质评)结果均为优秀。
三、相关定义
根据化疗史分为初治与复治患者。
初治患者指有下列情况之一者:(1)从未因结核病应用过抗结核药品治疗的患者;(2)正进行标准化疗方案规律用药而未满疗程的患者(登记分类以治疗开始时为准);(3)不规则化疗未满1个月的患者[7]。
复治患者指有下列情况之一者:(1)不合理或不规律应用抗结核药品治疗≥1个月的患者;(2)初治失败和复发患者[7]。
四、数据收集
由2名经过培训的住院医师查阅MDR-TB患者的住院及随访病历,并对所记录结果进行交叉核对。
五、统计学处理
使用SPSS 18.0软件进行统计学分析,计数资料组间比较采用卡方检验,以P<0.05为差异有统计学意义。
结 果
一、2015—2019年西安市不同MDR-TB类别患者耐药情况分析
680例MDR-TB患者对Sm、EMB、Lfx、Mfx的耐药率较高,分别为85.7%、37.5%、40.1%、31.3%;对Am、Cm、Pto、PAS的耐药率较低,分别为4.4%、4.3%、4.6%、14.4%。初治患者中对EMB、Am、Lfx 等3种药品的耐药率低于复治患者,其差异有统计学意义(P值均<0.05);初治患者中对Mfx、Cm、Pto 等3种药品的耐药率低于复治患者,但差异差异无统计学意义(P值均<0.05);初治患者中对Sm及PAS的耐药率高于复治患者(表1)。
二、2015—2019年西安市MDR-TB患者对8种药品的耐药率变化情况
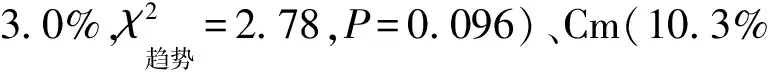
三、 二线药物交叉耐药情况分析
对Am耐药的30例中有21例(70.0%)对Cm耐药,对Cm耐药的29例中有21例(72.4%)对Am耐药,Am和Cm呈高度交叉耐药(表3);对Lfx耐药的273例中有205例(75.1%)对Mfx耐药,对Mfx耐药的213例中有205例(96.3%)对Lfx耐药(表4)。
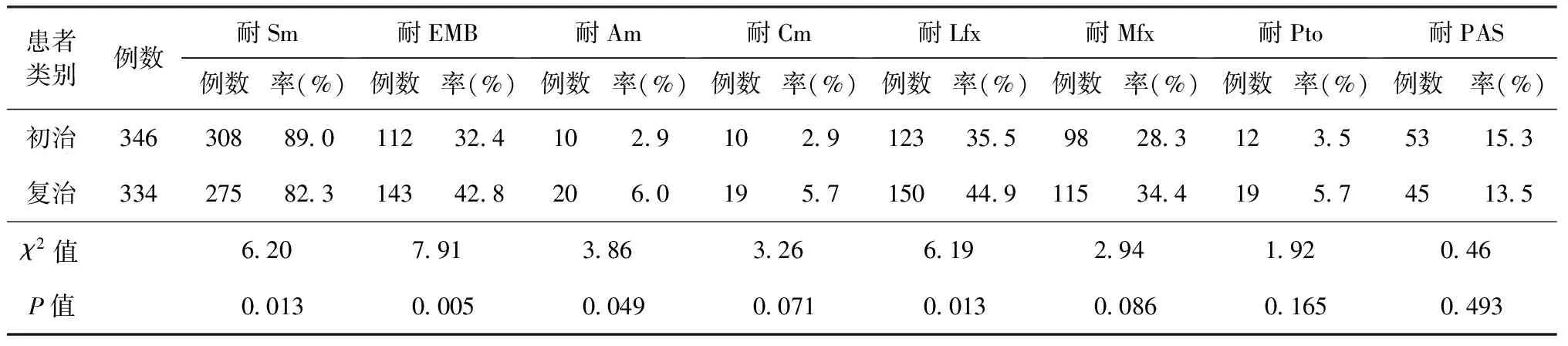
表1 2015—2019年西安市初、复治MDR-TB患者对8种药品的耐药性检测结果分析
注Sm=链霉素;EMB=乙胺丁醇;Am=阿米卡星;Cm=卷曲霉素;Lfx=左氧氟沙星;Mfx=莫西沙星;Pto=丙硫异烟胺;PAS=对氨基水杨酸钠
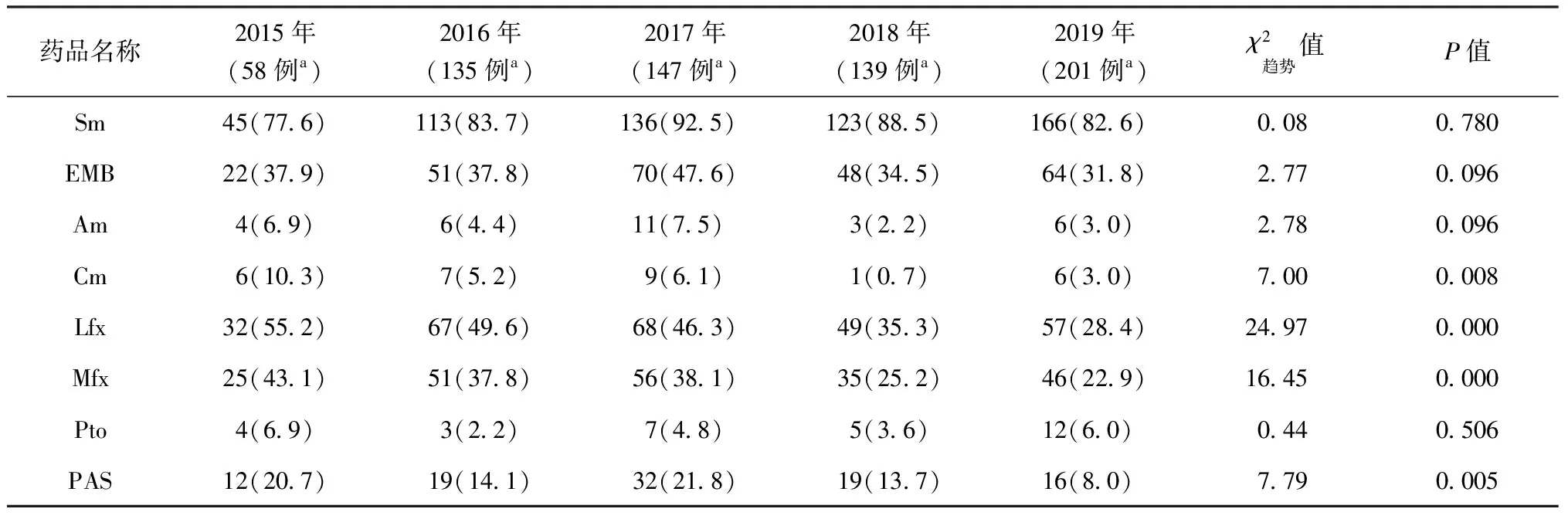
表2 西安市MDR-TB患者对8种药品的耐药率在2015—2019年间的变化情况
注Sm=链霉素;EMB=乙胺丁醇;Am=阿米卡星;Cm=卷曲霉素;Lfx=左氧氟沙星;Mfx=莫西沙星;Pto=丙硫异烟胺;PAS=对氨基水杨酸钠。a:MDR-TB患者例数。表中括号外数值为”耐药患者例数”,括号内数值为”耐药率(%)”

表3 2015—2019年西安市对阿米卡星(Am)和

表4 2015—2019年西安市对左氧氟沙星(Lfx)和
讨 论
陕西省仅49%的县(区)医院开展了MTB分子生物学检测,56%的县(区)医院开展了MTB培养[8],可见陕西省内结核病相关实验室建设还较薄弱,导致大部分结核病患者基于经验性用药。本研究回顾性分析了2015—2019年西安市MDR-TB患者对抗结核药品的耐药情况,希望对西安市MDR-TB患者的用药提供参考。
本研究显示,西安市MDR-TB患者对一线抗结核药品Sm、EMB的耐药率较高,结果与赵冰等[9]对全国耐药基线调查的结果基本一致,且上述2种药品的耐药率在2015—2019年内未见明显变化,因此在选择药物时不应优先考虑该2种药品来组成化疗方案。我国《耐药结核病化学治疗指南(2019)》[10]中亦指出,如果经过评估EMB达到了有效药品的标准,可以考虑将其加入治疗方案中,但不应作为核心药品。
氟喹诺酮类药品对MTB有较强的杀菌作用,其在耐药结核病的治疗中占有重要地位,WHO[11]2019年耐药结核病治疗指南中将氟喹诺酮类药品置于A组。本研究结果显示,5年内西安市MDR-TB患者对Lfx、Mfx的耐药率较高,分别达40.1%、31.3%;其高耐药率可能与氟喹诺酮类药品在呼吸和结核领域的滥用及MTB对其耐药稳定性较强有关[12],因此在选用氟喹诺酮类药品时应尽量获得氟喹诺酮类药品的药敏试验检测结果。研究发现,熔解曲线检测氟喹诺酮类药品耐药性有较高的敏感度及特异度[13],有条件的医院可早期使用熔解曲线进行氟喹诺酮类药品的耐药性检测。在缺乏药敏试验检测结果的情况下,考虑低代及高代氟喹诺酮类药品的耐药率,选择高代氟喹诺酮药品更有把握组成有效的抗结核药品治疗方案。
《耐药结核病化学治疗指南(2015)》[14]中指出注射剂是MDR-TB患者治疗方案中第一步选择的药品,而《耐药结核病化学治疗指南(2019)》[10]将注射剂归入C组药品,本研究显示西安市对Am及Cm的耐药率均较低,考虑到本研究结果,在对上述2种药品进行药敏试验的检测结果显示敏感时仍是较好的可选药品。《耐药结核病化学治疗指南(2019)》[10]中指出,Am和Cm有交叉耐药性;本研究发现耐Am菌株70.0%对Cm耐药,回顾本研究中同时耐Am及Cm的21例患者,发现其中19例仅有Am的暴露史,Am耐药率结果与曹广云等[15]及Du等[16]研究结果基本一致;但与车洋等[17]报道的44%耐药率及何贵清等[18]报道的60%耐药率不同。因此,对于Am耐药的MDR-TB患者,仍有使用Cm的空间,但不应作为首选药物。
MTB的inhA基因突变时,对Pto和INH有交叉耐药性[19];Huo等[20]研究认为,既往有Pto暴露史会增加inhA基因的突变率,从而增加对INH及Pto的耐药率;本次研究对Pto的5年内(2015—2019年)耐药率均较低,因此确定患者无inhA基因突变及Pto暴露史,即使缺乏对Pto的药敏试验检测,仍可以选择Pto作为有效的抗结核药品使用。
本研究中2019年较2015年西安市MDR-TB患者对二线抗结核药品的耐药率均有所下降;党丽云等[21]研究显示,本地区耐药率呈现下降趋势,研究者考虑这可能与近年来医保政策的广泛推广、医疗资源投入增加、医疗水平提高,使大部分患者能够得到规范化治疗有关。Lu等[22]研究发现,我国西北地区对二线抗结核药品的耐药率高于中东部,考虑这种差异与社会经济发展水平相关。因此,更多的经济投入和医保政策的推广对降低二线抗结核药品的耐药率将是有利的。
本研究分析了西安市2015—2019年MDR-TB患者除异烟肼与利福平外对8种抗结核药品的耐药情况,为本地区MDR-TB患者制订抗结核药品治疗方案提供参考,尤其为缺乏对二线抗结核药品药敏试验检测结果时的经验性用药提供了参考。本研究为回顾性研究,是为不足之处,可能会产生回顾性偏倚;另外,未能分析西安不同地区的耐药情况也是本次研究的不足之处。

