95%草铵膦原药对穗状狐尾藻的毒性效应
刘火娟
(上海市农药研究所有限公司,上海 201702)
随着环境问题越来越突出,水资源保护越来越被人们重视,通过利用植物改善水资源的研究越来越多。狐尾藻(Myriophyllum verticillatum),小二仙草科(Haloragaceae),为多年生草本沉水植物[1],近年各类研究表明,狐尾藻具有水质净化的作用[2-3]。草铵膦为膦酸类非选择性接触型除草剂,也是广泛应用的除草剂品种之一,该剂不溶于有机溶剂,易溶于水。因此,研究草铵膦对狐尾藻毒性影响,对于今后合理使用该农药有很大的参考价值。本研究测定了95%草铵膦原药处理14 d时对穗状狐尾藻茎、根、整株植物的长度、鲜重和干重的平均生物量增长量和平均生长速率的半效应抑制浓度,以明确该农药对穗状狐尾藻的毒性效应。
1 试验材料及方法
1.1 供试药剂与试验材料
1.1.1 穗状狐尾藻培养
穗状狐尾藻在试验前需进行预培养。剪取狐尾藻顶芽插入配制好的底泥中,每个花盆栽入4棵。将花盆放入培养缸中,加入Smart and Barko培养基(见表 1)没过狐尾藻约 10 cm,在试验条件下培养7 d。预培养结束后,从每个花盆中拔除与其他3棵生长状况差距较大的1棵狐尾藻,其余狐尾藻备用。
1.1.2 供试药剂
95%草铵膦原药(上海市农药研究所有限公司)。
1.1.3 试验仪器
AUY220岛津电子天平、玻璃花盆(内直径8 cm、内高9 cm)、圆玻璃缸、泥炭藓、玻璃培养缸、自制光照灯架、光照植物培养架、烘箱、溶解氧仪、温湿度计、pH计、光合有效辐射计、照度计、移液枪及配套枪头。
1.1.4 试验用培养基
本试验采用Smart and Barko培养基,配方见表1。
分别按表1浓度配制A、B、C、D 4种溶液,量取A、B、C、D溶液各30 mL用纯水稀释至30 L,搅拌均匀后用1 mol/L的HCl调节其pH至7.5~8。
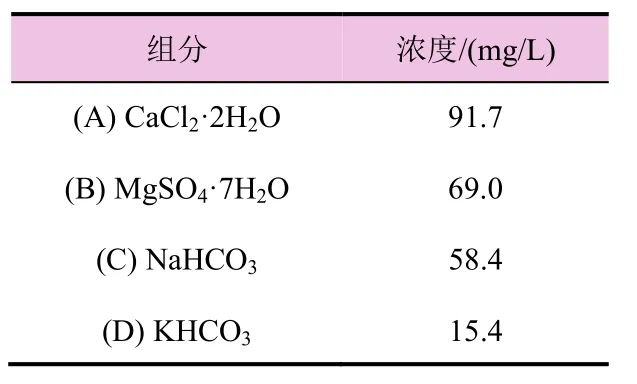
表1 Smart and Barko培养基配方
1.1.5 试验用土
由标准土和营养土构成底泥,配方比例见表2。

表2 人工土配方
将1.8 g Na3PO4、0.9 g NH4Cl溶解于纯水后与混合均匀的营养干土搅拌均匀,两种人工土均调节pH 至 6.5~7.5。
1.1.6 试验环境条件
试验周期为 14 d,在试验期间光照强度为6 000~9 000 Lux,光照黑暗比设为16 h∶8 h,培养基pH为7.30~8.49,环境温度为19.0~22.0 ℃。
1.2 试验方法
1.2.1 穗状狐尾藻移植
将圆滤纸湿润后紧贴垫在玻璃花盆底部。首先向花盆底部装入1 cm厚的标准土,后装入4 cm厚的营养土,再覆盖1 cm厚的标准土,压实。从同一批次培养的狐尾藻中剪取粗细一致、健康、快速生长且生长完好的狐尾藻,剪取6 cm长的顶芽,下端3 cm去掉侧枝后插入底泥中按压栽好。在栽好顶芽的标准土上均匀覆盖一层1 cm厚的粗粒石英砂。
在摆放好栽有狐尾藻玻璃花盆的培养缸中注入Smart and Barko培养基,没过沉积物表面约10 cm。打开灯架光源,在试验规定的光照和温度下培养7 d,及时补加培养基。
1.2.2 供试药液制备
准确称取1.052 6 g 95%草铵膦原药至100 mL烧杯中,用Smart and Barko培养基溶解完全后倒入1 000 mL容量瓶中,用Smart and Barko培养基定容,超声10 min,混匀后过0.45 μm水系滤膜,摇匀后得到1 000 mg a.i./L的母液。依次量取480、240、80、26.640、8.880、2.960、0.988 mL母液至圆玻璃缸中,后用Smart and Barko培养基分别稀释至8 L并混合均匀,得到7个不同浓度的药液。将每个浓度的药液分别加入2 000 mL高型烧杯中,每个烧杯1 800 mL,每个浓度设4个重复。同时设置包含6个重复的空白对照组。
1.2.3 染毒
将所有花盆从培养缸中取出,倒去花盆内残存的培养基。从每盆4棵狐尾藻中拔除与其他3棵生长状况差距较大的1棵,用自制夹勾随机勾取盛有狐尾藻的花盆缓缓沉入装有药液的烧杯中。将所有烧杯随机摆放在光照培养架上。试验7 d时更换药液,将所有重复的花盆连同狐尾藻一并从烧杯中取出,将烧杯清洗干净后对应装入新配制药液,最后将花盆放回原来的烧杯中。
1.2.4 观察记录
试验0 d,随机抽5盆狐尾藻测量茎长、根长、植物总长,称量茎叶、根和植物总的鲜重、干重。试验开始0、7、14 d测定各重复培养液的溶解氧、pH、培养基表面的光强,并记录狐尾藻的生长情况。每天测量培养液水温。试验14 d时检查所有烧杯,测量狐尾藻茎长、根长、植物总长,称量茎叶、根和植株的鲜重、干重。
1.3 测量结果及数据处理
1.3.1 指标测量方法
茎长为主茎长与侧枝长长度之和。根长是根垂直从上到下的长度。植物总长为茎长与根长之和。茎叶鲜重、根鲜重均为冲洗干净吸水纸吸干多余水分后的重量。总鲜重为茎叶鲜重与根鲜重之和。
1.3.2 数据处理
生长速率是指植物各指标的对数随时间的变化。处理组和对照组中的每一个重复计算得出一个生长速率值,每个处理组和控制组得到一个平均植物生长速率值,按公式⑴计算:

式中:μi-j为从试验开始时间i到结束时间j的平均生长速率;Ni为在时间 i时处理组或对照组的测量值;Nj为在时间j时处理组或对照组的测量值;t为从i到j的时间。
平均生长速率抑制率(Ir)按公式⑵计算:
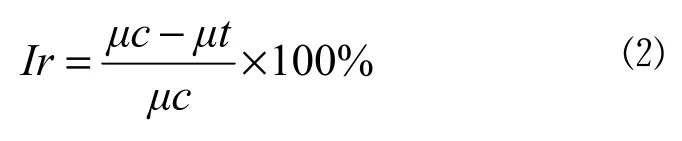
式中:Ir为植物平均生长速率抑制率(%);μc为空白对照组植物生长速率平均值;μt为处理组植物生长速率平均值。
平均生物量增长量抑制率(Iy)按公式⑶计算:

式中:Iy为平均生物量增长量抑制率(%);bc为空白对照组生物量增长量,即对照组最终生物量与0 d生物量之差;bt为处理组生物量增长量,即处理组最终生物量与0 d生物量之差。
ErC50为平均生长速率抑制百分率半效应浓度,EyC50为平均生物量增长量抑制百分率半效应浓度。本试验采用 SPSS21.0数据分析处理软件对试验过程中穗状狐尾藻各项指标平均生长速率抑制百分率(Ir)和平均生物量增长量抑制百分率(Iy)数据进行处理,得到穗状狐尾藻14 d各项指标ErC50、EyC50及其对应的95%置信区间。
2 结果分析与讨论
测量不同浓度药液中穗状狐尾藻茎长、根长、植物总长、茎叶鲜重、根鲜重、总鲜重、茎叶干重、根干重、总干重,计算得到上述指标对应的平均生长速率抑制率及平均生物量增长量抑制率,可以明确得到不同浓度草铵膦水溶液对穗状狐尾藻生长的影响。
以草铵膦药液浓度为横坐标,穗状狐尾藻各指标平均生长速率抑制率为纵坐标,绘制折线图,见图1。
由图1可知,各指标的平均生长率抑制率随草铵膦药液浓度的变化趋势相同,随着浓度不断的增加,各指标的平均生长速率抑制率不断增加,但是对比可以发现不同指标平均生长率抑制率存在一定的差别。在所有的指标中草铵膦药液对总干重和茎叶干重的抑制率最高,而对根长的抑制率最低,茎叶鲜重、总鲜重的抑制率基本一致,茎长和总长抑制率基本一致,这是由于茎的长度和重量远大于根,所以植株总长、总鲜重、总干重的各项指标毒性数值与茎叶各项指标的毒性数值较接近。
以草铵膦药液浓度为横坐标,穗状狐尾藻各指标平均生物量增长量抑制率为纵坐标,绘制折线图,见图2。
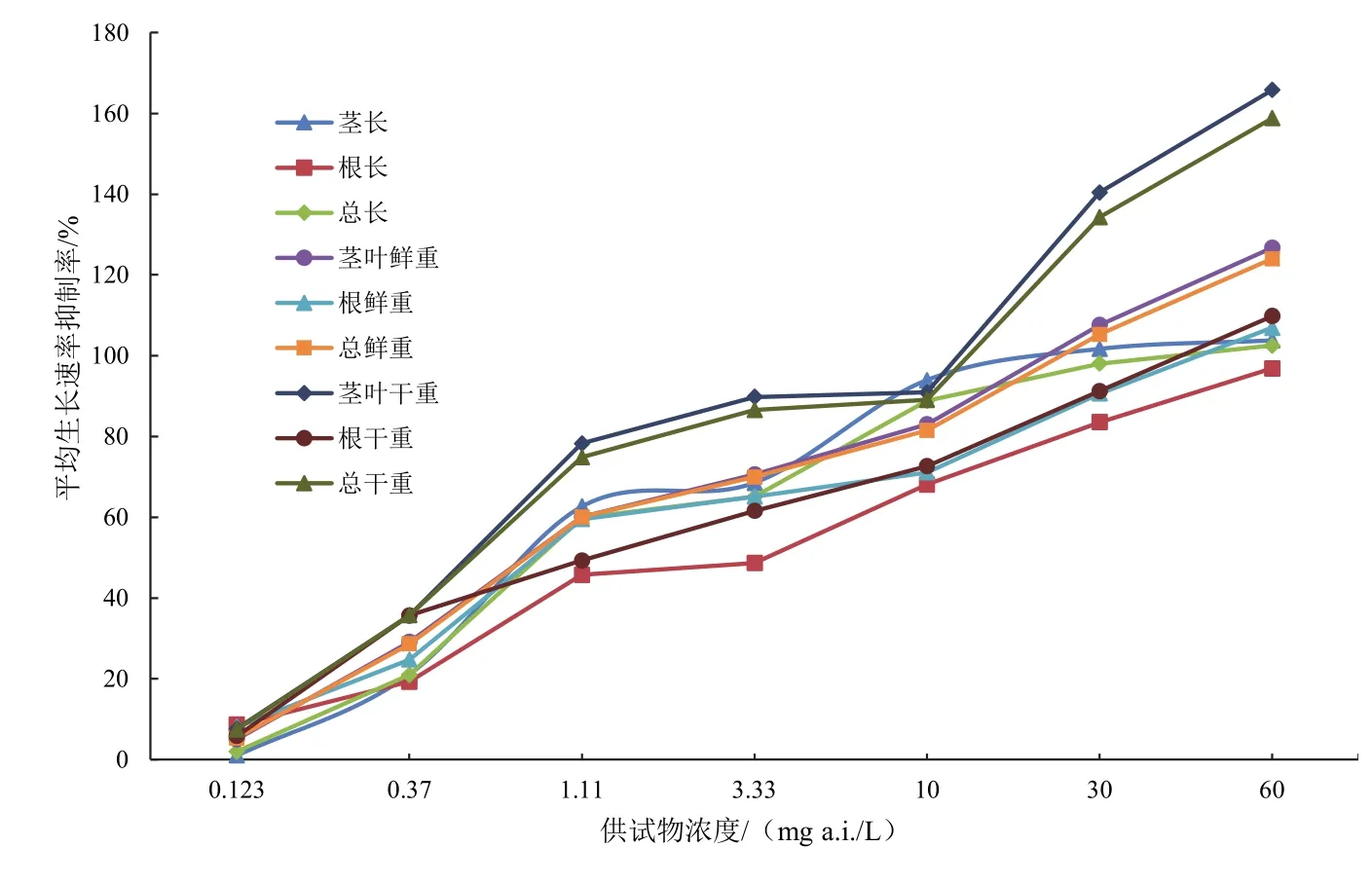
图1 不同浓度草铵膦水溶液对穗状狐尾藻各指标平均生长速率抑制率
由图2可知,各指标的平均生物量增长量抑制率随草铵膦药液浓度的变化趋势相同,随着浓度不断的增加各指标的平均生物量增长量抑制率不断增加,不同指标间的抑制率存在一定的差异。在所有指标中草铵膦药液对茎叶干重和总干重的抑制率最高,对根长的抑制率最低,其余指标的平均生物量增长量抑制率基本一致。
图1、图2直观反应了不同浓度草铵膦药液对穗状狐尾藻的生长影响,可以看到无论是平均生长率抑制率还是平均生物量增长量抑制率都随着草铵膦药液浓度的增加变大,并且对茎叶的毒性最高,而对根的毒性相对较低。由此得出结论,草铵膦对于穗状狐尾藻的生长具有一定毒性效应。
再对试验穗状狐尾藻各指标平均生长速率抑制率及平均生物量增长量抑制率进行处理可以计算得到ErC50、EyC50及对应的置信区间结果,ErC50、EyC50可以直观体现95%草铵膦原药对穗状狐尾藻的毒性 效应。
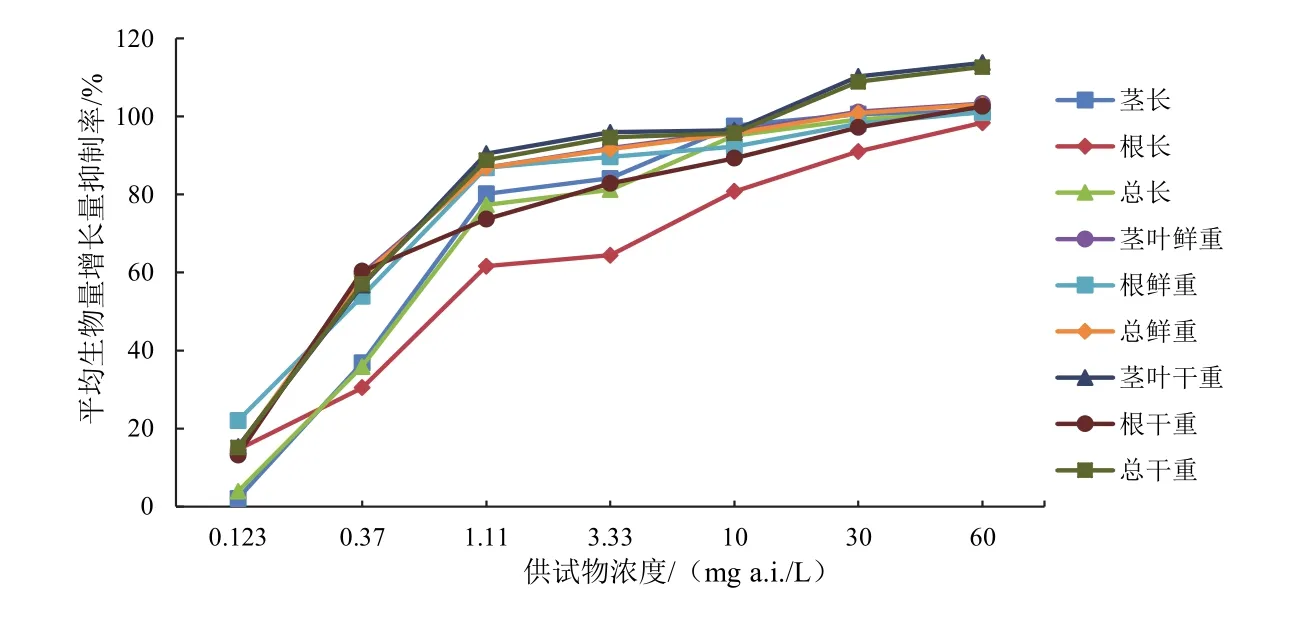
图2 不同浓度草铵膦水溶液对穗状狐尾藻各指标平均生物量增长量抑制率

表3 各指标ErC50、EyC50及对应置信区间结果
由表 5可知,草铵膦原药对穗状狐尾藻 ErC50略高于其对穗状狐尾藻EyC50,但是大体趋势相似。所有指标的半效应浓度均为0.3~2.5 mg a.i./L。
3 结 论
由试验数据计算及图表分析,得知穗状狐尾藻的茎叶对草铵膦的敏感性大于根对草铵膦的敏感性。随着草铵膦浓度的增大,茎叶逐渐开始变色直至坏死,但由于茎的长度和重量远大于根,所以植株总长、总鲜重、总干重的各项指标毒性数值与茎叶各项指标的毒性数值较接近,草铵膦作为常用的除草剂在使用时需要考虑对环境中水生植物造成的毒性影响,特别是像穗状狐尾藻这类可以吸收并富集重金属及持久性有机污染物的“有益植物”。

