短期高盐胁迫对脆江蓠抗氧化酶活性及光合酶活性的影响*
徐 涵 薛素燕 李加琦 丁敬坤 霍恩泽 张雯雯 毛玉泽 方建光
短期高盐胁迫对脆江蓠抗氧化酶活性及光合酶活性的影响*
徐 涵1,3薛素燕1,2李加琦1,2丁敬坤1,3霍恩泽1,3张雯雯1,3毛玉泽1,2①方建光1
(1. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 青岛 266071;2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 青岛 266071;3. 上海海洋大学水产与生命学院 上海 201306)
采用实验生态学方法,研究了脆江蓠()相关酶活性对短期高盐胁迫的响应,旨在为提高脆江蓠规模化养殖夹苗效率提供理论依据。实验设置5个盐度梯度(40、45、50、55和60),自然海水作为对照组,研究了高盐处理0.5 h及自然海水恢复12和24 h对脆江蓠抗氧化酶和光合酶活性的影响。结果显示,高盐胁迫0.5 h后,随盐度的升高,脆江蓠的抗氧化酶中,超氧化物歧化酶(SOD)活性逐渐升高(<0.05),过氧化物酶(POD)活性呈波动变化(<0.05),过氧化氢酶(CAT)活性逐渐降低但差异不显著(>0.05),丙二醛(MDA)含量随盐度升高显著升高(<0.01),上述抗氧化酶活性均在盐度50~55时出现极值;脆江蓠光合作用关键酶Rubisco活性随盐度升高逐渐降低(<0.01),碳酸酐酶(CA)含量随盐度增加略有增加(<0.05)。随恢复时间的增加,脆江蓠SOD、POD和CAT活性逐渐升高(<0.05),MDA含量显著降低(<0.05);Rubisco活性逐渐升高(<0.05),CA含量呈波动变化。研究表明,短期高盐胁迫显著影响脆江蓠藻体抗氧化酶和光合酶活性,藻体通过提高抗氧化酶活性以及加强对无机碳的吸收利用来应对高盐胁迫,胁迫去除后逐渐恢复至正常水平。
脆江蓠;高盐胁迫;抗氧化酶;光合酶
脆江蓠()是我国特有的暖水种经济红藻,具有较高的研究价值。前期研究表明,短期高盐海水浸泡脆江蓠使其藻体软化,用于实际夹苗生产的前处理方法是可行的,该方法夹苗牢固,对藻体损伤小,且可在短期内恢复正常。但高盐度诱发活性氧积累会造成海藻损伤,而海藻抗氧化系统清除活性氧能力在海藻耐盐能力中起着重要作用。对高等植物研究发现,盐胁迫可增加植物体内活性氧的产生,造成氧化胁迫(Heidari, 2011)。在大型红藻的研究中也发现,盐度胁迫会引起藻体内抗氧化酶活性的升高(李晓蕾等, 2019;Kumar, 2010)。抗氧化酶活性与藻类的抗逆性之间有着重要的相关性(Dummermuth, 2003)。在系统进化中,藻类进化出一套自由基清除系统来去除体内过多的氧自由基,抵抗氧化胁迫,从而避免藻体损伤。植物的抗氧化系统包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等酶促抗氧化系统和包括抗坏血酸、类胡萝卜素和脯氨酸等在内的非酶促抗氧化系统。
通常盐碱胁迫会减弱植物的光合作用,而藻类的生长发育及产量与光合作用密切相关(徐涵等, 2019)。高盐胁迫下,植物细胞发生水分亏缺,光合作用能力与叶绿体内的光合酶活性有关(Kaiser, 2015)。研究表明,细胞在缺水条件下,光合作用的下调与抗氧化酶的活性有关,此时,细胞内活性氧自由基(ROS)大量积累,抗氧化系统作用减弱,造成细胞膜脂过氧化损伤,从而导致了植物光合碳同化能力下降(闻志彬等, 2015)。植物光合碳同化途径可以随环境改变发生适应性变化(Hibberd, 2004),大型海藻的光合碳代谢除了C3途径外,通常还同时存在不一定完整的C4途径(芦笛, 2013)。作为C3途径的补充,C4植物具有高光合效率、低CO2补偿点、几乎没有光呼吸等特点(李卫华等, 1999),尤其在干旱、盐碱胁迫下,C4植物具有明显的生长优势及水分和营养利用率(Hatch, 1987)。
目前,有关盐度对脆江蓠影响的研究甚少,主要为低盐对脆江蓠生长、光合色素含量及抗氧化酶活性等影响方面的少数研究(金玉林等, 2012; 解修俊等, 2014)。但高盐胁迫对脆江蓠影响的研究还未见报道。本研究通过测定不同高盐度和不同处理时间对脆江蓠抗氧化酶以及光合作用相关酶含量的变化,探讨高盐胁迫对脆江蓠光合作用相关酶活性的影响以及脆江蓠抗氧化酶活性对短期盐度胁迫的调控作用,为大型藻类耐盐机制的研究提供数据参考。
1 材料与方法
1.1 材料
脆江蓠取自山东省青岛市城阳水产批发市场,低温运回实验室。选取生长状况良好,形态一致的藻体,灭菌海水反复冲洗至表面无杂质,GXZ智能光照培养箱(宁波江南仪器厂)预培养7 d。培养海水取自胶州湾养殖区(盐度为32, pH为7.99, 无机氮浓度为56.9 μmol/dm3, 无机磷浓度为2.16 μmol/dm3),1 L培养液放入1 g藻体,温度为(20±1)℃,光照强度为(70±10) μmol/m2·s,光照周期为12 L∶12 D。每天更换一次培养液。
1.2 浸泡处理
使用NaCl溶解于灭菌自然海水的方法,调节水体盐度至40、45、50、55和60。将脆江蓠浸泡于上述盐度海水中,光照培养箱培养(培养条件与暂养一致) 0.5 h后,置于自然灭菌海水中恢复12、24 h,每个处理设置3个重复。选取健康、生长一致藻体,无菌海水冲洗3次并吸干表面水分,进行酶活测定实验,自然海水作为对照组。
1.3 抗氧化相关酶活性的测定
脆江蓠SOD、POD、CAT和丙二醛(MDA)活性使用南京建成酶活试剂盒测定,具体方法参见试剂盒使用说明书。
1.4 光合碳代谢相关键酶活性的测定
脆江蓠1,5-二磷酸核酮糖羧化酶(Rubisco)活性使用索莱宝酶活试剂盒测定,碳酸酐酶(CA)活性使用Melson检测试剂盒测定,具体方法参见试剂盒使用说明书。
1.5 数据处理和统计学分析
使用Excel 2013进行数据处理;采用SPSS 17.0软件进行单因素方差分析(One-way ANOVA),使用Duncan法进行多重比较,<0.05为显著标准。
2 结果
2.1 高盐处理对脆江蓠抗氧化相关酶、MDA活性的影响
如图1~图4所示,盐度胁迫显著影响脆江蓠抗氧化酶活性及MDA含量(<0.05)。高盐处理0.5 h后,SOD活性随盐度升高,呈先降低后升高趋势(<0.05),盐度为55时达最大值。POD活性随盐度升高波动变化(<0.05)。CAT活性随盐度升高略有降低,但与对照组间差异不显著(>0.05)。MDA含量随盐度升高呈先降低后升高(<0.01),盐度为40时含量最低,盐度为55时达最大值。
恢复12 h后,脆江蓠抗氧化酶系统活性变化见图1~图4,随盐度的升高,SOD活性逐渐升高(<0.01)(图1),盐度为55时含量最高。POD活性随盐度升高呈与高盐处理0.5 h相反的趋势波动变化(<0.05)(图2)。CAT活性随盐度升高逐渐降低(<0.01)(图3),盐度为55时含量最低。MDA含量变化趋势与盐处理0.5 h相同(<0.01),较盐处理0.5 h含量低(图4)。
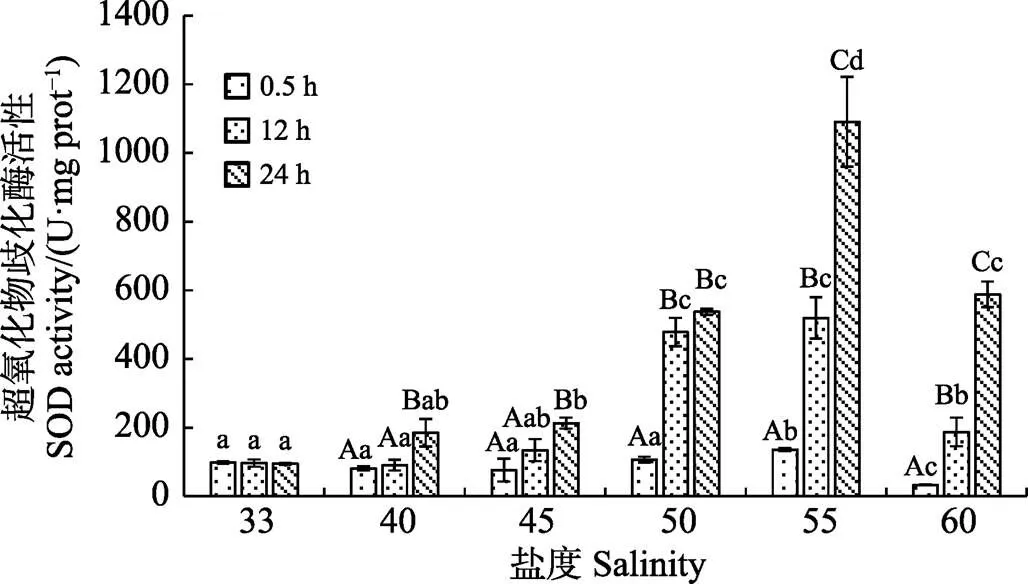
图1 盐度对脆江蓠超氧化物歧化酶活性的影响
不同小写字母表示同一处理时间下不同盐度处理组间差异显著(<0.05),不同大写字母表示同一盐度处理组在不同处理时间下差异显著(<0.05)。下同
Different lowercases indicate significant difference (<0.05) among different groups at the same time. Different uppercases lowercases indicate significant difference (<0.05) at different time point of the same group. The same as below
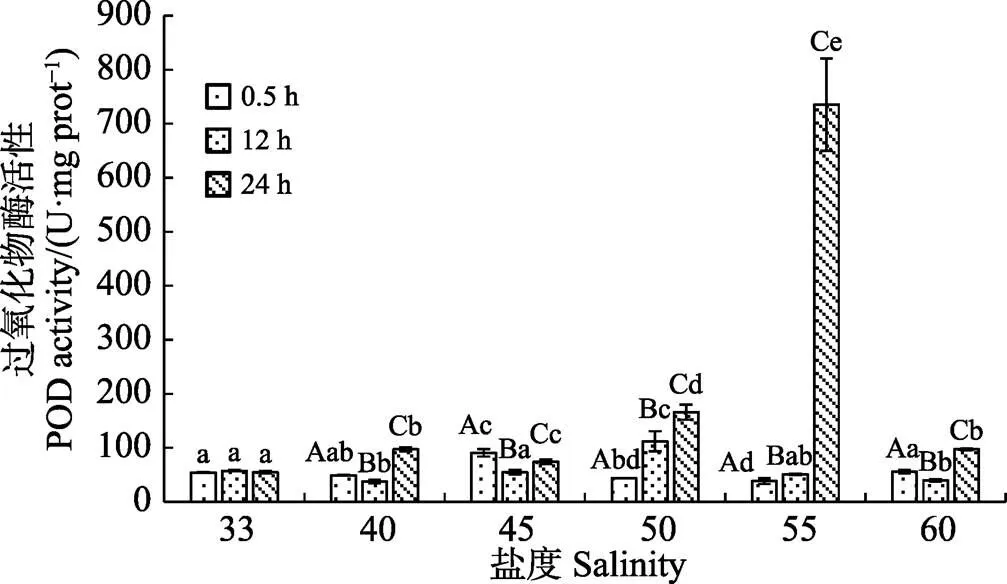
图2 盐度对脆江蓠过氧化物酶活性的影响
胁迫去除后,随恢复时间的增加,藻体内抗氧化酶活性显著升高(<0.01),MDA含量明显降低(图1~ 图4)。SOD活性随恢复时间的增加显著升高(<0.01),恢复24 h后,随盐度的增加显著升高(<0.01)。POD活性随恢复时间的增加而升高(<0.01),恢复24 h后,POD活性波动变化总体呈升高趋势(<0.05),盐度为55时达最大值。除盐度40组外,各盐度处理组CAT活性随恢复时间的增加而升高,盐度为50和55时最为显著(<0.01),且随恢复时间的增加而升高。MDA含量与盐处理0.5 h相比明显降低。

图3 盐度对脆江蓠过氧化氢酶活性的影响
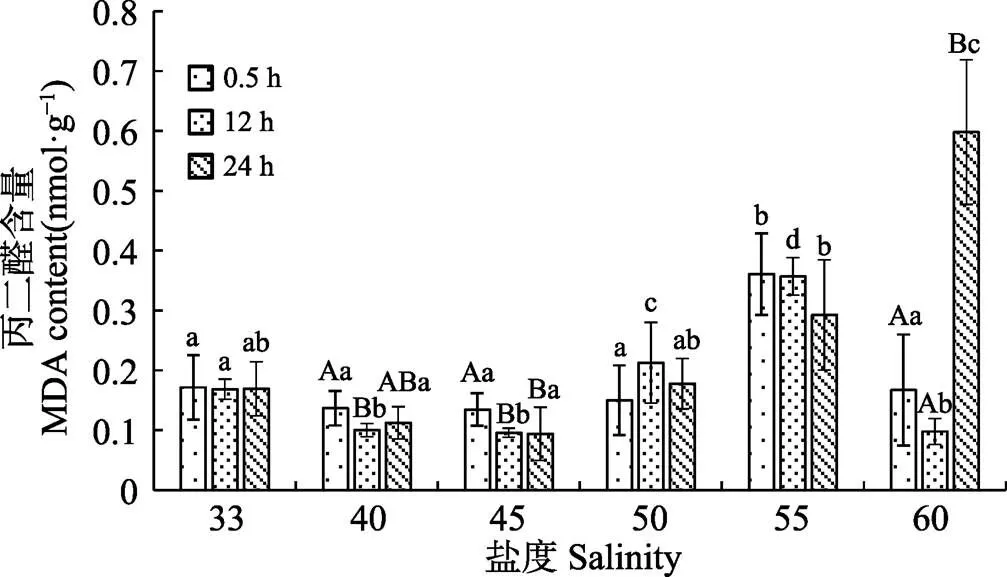
图4 盐度对脆江蓠丙二醛含量的影响
2.2 高盐处理对脆江蓠光合作用关键酶活性的影响
盐处理0.5 h及恢复24 h后脆江蓠Rubisco活性变化见图5。盐处理0.5 h后,随着盐度增加,Rubisco活性呈先增加后减少的趋势(<0.01)。经过24 h恢复,盐度为40、50及60组Rubisco活性显著增加(<0.01)。
盐处理0.5 h后(图6),盐度55组CA含量显著低于对照组(<0.05),其余各处理组与对照组相比CA含量有所增加。恢复24 h后,与盐处理0.5 h相比,盐度45、50和60组中CA含量开始降低,盐度为55组CA含量显著增加(<0.05)。
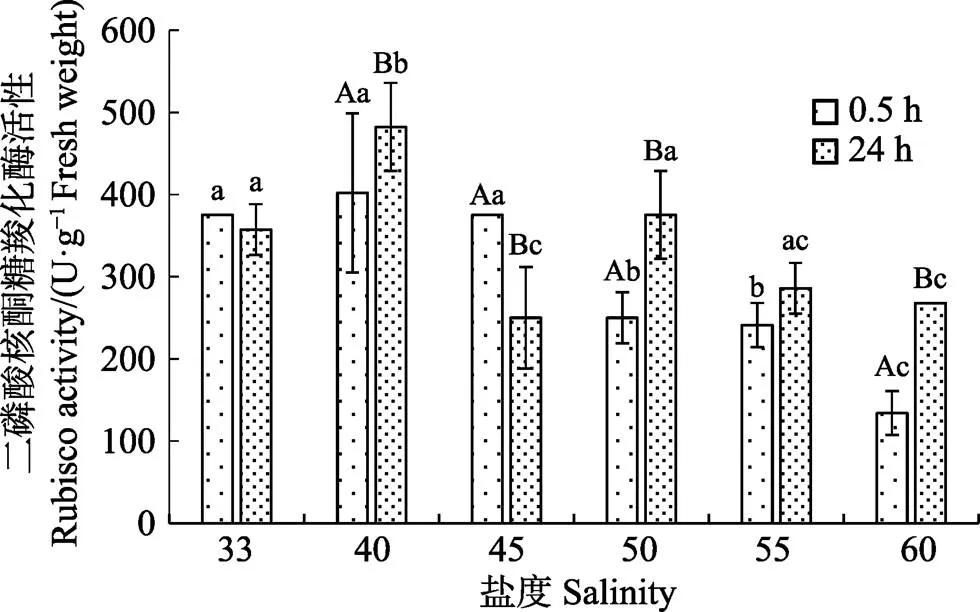
图5 盐度对脆江蓠二磷酸核酮糖羧化酶活性的影响
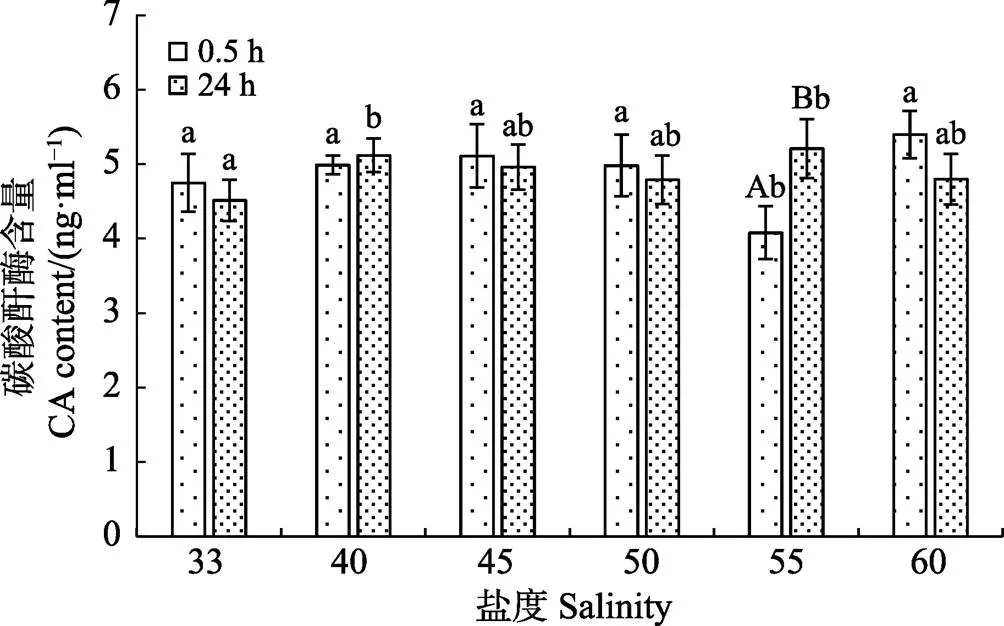
图6 盐度对脆江蓠碳酸酐酶含量的影响
3 讨论
3.1 脆江蓠抗氧化酶系统对短期高盐胁迫的调控作用
高渗透压胁迫下,在不同光、重金属等环境胁迫,大型藻类藻体会发生快速、强烈但短期的活性氧(ROS)猝发(Dring, 2005)。ROS的大量积累,会引起植物膜结构和功能的破坏、DNA突变及蛋白质降解(Bowler, 1992)等生物损伤。大型藻类在逆境胁迫下进化出一套自由基清除系统,通过增加细胞内抗氧化物、SOD、POD、CAT等抗氧化酶的含量清除过多的活性氧,减少细胞损伤(Dring, 2005)。本研究中,盐度处理0.5 h,藻体SOD活性在盐度为45以后随盐度增加而升高,盐度为55时达最大值,这与金玉林(2012)的研究结果相似。SOD是抗氧化酶抵御不良环境的第一道防线,其活性增加是对体内氧自由基增加的应急解毒措施(罗广华等, 1987),在一定盐度胁迫范围内,SOD活性可随胁迫强度的增加而升高,迅速清除ROS,从而达到对机体的保护作用。POD对环境变化尤其敏感(刘晓培等, 2012),但盐度胁迫需要依赖细胞的完整性才能诱导POD酶活性(柯德森等, 2006)。本研究中,POD活性随盐度增加呈波动变化,推测其原因可能是,藻体内积累的活性氧造成细胞膜结构和功能的破坏,POD不能完全发挥作用而导致的。CAT活性随盐度增加逐渐降低,可能是由于CAT酶蛋白更易受到损伤,这与高NaCl可引起螺旋藻CAT失活的结果相似(刘志礼等, 1998)。
当机体自由基清除系统不能及时清除大量ROS时,会产生大量的脂质过氧化产物MDA,其极易与细胞内各种成分反应,从而引起细胞膜及胞内酶的严重损伤,MDA是衡量脂质损害程度的重要指标 (王爱国等, 1986)。本研究中,盐处理0.5 h,盐度不超过45时,脆江蓠体内MDA含量随盐度升高呈先减少后增加的趋势,说明在一定范围内升高盐度,脆江蓠体内自由基清除系统能有效发挥作用,降低MDA含量。当盐度继续增加,机体来不及清除体内过多ROS,MDA含量随盐度增加而升高,与冯琛等(2004)对条斑紫菜的研究结果相一致。
盐度为60时,脆江蓠藻体SOD、POD以及CAT活性都显著降低。可能是藻体受到极端胁迫时,破坏了自由基清除系统,对生物体的保护功能降低 (王建华等, 1989)。当胁迫停止,随恢复时间的增加,藻体SOD、POD及CAT活性明显升高,MDA活性显著降低,表明胁迫去除后,抗氧化酶类活性增加,藻体保护系统又逐步恢复作用,大量清除ROS,藻体逐渐恢复。藻类抗氧化酶系统和抗逆性之间存在着重要的联系(Dummermuth, 2003),抗氧化酶系统或许可以作为藻类抗逆的指标,但对藻类抗氧化酶系统抵御盐度胁迫机制的了解还不够,还需进一步研究。
3.2 短时间高盐处理对脆江蓠光合作用相关酶含量的影响
盐碱胁迫通常会减弱植物的光合作用,细胞缺水条件下,光合作用的下调与抗氧化酶的活性有关,此时细胞内ROS大量积累,抗氧化系统作用减弱,造成细胞膜脂过氧化损伤,从而导致了植物光合碳同化能力下降。影响光合作用的各种生态因子都通过Rubisco而起作用(Brüggemann, 1992)。本研究中,盐处理0.5 h后,轻微的盐度增加,使藻体Rubisco活性有所增加,可能是因为轻微盐度刺激ATP和呼吸产生的还原能量,增强了藻体解毒系统对活性氧释放的反应活性。盐度超过40,Rubisco活性随盐度增加显著降低,可能是因为氧化的Rubisco是一种更好的蛋白酶底物,盐度胁迫可能会增强AOS造成的Rubisco降解(Ishida, 1997)。Rubisco可以通过调节光合作用和光呼吸来决定光合效率,高盐胁迫可能限制了藻体ATP的供应,影响了活化酶对Rubisco的激活,使Rubisco活性下降,进而对胁迫下的光合作用产生调控。有研究认为,在盐度胁迫下,鱼腥藻() Rubisco蛋白表达量增加,可能是由于离子胁迫和氧化损伤的积累效应(Rai, 2013)。大多数红藻对CO2和HCO3–都能利用(Maberly, 1990),CA与大型海藻高效的CO2浓缩机制(CCM)密切相关。CA通过催化CO2和HCO3–之间的相互转化,加速无机碳向羧化酶活性部位的扩散,还能增加1,5-二磷酸核酮糖(RuBP)的羧化活性,降低其加氧活性,从而提高CO2的固定速率。本研究中,盐处理0.5 h,盐度45以后,脆江蓠体内CA含量随盐度增加逐渐降低,表明高盐胁迫对藻体无机碳吸收产生了影响,CA能对环境胁迫进行适应性调节(张震林等, 1992)。
Bowler C, van Montagu M, Inzé D. Superoxide dismutase and stress tolerance. Annual Review of Plant Biology, 1992, 43(1): 83–116
Brüggemann W, van der Kooij TAW, van Hasselt PR. Long-term chilling of young tomato plants under low light and subsequent recovery. Planta, 1992, 186(2): 172–178
Dring MJ. Stress resistance and disease resistance in seaweeds: The role of reactive oxygen metabolism. Advances in Botanical Research, 2005, 43(5): 175–207
Dummermuth AL, Karsten U, Fisch KM,. Responses of marine macroalgae to hydrogen-peroxide stress. Journal of Experimental Marine Biology and Ecology, 2003, 289(1): 103–121
Fen C, Lu XZ, Yu WG. Biochemical and physiological effects of adversity stress on. Transactions of Oceanology and Limnology, 2004(3): 22–26 [冯琛, 路新枝,于文功. 逆境胁迫对条斑紫菜生理生化指标的影响. 海洋湖沼通报, 2004(3): 22–26]
Hatch MD. C4photosynthesis: A unique elend of modified biochemistry, anatomy and ultrastructure. Biochimica et Biophysica Acta (BBA)–Reviews on Bioenergetics, 1987, 895(2): 81–106
Heidari M, Jamshidi P. Effects of salinity and potassium applicationon antioxidant enzyme activities and physiological parameters in pearl millet. Journal of Integrative Agriculture, 2011, 10(2): 228–237
Hibberd JM. The evolution of C4photosynthesis. New Phytologist, 2004, 161(2): 341–370
Ishida H, Nishimori Y, Sugisawa M,. The large subunit of ribulose-1,5-bisphosphate carboxylase/oxygenase is fragmented into 37-kDa and 16-kDa polypeptides by active oxygen in the lysates of chloroplasts from primary leaves of wheat. Plant and Cell Physiology, 1997, 38(4): 471–479
Jin YL. Preliminary study on experimental ecology of. Master's Thesis of Shantou University, 2012, 1–61 [金玉林. 大型红藻脆江蓠实验生态学初步研究. 汕头大学硕士研究生学位论文, 2012, 1–61]
Jin YL, Wu WT, Chen WZ. Effects of different temperature and salinity on growth and biochemical constituents of. South China Fisheries Science, 2012, 8(2): 51–57 [金玉林, 吴文婷, 陈伟洲. 不同温度和盐度条件对脆江蓠生长及其生化组分的影响. 南方水产科学, 2012, 8(2): 51–57]
Kaiser E, Morales A, Harbinson J,. Dynamic photosynthesis in different environmental conditions. Journal of Experimental Botany, 2015, 66(9): 2415–2426
Ke DS, Wang ZX, Yang LX. Effects of environmental factors on proteins and activity of peroxidase in. Proceedings of the 2th National Workshop on Genetic Diversity Gene Discovery of Tropical and Subtropical Plant Resources, 2006 [柯德森, 王正询, 杨礼香. 环境因素对龙须菜蛋白质及POD活性的影响. 第二届热带亚热带植物资源的遗传多样性与基因发掘利用研讨会论文集, 2006]
Kumar M, Kumari P, Gupta V,. Biochemical responses of red alga(Gracilariales, Rhodophyta) to salinity induced oxidative stress. Journal of Experimental Marine Biology and Ecology, 2010, 391(1): 27–34
Li WH, Hao NB, Ge QY,. Advances in study on C4pathway in C3plant. Chinese Bulletin of Botany, 1999, 16(2): 97–106 [李卫华, 郝乃斌, 戈巧英, 等. C3植物中C4途径的研究进展. 植物学通报, 1999, 16(2): 97–106]
Li XL, Wang WJ, Liang ZR,. Antioxidant physiological characteristics of wildunder desiccation stress. Progress in Fishery Sciences, 2017, 38(5): 156–163 [李晓蕾, 汪文俊, 梁洲瑞, 等. 野生条斑紫菜()叶状体对干出胁迫的抗氧化生理响应特征. 渔业科学进展, 2017, 38(5): 156–163]
Liu XP, Zhang YJ, Li Y,. Effect of different salinity on physiological features of. Ecological Science, 2012, 31(6): 606–612 [刘晓培, 张饮江, 李岩, 等.不同盐度对苦草生理特征的影响. 生态科学, 2012, 31(6): 606–612]
Liu ZL, Li PY. The effect of NaCl stress on the antioxidase activities and growth of. Chinese Bulletin of Botany, 1998, 15(3): 43–47 [刘志礼, 李鹏云. NaCl胁迫对螺旋藻生长及抗氧化酶活性的影响. 植物学通报, 1998, 15(3): 43–47]
Lu D. Progress on photosynthetic carbon metabolism types in marine macroalgae. Chinese Journal of Nature, 2013, 35(4); 264–273 [芦笛. 大型海藻光合碳代谢类型的研究进展. 自然杂志, 2013, 35(4): 264–273]
Luo GH, Wang AG, Shao CB,. The injury of high oxygen concentration to seeds germination and seedlings growth. Acta Phytophsiologica Sinica, 1987, 13(2): 161–167 [罗广华, 王爱国, 邵从本, 等. 高浓度氧对种子萌发和幼苗生长的伤害. 植物生理学报, 1987, 13(2): 161–167]
Maberly SC. Exogenous source of inorganic carbon for photosynthesis by marine macroalgae. Journal of Phycology, 1990, 26(3): 439–449
Rai S, Singh S, Shrivastava AK,. Salt and UV-B induced changes in Anabaena PCC 7120: Physiological, proteomic and bioinformatic perspectives. Photosynthesis Research, 2013, 118(1–2): 105–114
Wang AG, Shao CB, Luo GH. Inquiry into malondialdehyde as index of peroxidation of plant lipids. Plant Physiology Communications, 1986(2): 55–57 [王爱国, 邵从本, 罗广华. 丙二醛作为植物脂质过氧化指标的探讨. 植物生理学通报, 1986(2): 55–57]
Wang JH, Liu HX, Xu T. The role of superoxide dismutase(SOD) in stress physiology and senescence physiology of plant. Plant Physiology Communications, 1989(1): 1–7 [王建华, 刘鸿先, 徐同. 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用. 植物生理学通报, 1989(1): 1–7]
Wen ZB, Zhang ML. C4photosynthetic enzymes and antioxidant enzymes activities in two photosynthetic subtypes of C4desert plants under soil drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(9): 1815–1822 [闻志彬, 张明理. 干旱胁迫对2种光合类型C4荒漠植物叶片光合特征酶和抗氧化酶活性的影响. 西北植物学报, 2015, 35(9): 1815–1822]
Xie JX, Kuang JX, Chen SM,. Effects of environmental factors on the growth of four species of. Guangxi Sciences, 2014(6): 596–599 [解修俊, 邝继鲜, 陈世明, 等. 环境因子对4种江蓠生长的影响. 广西科学, 2014(6): 596–599]
Xu H, Li JQ, Xue SY,. Effects of short period high-salinity stress on photosynthetic characteristic of. Journal of Fishery Sciences of China, 2019, 26(4): 722–728 [徐涵, 李加琦, 薛素燕, 等. 短时间高盐处理对脆江蓠光合生理生化指标的影响. 中国水产科学, 2019, 26(4): 722–728]
Zhang ZL, Gao YZ, Wang Z. The role of carbonic anhydrase in photosynthetic carbon metabolism in higher plants. Jiangsu Journal of Agricultural Sciences, 1992, 8(2): 7–12 [张震林, 高煜珠, 王忠. 碳酸酐酶在高等植物光合碳代谢中的作用. 江苏农业学报, 1992, 8(2): 7–12]
Effects of Short Period High-Salinity Stress on Antioxidant Enzyme Activities and Photosynthesis Enzyme Activities of
XU Han1,3, XUE Suyan1,2, LI Jiaqi1,2, DING Jingkun1,3, HUO Enze1,3, ZHANG Wenwen1,3, MAO Yuze1,2①, FANG Jianguang1
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Shandong Provincial Key Laboratory of Fishery Resources and Eco-Environment, Qingdao 266071; 2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071; 3. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306)
The effects of acute hypersalinity stress on the antioxidant and photosynthetic enzyme activities ofwere studied. Plants were exposed to different levels of salinity ranging from 33 (control) to 60 under laboratory conditions. After incubation, plants were then transferred to seawater with a controlled level of salinity and recovered after 12 or 24 hours, respectively. The activity of antioxidant enzyme SOD increased (<0.05), the activity of POD was fluctuated (<0.05), the activity of CATgradually decreased without significant difference (>0.05) but the content of MDA was significantly increased (<0.01). The activity of SOD、POD、CAT and MDA reached the maximum in 50~55 psu groups but decreased significantly at salinity 60; The activity of Rubisco, a key enzyme in photosynthesis of C3, gradually decreased with the increase of salinity (<0.01). The content of CA slightly increased with the increase of salinity (<0.05). With the increase of recovery time, SOD, POD and CAT activities gradually increased (<0.05), and the activity of each antioxidant enzyme showed a maximum value in 50~55 psu groups, but MDA content decreased considerably (<0.05). Rubisco activity was significantly higher than that in 0.5 h (<0.05), and CA content fluctuated with salinity. Short period high-salinity stress significantly affected the activities of antioxidant enzymes and photosynthetic enzymes in. Algae responded to hypersalinity stress by increasing the activities of antioxidant enzymes, and enhancing the absorption and utilization of inorganic carbon by CA.The alga gradually returned to the normal level after the stress was removed.The purpose of this study is to provide a theoretical basis for improving the efficiency of large-scale cultivation of, and to provide basic data for the study of salt tolerance mechanism of macroalgae.
; High-salinity stress; Antioxidant enzyme; Photosynthetic enzymes
MAO Yuze, E-mail: maoyz@ysfri.ac.cn
S968
A
2095-9869(2020)03-0119-06
10.19663/j.issn2095-9869.20190225001
http://www.yykxjz.cn/
* 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室创新团队项目(LMEES-CTSP-2018-4)、中国水产科学研究院中央级公益性科研院所基本科研业务费专项资金(2019ZD0105)、中国水产科学研究院黄海水产研究所基本科研业务费(20603022017010)和山东省海洋与渔业科技创新计划项目共同资助[This work was supported by Creative Team Project of the Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao)(LMEES-CTSP-2018-4), Central Public-Interest Scientific Institution Basal Research Fund, CAFS (2019ZD0105), Central Public-interest Scientific Institution Basal Research Fund, YSFRI, CAFS (20603022017010), and Marine and Fishery Science and Technology Innovation Project of Shandong Province]. 徐 涵,E-mail: m160111259@st.shou.edu.cn
毛玉泽,研究员,E-mail: maoyz@ysfri.ac.cn
2019-02-25,
2019-04-11
徐涵, 薛素燕, 李加琦, 丁敬坤, 霍恩泽, 张雯雯, 毛玉泽, 方建光. 短期高盐胁迫对脆江蓠抗氧化酶活性及光合酶活性的影响. 渔业科学进展, 2020, 41(3): 119–124
Xu H, Xue SY, Li JQ, Ding JK, Huo EZ, Zhang WW, Mao YZ, Fang JG. Effects of short period high-salinity stress on antioxidant enzyme activities and photosynthesis enzyme activities of. Progress in Fishery Sciences, 2020, 41(3): 119–124
(编辑 陈 辉)

