草莓应答炭疽菌侵染的转录组分析
陈哲 黄静 赵佳 梁宏


摘要 本研究以栽培草莓为材料,用炭疽菌对植株进行侵染,对健康草莓和患病草莓进行转录组分析(RNA-seq),共得到86 988个序列以及2 127个差异表达基因。利用GO数据库对差异表达基因进行了聚类分析,结果发现差异表达基因主要聚类在光合作用、氧化还原过程、氧化还原酶活性、碳固定过程以及糖代谢过程等方面。同时,利用KEGG数据库对差异表达基因影响的通路进行注释后发现,炭疽菌侵染主要影响了光合作用、倍半萜和三萜生物途径、类黄酮生物合成、谷胱甘肽代谢和植物激素信号转导等途径中关键基因的表达水平。挑选了20个差异表达基因进行qRT-PCR,结果有19个基因的表达趋势与转录测序结果一致。本研究获得的草莓应答炭疽菌侵染转录组数据信息,将有助于丰富草莓抗炭疽病的调控机制。
关键词 草莓; 炭疽菌; 转录组分析; 差异表达基因
中图分类号: S 436.63
文献标识码: A
DOI: 10.16688/j.zwbh.2019096
Transcriptomics analysis of strawberry response to
Colletotrichum theobromicola infection
CHEN Zhe, HUANG Jing, ZHAO Jia, LIANG Hong
(Biotechnology Research Center, Shanxi Academy of Agriculture Sciences, Taiyuan 030031, China)
Abstract
In this study, we analyzed the response of strawberry plants(Fragaria×ananassa) to infection with Colletotrichum theobromicola using the next-generation sequencing (RNA-seq) and investigated the alterations in gene expression between the healthy and infected plants. We have identified 86 988 unigenes, of which 2 127 were differentially expressed in the fungi-infected plants (DEGs). The unigenes were annotated and classified with Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) analyses. The DEGs annotated to the GO database were distributed in many functional types, including photosynthesis, oxidation-reduction process, oxidoreductase activity and growth, development and metabolism. The KEGG pathway analysis of these genes suggested that strawberry disease caused by C.theobromicola may affect multiple processes including photosynthesis, sesquiterpenoid and triterpenoid biosynthesis, flavonoid biosynthesis, glutathione metabolism and plant hormone signal transduction. In order to validate our DGE data, 20 DEGs with annotations were selected for qRT-PCR analysis. Among them,19 out of 20 DGEs exhibited a consistent expression pattern between RNA-Seq and qRT-PCR.The comprehensive transcriptome information obtained in this study will help to understand the regulatory mechanisms involved in strawberry response to C.theobromicola infection.
Key words
strawberry; Colletotrichum theobromicola; transcriptomics analysis; differentially expressed genes
炭疽病的病原菌為炭疽菌属Colletotrichum的多种真菌[1],其中可以侵染草莓的病原菌多是C.acutatum复合种[2](C.nymphaeae、C.cuscutae、C.godetiae、C.salicis和C.simmondsii)和C.gloeosporioides复合种[3](C.fructicola和C.theobromicola)。炭疽病可在草莓、苹果、梨、枣、柑橘和虎耳草等多种植物中发生,给这些植物的生产造成严重损失。近年来,炭疽病在草莓生产中发生日趋严重,已经成为草莓苗期甚至整个生长期的主要病害,是设施草莓移栽后成活率低的主要原因之一,给草莓生产带来了严重影响。目前, 生产上针对炭疽病的防治主要有化学防治及一些微生物防治的方法,前者易造成药物残留、环境污染等问题,后者则往往以预防为主。种植抗性品种是防治草莓炭疽病最根本的方法,这样才能从源头上解决炭疽病侵染[4]。
植物在逆境胁迫下,转录水平上的基因表达会发生很大的改变。近年来转录组测序技术(RNA-seq)发展成为研究逆境应答、挖掘新基因及代谢途径确定的重要技术之一[5]。张明伟等研究发现野生稻基因导入系W6023在受到白叶枯菌侵染后,差异表达基因主要富集在次生代谢产物的生物合成、植物激素信号转导及糖代谢途径等方面,并从中挖掘出了多个抗病基因[6]。刘之慧等发现,不同配比的红蓝光对草莓组培苗有机物的积累与代谢、光合作用、叶绿素的产生与代谢、植物激素的产生均有明显作用[7]。张小芳等发现耐旱型野生大豆受到干旱胁迫后,其差异表达基因广泛涉及糖、脂类、蛋白质和核酸等生物大分子代谢、能量代谢以及次生代谢过程,代谢途径则涉及植物-病原体互作、植物激素信号转导、RNA降解和ABC转运蛋白等[8]。
本研究用胶孢炭疽菌侵染草莓根部,待草莓发病后,对健康草莓和患病草莓进行转录组分析,找到二者在转录水平基因表达的差异,分析参与植物抗病过程的相关基因和途径,为草莓抗病品种的选育提供一些理论依据。
1 材料与方法
1.1 供试草莓和炭疽菌菌株供试草莓品种为‘红颜。
供试真菌草莓炭疽菌C.theobromicola TAN-9为中国农业大学农学与生物技术学院张国珍老师赠送。
1.2 培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL,自然pH。
1.3 病原菌侵染试验
将健康、生长状态一致的2叶1心草莓幼苗移植到灭菌基质中,处理组(D)和对照组(CK)各15株。待移苗成功10 d后对处理组草莓进行伤根处理,并浇灌浓度为1×106 个/mL草莓炭疽菌TAN-9的孢子悬浮液;对照组浇灌无菌水。此后,结合草莓生长状态和基质干湿情况,每隔5~7 d进行补施病原菌,一共浇灌3次。
在处理组接种病原菌50 d后进行样品采集。患病叶柄的选择:截取包含病斑的10 mm长的叶柄段,病斑长度为5.1~10.0 mm。每株草莓只收集1个叶柄,5株草莓即5个叶柄段为1组,处理组和对照组各3组重复。采集到的样品在液氮迅速冷冻,-80℃冷藏备用。
1.4 转录组分析
1.4.1 草莓叶柄RNA提取
将采取的样品用干冰盒包装好,送上海派森诺生物科技股份有限公司提取 RNA和测序。利用琼脂糖凝胶电泳和Agilent 2100 Bioanalyzer检测RNA完整性。
1.4.2 草莓叶柄cDNA文库构建和质控
用Oligo(dT)磁珠富集总RNA中带有polyA结构的mRNA,采用离子打断的方式,将RNA打断成200~300 bp片段。以RNA为模板,用6碱基随机引物和逆转录酶合成cDNA第一链,并以第一链cDNA为模板合成第二链cDNA,第二链cDNA合成时,其中的碱基T,被替换成U,从而达到链特异性文库的目的。
文库构建完成后,采用PCR擴增进行文库片段富集,之后根据片段大小进行文库选择,文库大小在300~400 bp。接着,通过Agilent 2100 Bioanalyzer对文库进行质检,再对文库总浓度及文库有效浓度进行检测。然后根据文库的有效浓度以及文库所需数据量,将含有不同Index序列的文库按比例进行混合。混合文库统一稀释到2 nmol/L,通过碱变性,形成单链文库。
1.4.3 高通量测序
草莓叶柄的转录组分析: 利用第二代测序技术,基于Illumina HiSeq测序平台,对库进行双末端 (paired-end,PE)测序。将测序得到的原始读序(raw reads)经过截除reads中的测序接头以及引物序列,过滤低质量值数据等处理,获得高质量的干净读序(clean reads),确保数据质量。进行碱基组成和碱基质量分析,控制数据质量。
提取每个基因下最长的转录本作为该基因的代表序列,称为Unigene。对 Unigene 进行基因功能注释。基因功能注释所用到的数据库包括NR(NCBI non-redundant protein sequences)、GO (gene ontology)、KEGG(Kyoto encyclopedia of genes and genome)、eggNOG(evolutionary genealogy of genes: non-supervised orthologous groups)、Swiss-Prot。
1.4.4 差异基因的筛选
采用DESeq对基因表达进行差异分析,筛选差异表达基因条件为:表达差异倍数|log2FoldChange|>1,显著性 P-value<0.05。
1.4.5 差异表达基因的GO功能显著性富集分析
采用BLAST2 GO软件将差异基因映射到GO数据库的各个分类,计算每个分类中的差异基因数目,以整个基因组为背景,采用超几何分布计算差异基因显著富集的GO分类信息。
1.4.6 差异表达基因的 KEGG 通路富集显著性分析
将差异基因与KEGG数据库进行比对,获得差异表达基因主要参与的代谢途径和信号通路。以整个基因组为背景,采用超几何分布计算差异基因显著富集的通路。
1.4.7 差异表达基因的荧光定量PCR(qRT-PCR)验证
综合分析NCBI数据库,并结合本研究转录组数据提供的信息,对转录组中20个可能与植物抗性或者病原菌侵染过程等机制相关的差异表达基因进行聚类分析,并对其进行qRT-PCR验证。
利用 Premier 5.0软件设计qPCR引物,以草莓β-actin作为内参基因(表1)。用PrimeScriptTM 1st stand cDNA Synthesis Kit将检测合格并定量的草莓叶柄总RNA逆转录成 cDNA。荧光定量PCR反应体系(20 μL): cDNA 1 μL、上下游引物各 0.8 μL、2×SYBR real-time PCR premixture 10 μL,加超纯水补足至20 μL。荧光定量PCR的扩增条件为 95℃预变性5 min,95℃变性 15 s,60℃延伸 30 s,循环 40 次。每份样品进行3次生物学重复。整个流程由上海派森诺生物科技股份有限公司完成。
2 结果与分析
2.1 病原菌侵染草莓植株
‘红颜草莓在接种病原菌45 d后,叶柄开始发病,在接种50 d后处理组中超过半数的草莓叶柄出现了明显的红褐色病斑(图1),此时采集样品进行分析。
2.2 测序数据结果统计
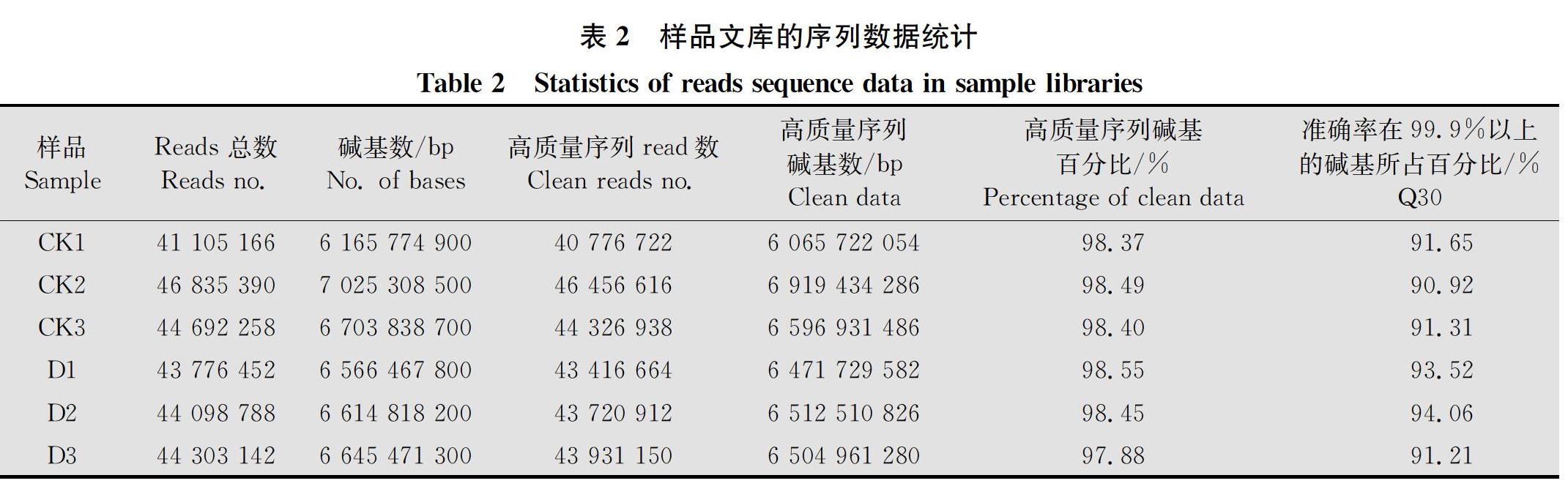
通过RNA-seq技术对健康草莓叶柄(CK1、CK2、CK3)和患病草莓叶柄(D1、D2、D3)的6个样品进行分析,获得的序列数据见表2。
将上述序列进行拼接和分析,共获得86 988个Unigene序列。 分别在NR数据库、GO数据库、KEGG数据库、eggNOG数据库和Swiss-Prot数据库中对Unigene序列进行比对分析,发现有4 364个序列全部获得注释(表3)。
2.3 差异表达基因的筛选
将健康草莓叶柄(CK)与患病草莓叶柄(D)的差异基因进行双向聚类分析(图2),结果显示聚类结果良好。对二者差异基因的表达统计分析发现,显著差异表达基因的数目是2 127个,其中上调表达数量是1 021个,下调表达基因数量是1 106个,上调表达基因数量略低于下调表达基因。大量的基因在草莓响应炭疽病时呈现差异表达模式,表明草莓响应炭疽病是多基因共同作用的复杂过程。
2.4 差异表达基因的GO富集分析
对差异表达基因进行GO数据库分析,一共比对到了1 122个GO功能条目,筛选出p值小于0.01的68个条目进行后续分析。 这68个条目分为3大类功能,生物学过程(biological process)、细胞组分(cellular component)和分子功能(molecular function),每类功能分别包括26个、14个和10个功能亚组,图3展示了每类功能之下的10个功能亚分组。
分析发现,感染炭疽菌的草莓叶柄的光合作用过程受到了极大的影响,这一结果和病症相对应。炭疽菌侵染到草莓叶柄处,逐渐积累到一定程度时会在叶柄外部出现红褐色病斑,严重影响正常的光合作用,进而草莓的很多生长代谢过程也会出现异常。分子功能中的氧化还原酶活性功能,还有生物学过程中的氧化还原过程都富集了大量的差异表达基因等,这二者都是植物抗逆反应中重要的环节[9],说明在草莓应答炭疽病的过程中,氧化还原反应很可能发挥了关键性的作用。
2.5 差异表达基因的 Pathway 富集分析
利用KEGG数据库可以分析差异表达基因参与的最主要生化代谢途径和信号转导途径。本研究中有556个DEGs映射到154个pathway,图4中展示差异显著的前20个通路,包括光合作用、碳代谢、光合生物中的碳固定、光合作用触角蛋白质、甘氨酸、丝氨酸和苏氨酸代谢、类黄酮生物合成、谷胱甘肽代谢、植物激素信号转导、牛磺酸和次牛磺酸代謝、氨基酸的生物合成、苯丙醇生物合成、细胞色素P450对外源物的代谢、药物代谢细胞色素P450、乙醛和二羧酸代谢、甲烷代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成、糖酵解/糖异生、戊糖磷酸途径以及倍半萜和三萜生物合成。
从差异表达基因的富集程度可以看出,其主要还是集中在植物正常生长的代谢途径中,包括光合作用、牛磺酸和次牛磺酸代谢、倍半萜和三萜生物途径等,这表明病原菌的入侵严重干扰了植物的正常生长,尤其是光合作用。同时,与植物抵御非生物及生物胁迫有关的途径,包括类黄酮生物合成、谷胱甘肽代谢以及植物激素信号转导都有差异表达基因的富集,而在类黄酮途径中更是有超过三分之一的基因出现了变化,充分说明炭疽菌侵染后,触发了草莓体内的抗性反应[1011],而类黄酮途径可能起到了关键性的作用。
2.6 差异表达基因的qRT-PCR验证
利用实时定量PCR(qRT-PCR)技术对转录组数据进行验证,选取了20个基因进行验证。分析结果显示(图5),有19个差异表达基因的表达趋势和转录组测序结果一致,表明 RNA-Seq 分析结果可靠。虽然差异基因的表达倍数略有不同,但这可能与两种检测方法的检测范围和灵敏度不同有关。
19个差异表达基因中包含10个上调基因和9个下调基因。上调基因包括:1-氨基环丙烷-1-羧酸合成酶(ACS)、2-氨基乙硫醇双加氧酶(ADO)、过氧化物酶21(POD21)、无色花色苷双加氧酶(LDOX)、查尔酮合酶(FrCHS5)、查尔酮黄酮异构酶3(CHI3)、谷胱甘肽S-转移酶F11(GST F11)、MYB、苯丙氨酸解氨酶1(PAL1)和呼吸爆发氧化酶同源蛋白A(RhoA);下调基因有:NF-X1型锌指蛋白(NF-XL1)、色氨酸合酶α链(trpA)、生长素诱导蛋白15A(AX15A)、细胞分裂素脱氢酶5(CKX5)、ADP-葡萄糖焦磷酸化酶大亚基(gpL2)、类胡萝卜素双加氧酶4(CCD4)、9-顺式环氧类胡萝卜素双加氧酶1(NCED1)、核酮糖1,5-二磷酸羧化酶/加氧酶(rbcL)和叶绿体果糖-1,6-二磷酸酶Ⅰ(cfbI)。
从表达量上分析,在上调和下调基因中各有3个表达量倍数超过40倍的基因。ACS、POD21和ADO基因,在处理组中表达倍数分别是对照组的927、586和326倍;而trpA、AX15A和CKX5在对照组的表达量则是处理组的49、252和271倍。
3 讨论
草莓炭疽病是草莓在生长期内面临的主要威胁之一[1213],直接影响其生长发育,给草莓产量和品质带来极大危害,培育抗炭疽病的草莓品种是防控病害的最直接有效的方法,能从源头上预防炭疽病的发生[14]。病原菌在侵入寄主植物后,二者在共同进化及相互识别过程中形成了错综复杂的关系。病原菌从植物获得营养的同时也激发了植物体内一系列生理生化反应,增强其抗病性,从而达到抵制病原菌入侵的目的。近年来,越来越多的研究者从转录组水平上揭示植物抗病系统中的代谢通路以及分子调控网络,不仅有助于筛选与鉴定关键作用基因,也为抗病性育种提供了有力支持[1517]。
本研究利用高通量测序手段,在转录组水平上分析健康草莓叶柄和患炭疽病草莓叶柄的差异表达基因,结果发现草莓应答病原菌的过程中,共有2 127个基因表达出现显著差异,其中有1 021个差异基因的表达水平显著升高,1 106个差异基因的表达水平显著下降。GO数据库和KEGG数据库分析显示,当炭疽病菌在进入草莓体内后,草莓植株的正常生长受到了极大的影响,多个代谢通路的基因表达发生了改变。根据转录组差异基因分析结果,挑选了20个基因进行qRT-PCR检测,有19个基因的表达趋势与转录组结果一致,说明转录组数据真实可靠,可以进行后续分析。通过差异基因和代谢通路进行分析,发现本研究中‘红颜草莓应答炭疽菌主要涉及活性氧的平衡調节、乙烯的生物合成以及植物正常发育等生理过程。
3.1 活性氧平衡与草莓应答炭疽病密切相关
正常条件下,植物体内活性氧 ROS 的生成和清除处于动态平衡状态,当植物遭遇胁迫时,稳态被破坏,大量的 ROS (主要由NADPH氧化酶催化产生,NADPH氧化酶由Rbohs编码合成[18])迅速累积,使植物细胞受到氧化损伤[19]。为了维持平衡,植物会通过两种方式清除活性氧,第一种是酶促清除系统,通过抗氧化酶(SOD、GST、CAT和POD等)将活性氧分解;第二种是非酶系统的抗氧化次级代谢物,他们可以与活性氧发生反应,直接清除ROS,例如多酚、类黄酮、类胡萝卜素等[20]。
根据本研究结果,我们认为草莓接种炭疽菌后,上述两种方式都会开始工作,进行活性氧的清除。在酶促清除系统中,草莓主要通过体内过氧化物氧化酶POD21来进行。POD是活性氧酶促清除系统中常见的酶,可以分解体内产生的H2O2,它与植物的抗逆境能力有着密切的联系。大豆在重度干旱胁迫下,叶片内POD活性最高[21];马铃薯[22]和番茄[23]在受到病原菌侵染后,叶片POD活性较未接种对照均有显著提高。在本试验中其表达量在炭疽菌侵染后升高到对照的586倍,足以证明POD21在活性氧清除过程中发挥了关键性的作用。
在第二种方式中,草莓体内主要起作用的则是类黄酮物质。类黄酮代谢途径是植物抵抗病原菌的防卫反应之一,有实验证实,海岛棉在接种枯萎病菌之后,类黄酮代谢通路中的多个相关基因表达量发生了显著升高,同时认为此通路与海岛棉的抗性相关[24]。在本试验中,类黄酮代谢途径(包括上游的苯丙烷类代谢途径)的相关基因PAL1、LDOX、FrCHS5与CHI3均在处理组中发生了上调,因此推测当草莓受到病原菌侵染,上述基因发生上调,加速了类黄酮物质[10]的积累,从而清除ROS,维持ROS的平衡,缓解了炭疽菌给植物带来的氧化伤害,增强了草莓对病菌的抗性。
值得注意的是,草莓被炭疽菌侵染后,2-氨基乙硫醇双加氧酶ADO的表达量上升到对照的326倍。ADO可以将半胱氨酸氧化成次牛磺酸(hypotaurine, HT),后者在动物体内是一种强抗氧化剂[25];尽管次牛磺酸在植物中的研究很少,但是也有类似的作用。有研究证实,水稻幼苗经过HT的处理能够降低碱胁迫下叶片中活性氧的积累,缓解其对幼苗生长的抑制作用[26]。ADO表达量的大量增加,很可能预示着其在应答过程中会起到一定的关键作用,所以说其作用机制是值得关注的一个新的研究点,它能否对活性氧平衡发挥作用则需要进一步的研究探索。
3.2 ACS在草莓应答炭疽病中发挥作用
乙烯是植物体内一种重要的气态激素,参与调节植物生长发育的多个过程,也在植物响应生物和非生物胁迫过程中起重要的调控作用。ACS是乙烯生物合成过程的关键调控酶,它催化SAM(S-腺苷甲硫氨酸)合成乙烯前体ACC(1-氨基环丙烷-1-羧酸),ACC在 ACC氧化酶的作用下氧化生成乙烯。耿夙的研究发现,在轮纹病菌侵染苹果果实后,ACS5a、ACS5b、ACS4被大量诱导表达,乙烯也被大量诱导合成[27]。这和本研究结果类似,当炭疽菌侵染草莓后,ACS基因的表达量骤然上升到对照的927倍,是所有差异表达基因中表达倍数最高的基因。推测ACS基因的显著上调会导致ACC的过表达,进而促进乙烯的合成,而乙烯的累积会促进草莓体内逆境胁迫的信号转导过程,起到防御炭疽菌侵害的作用[28]。
3.3 植物正常生长受到抑制
色氨酸合酶由两个不同的亚基组成,α-亚基和β-亚基依次催化色氨酸生物合成的最后两个步骤[29],并且色氨酸合酶还参与了甘氨酸、丝氨酸和苏氨酸代谢以及苯丙氨酸和酪氨酸的生物合成;生长素诱导蛋白基因编码合成植物特有的生长素响应蛋白 SAUR (small auxin up RNA),而且此基因在生长旺盛的部位表达量要高于其他部位[30];细胞分裂素脱氢酶是分解细胞分裂素的唯一降解酶[3132]。因此,我们推测,当炭疽菌侵染草莓后,草莓体内涉及正常生长的一些基因发生了重大改变。色氨酸合酶 α链基因trpA的下调,表明色氨酸合酶α-亚基会受到影响,进而影响植物体内包括色氨酸在内的多个氨基酸的合成和代谢;AX15A的显著下调会导致SAUR的缺乏,无法响应生长素信号;而CKX 5表达量的下降,导致细胞分裂素在草莓体内失去代谢平衡。所以,这3个基因的显著下调,影响了植物激素和氨基酸代谢途径,最终导致草莓的生长受到阻碍,出现植株矮小、根系不发达等现象。
本文通过RNA-seq分析和qRT-PCR验证发现了一些与草莓应答炭疽病相关的差异表达基因,其中表达量有显著差异的基因有6个,分析推测这些差异基因可能在活性氧平衡、乙烯合成以及植物正常生长过程发挥了重要作用。那么,这些基因在草莓应答病原菌过程中是怎样发挥作用的,其调控机制又是什么,它们之间又会形成怎样的关联网络,尤其是次牛磺酸在植物活性氧清除过程中所起到的作用是十分值得研究的,所以我们需要进一步开展分子试验来解决这些深层次的问题。转录组分析为深入研究植物病原菌互作提供了良好的平台[33],可以从整体上了解患病草莓与健康草莓在转录组水平上的差异表达基因,有助于挖掘草莓防御炭疽病菌的关键基因,为研究草莓应答炭疽病的分子机理提供重要的基因资源,从而为抗性草莓品种的选育提供有力的科学理论。
参考文献
[1] 陈哲, 黄静, 赵佳, 等. 防治草莓炭疽病的芽胞杆菌组合的筛选[J]. 中国生物防治学报, 2018, 34(4): 582588.
[2] DAMM U, CANNON P F, WOUDENBERG J H C, et al. The Colletotrichum acutatum species complex [J]. Studies in Mycology, 2012, 73(1):37113.
[3] WEIR B S, JOHNSTON P R, DAMM U. The Colletotrichum gloeosporioides species complex [J]. Studies in Mycology, 2012, 73(1):115180.
[4] CHEN Jing, ZHANG Hanping, FENG Mingfeng, et al. Transcriptome analysis of woodland strawberry (Fragaria vesca) response to the infection by strawberry vein banding virus (SVBV) [J]. Virology Journal, 2016, 13(1): 128.
[5] 張健, 唐露, 张雅洁, 等. 转录组测序技术在植物水淹胁迫研究中的应用[J]. 分子植物育种: 2019(2): 113.
[6] 张明伟, 徐飞飞, 郝巍, 等. 野生稻基因导入系W6023对白叶枯菌的抗谱及转录组差异表达基因分析[J]. 植物遗传资源学报, 2017, 18(2): 298309.
[7] 刘之慧, 蔡雯婷, 董清华. 红蓝光处理草莓组培苗的转录组测序与分析[J]. 北京农学院学报, 2017, 32(4): 2835.
[8] 张小芳, 王冰冰, 徐燕, 等. PEG模拟干旱胁迫下野生大豆转录组分析[J]. 大豆科学, 2018, 37(5): 681689.
[9] 刘洪博, 刘新龙, 苏火生, 等. 干旱胁迫下割手密根系转录组差异表达分析[J]. 中国农业科学, 2017, 50(6): 11671178.
[10]潘媛, 陈大霞, 宋旭红, 等. 基于转录组测序挖掘国槐花蕾黄酮类物质生物合成相关基因[J]. 中国中药杂志, 2018, 43(13): 26822689.
[11]张亚真, 张芬, 王丽鸳, 等. 植物谷胱甘肽转移酶在类黄酮累积中的作用[J]. 植物生理学报, 2015, 51(11): 18151820.
[12]谷春艳, 苏贤岩, 杨雪, 等. 解淀粉芽胞杆菌WH1G与咪鲜胺协同防治草莓炭疽病[J]. 植物保护, 2018, 44(2): 184189.
[13]马世龙, 王国良, 赵君, 等. 大棚‘红颊草莓病害控制关键技术[J]. 现代园艺, 2017(6): 6566.
[14]NAMAI K, MATSUSHIMA Y, MORISHIMA M. Resistance to anthracnose is decreased by tissue culture but increased with longer acclimation in the resistant strawberry cultivar [J]. Journal of General Plant Pathology, 2013, 79(6): 402411.
[15]梁国平, 李文芳, 马宗桓, 等. 基于转录组研究葡萄糖对葡萄试管苗碳代谢的影响[J]. 园艺学报, 2019, 46(1): 121134.
[16]王冕. 花生应答果腐病病原菌侵染的转录组和miRNAs研究及抗性相关基因克隆[D]. 泰安: 山东农业大学, 2018.
[17]杨仕美, 乔光, 毛永亚, 等. 基于火龙果转录组测序的SSR标记开发及种质亲缘关系分析[J]. 分子植物育种, 2018, 16(24): 80968110.
[18]ZHANG Yunting, LI Yali, HE Yuwei, et al. Identification of NADPH oxidase family members associated with cold stress in strawberry [J]. FEBS Open Bio, 2018, 8(4): 593605.
[19]郭鹏飞, 雷健, 罗佳佳, 等. 柱花草苯丙氨酸解氨酶(SgPALs)对生物胁迫与非生物胁迫的响应[J].热带作物学报,2019,40(9):17421751.
[20]王福祥, 肖开转, 姜身飞, 等. 干旱胁迫下植物体内ROS的作用机制[J].科学通报,2019,64(17):17651779.
[21]王文佳,李爽,马泽众,等.水分胁迫对春大豆叶片保护酶活性及相对电导率的影响[J].中国农学通报,2019,35(11):1418.
[22]胡耀华, 李清宇, 唐翊. 基于高光谱的晚疫病胁迫下马铃薯叶片的过氧化物酶活性检测[J]. 江苏大学学报(自然科学版), 2018, 39(6): 683688.
[23]张菁, 连清贵, 陈婧, 等. 淡紫拟青霉QLP12对感染灰霉病后番茄植株的促生作用及抗病相关酶活性变化[J]. 植物保护学报, 2018, 45(5): 10881095.
[24]黄启秀,曲延英,姚正培,等. 海岛棉枯萎病抗性与类黄酮代谢途径基因表达量的相关性[J].作物学报,2017,43(12):17911801.
[25]TERRIENTE-PALACIONS C, DIAZ I, CASTELLARI M. A validated ultra-performance liquid chromatography with diode array detection coupled to electrospray ionization and triple quadrupole mass spectrometry method to simultaneously quantify taurine, homotaurine, hypotaurine and amino acids in macro-and microalgae [J].Journal of Chromatography A, 2019,1589:8392.
[26]祝一文,车永梅,赵方贵,等.碱胁迫下H2S参与活性氧代谢和水稻幼苗生长的调控[J].農业生物技术学报,2018,26(7):11241131.
[27]耿夙. 轮纹病致病菌Botryosphaeria dothidea侵染对苹果抗性反应、乙烯合成和相关基因表达的影响[D].泰安:山东农业大学,2016.
[28]张弢, 董春海. 乙烯信号转导及其在植物逆境响应中的作用[J]. 生物技术通报, 2016, 32(10): 1117.
[29]FLEMING J R, SCHUPFNER M, BUSCH F, et al. Evolutionary morphing of tryptophan synthase: functional mechanisms for the enzymatic channeling of indole [J]. Journal of Molecular Biology, 2018:50675079.
[30]张欢,杨英杰,李鼎立,等.杜梨根茎叶特异表达基因的RNA-Seq分析[J].园艺学报,2018,45(10):18811894.
[31]张晨, 郑伟, 周涛, 等. 太子参细胞分裂素氧化/脱氢酶基因PhCKX的克隆及表达分析[J]. 分子植物育种, 2018, 16(19): 62426249.
[32]李志康,严冬,薛张逸,等.细胞分裂素对植物生长发育的调控机理研究进展及其在水稻生产中的应用探讨[J].中国水稻科学,2018,32(4):311324.
[33]ZANARDO L G, DE SOUZA G B, ALVES M S. Transcriptomics of plant-virus interactions: a review [J]. Theoretical and Experimental Plant Physiology. 2019, 31:103125.
(责任编辑:田 喆)
收稿日期: 20190302 修订日期: 20190511
基金项目:山西省农业科学院特色农业技术攻关项目(YGG17067);山西省应用基础研究项目(201601D202062)
致 谢: 参加本试验部分工作的还有江代礼、谭翰杰、张能和纪烨斌等同学,特此一并致谢。
通信作者E-mail:lh1964@126.com
#为并列第一作者

