芙新姬小蜂孤雌品系和两性品系未成熟期生活史比较
杨月梅 杜素洁 刘万学 潘立婷 杨利艳 郭建洋


摘要 芙新姬小蜂Neochrysocharis formosa是潜叶蝇类害虫的优势天敌。在中国已发现孤雌产雌品系(thelytokous strain)和两性品系(arrhenotokous strain)。以实验室连代饲养的芙新姬小蜂两种品系为研究对象,比较了两种品系在5个温度梯度(18、22、26、30和34℃)下未成熟期的生活史参数。结果表明:卵幼虫历期、蛹历期和整个未成熟期均随温度升高而缩短;相同温度条件下,孤雌品系和两性品系雌蜂的未成熟期的发育历期,在18、22和30℃下均为孤雌品系显著短于两性品系,在26℃下,二者无显著差异,在34℃下则为前者显著长于后者;5个温度下,孤雌品系雌蜂个体大小和卵子数均分别显著低于两性品系雌蜂。综合分析表明,两种品系在未成熟期的生活史特征参数方面发生了较大程度的分化。
关键词 芙新姬小蜂; 孤雌产雌品系; 两性品系; 未成熟期; 生活史
中图分类号: S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2019095
Comparison of life history during immature stage between thelytokous and
arrhenotokous strains of Neochrysocharis formosa
YANG Yuemei1, 2#, DU Sujie1#, LIU Wanxue1, PAN Liting1, YANG Liyan2, GUO Jianyang1
(1. State Key Laboratory for Plant Diseases and Insect Pests, Institute of Plant Protection,
Chinese Academy of Agricultural Sciences, Beijing 100193, China;
2. College of Life Sciences, Shanxi Normal University, Linfen 041004, China)
Abstract
Neochrysocharis formosa is the dominant natural enemy of the leafminers. Thelytokous and arrhenotokous strains of N.formosa were reported in China and laboratory strains were successfully established. In this study, life history parameters of N. formosa during immature stage were compared between the two strains at 18, 22, 26, 30℃ and 34℃. The results showed that the eggs-larvae, the pupal duration and the whole immature period shortened with the rise of experimental temperature. Under the same temperature conditions (18, 22℃ and 30℃), the developmental duration of the immature stage of the female of the arrhenotokous strain was significantly longer than that of the thelytokous strain, and there was no significant difference at 26℃, but the thelytokous strain was significantly longer than the arrhenotokous strain at 34℃. Under the five temperature conditions, body sizes and the number of eggs of virginal female of arrhenotokous strain were significantly greater than the thelytokous strain. The comprehensive analysis showed that the two strains had a certain degree of differentiation during the immature period.
Key words
Neochrysocharis formosa; thelytokous strain; arrhenotokous strain; immature stage; life history
潛叶蝇(agromyzid leafminers)属于潜蝇科Agromyzidae,是为害蔬菜、花卉等经济作物的一类世界性重要害虫。据Spencer[1]1973年统计,世界潜蝇科昆虫有害类群达17 属158 种,其中对蔬菜、花卉、禾谷、牧草及林木等构成威胁或潜在威胁的害虫为75 种;潜叶蝇成虫取食植物叶片汁液形成危害,而其幼虫常潜入植物叶片形成“潜道”危害,降低植物的光合作用,严重减少作物产量甚至造成绝收[18]。我国是世界上蔬菜潜叶蝇类害虫为害最为严重的国家之一,主要潜叶蝇有本地种豌豆彩潜蝇Chromatomyia horticola (Goureau)和葱斑潜蝇Liriomyza chinensis (Kato)等;入侵种有三叶草斑潜蝇L.trifolii (Burgess)、美洲斑潜蝇L.sativae (Blanchard)、南美斑潜蝇L.huidobrensis (Blanchard)和番茄斑潜蝇L.bryoniae (Kaltenbach)。潜叶蝇不仅造成严重的经济损失,而且随着外来斑潜蝇的入侵和迅速扩散对我国蔬菜、花卉、林业等构成更严重的威胁[914]。
由于潜叶蝇类害虫具有寄主范围广、世代周期短、繁殖力高、为害隐蔽、易产生抗药性等特性[6, 910, 1519],以及由于农药的频用和滥用对天敌的抑制,自20世纪50年代之后,美洲斑潜蝇、三叶草斑潜蝇、南美斑潜蝇等重要潜叶蝇类害虫在世界上许多国家入侵扩散并形成了持续的危害[6, 11, 17],但潜叶蝇的寄生蜂种类多,控害能力强,合理利用寄生蜂进行“绿色”防控是目前潜叶蝇防控的首选措施[1213, 17]。
我国潜叶蝇的寄生蜂种类丰富,至少在50种以上,芙新姬小蜂N.formosa (Westwood)是其中的优势种[12]。该寄生蜂广泛分布于世界30个国家,我国已至少在17个省(直辖市)有发现,具有重要的潜在控害效应和应用价值[12, 2023]。该寄生蜂为卵育型(synovigenic)抑性单内寄生蜂,温度适应范围广,而且耐高温,不仅可以通过产卵寄生致死寄主幼虫,而且可以通过取食寄主(host feeding)和叮蛰寄主(host stinging)的非繁殖方式杀死寄主幼虫[12, 2021, 24]。该寄生蜂于1998年在日本首次被确认具有孤雌产雌品系(thelytokous strain)和两性品系(arrhenotokous strain)[25],我国也于2015年发现孤雌产雌品系和两性品系[26],两种品系的发生分布上存在地理区域差异,且在我国多数地区,孤雌产雌品系已经占据了优势。本研究以室内建立的芙新姬小蜂孤雌产雌品系和两性品系为材料,比较研究两种品系在不同温度下未成熟期的生活史参数,以期解释两种品系对温度的适应性及其发生分布差异,同时为寄生蜂的应用实践提供指导。
1 材料方法
1.1 供试虫源
芙新姬小蜂孤雌产雌品系于2015年5月采自中国农业科学院蔬菜花卉研究所的蔬菜种植基地,寄主为美洲斑潜蝇,寄主植物为芥蓝Brassica alboglabra。在实验室采用单雌饲养方式建立室内种群。芙新姬小蜂两性品系于2016年7月采自海南省海口市海南大学实验地,寄主为美洲斑潜蝇,寄主植物为豇豆Vigna unguiculata。两种品系均用“矮生菜豆美洲斑潜蝇(2龄末~3龄初幼虫)系统”在人工气候箱(温度26℃±1℃,湿度40%~50%,光周期L∥D=14 h∥10 h)进行连代饲养。美洲斑潜蝇采自中国农业科学院植物保护研究所廊坊中试基地菜豆地。以实验室多代饲养的两种品系稳定种群供试。
1.2 温度对两种品系未成熟期生活史特性的影响
1.2.1 不同温度下两种品系未成熟期的发育历期
设置5个温度梯度,分别为18、22、26、30℃和34℃。将带有2龄末~3龄初美洲斑潜蝇幼虫(寄主密度约10头/叶)的菜豆Phaseolus vulgaris叶片剪下移入培养皿(直径9.0 cm,高1.6 cm)中,皿底用1%(琼脂/水的比例为1 g/100 mL)琼脂保湿,然后用封口膜密封并打孔以保持空气流通。每天上午08:00,将3日龄有交配经历的芙新姬小蜂两性品系的雌蜂和孤雌产雌品系各2~3头,分别移入培养皿供其产卵寄生,持续3 h后移出寄生蜂。然后将培养皿放入人工气候箱(温度26℃,相对湿度(50±5)%,光照周期L∥D=14 h∥10 h,光照08:00-22:00,黑暗:22:00-08:00)中供寄生蜂发育。每隔12 h(08:00和20:00各1次)在体视显微镜下观察记录寄生蜂的生长发育情况。寄生蜂羽化后,鉴别雌雄后分别移入1.5 mL离心管,迅速冻死并储存于-40℃冰箱保存备用。
1.2.2 不同温度下初羽化雌蜂的卵子发生情况及个体大小
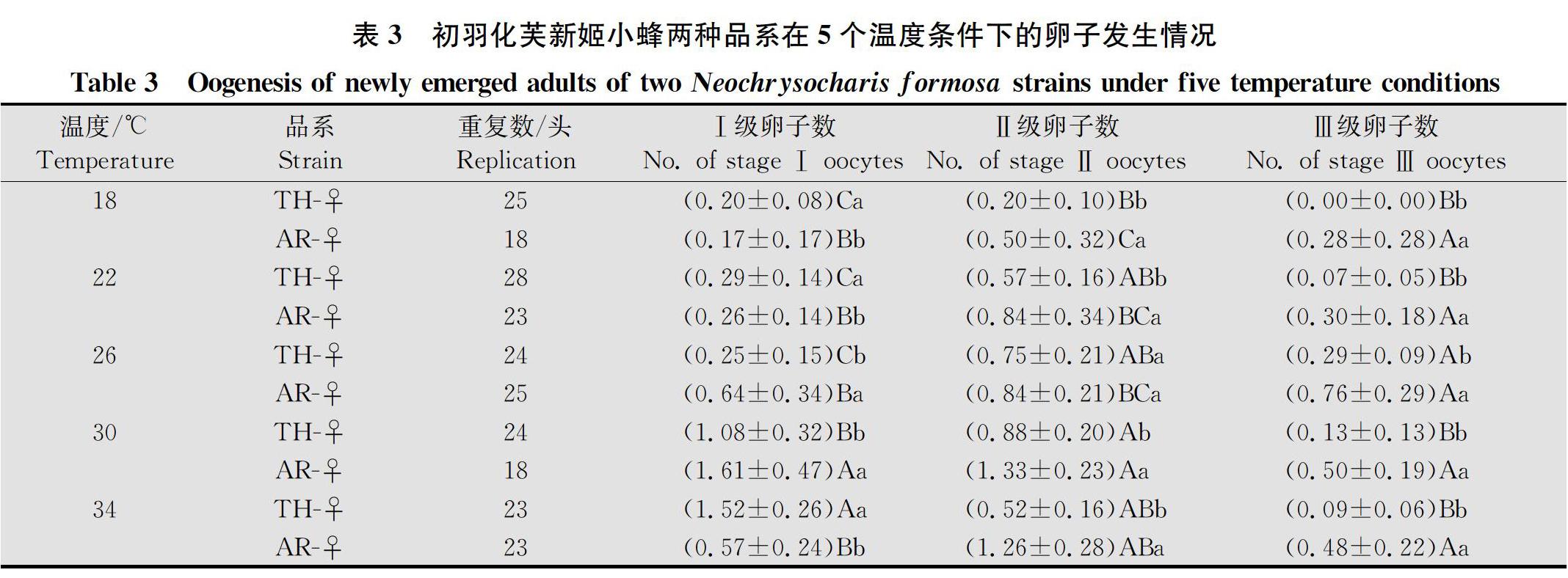
将上述试验中冰箱保存的雌蜂,首先在体视显微镜下测定其个体大小(体长、体宽和后足胫节长);然后解剖卵巢,观察并记录卵巢内卵子发生情况和各级卵子数量。参考Bodin等[27]和Liu等[28]的方法,将雌蜂卵母细胞按发育程度分为3个等级,以评价成虫的卵室/卵子发生动态。Ⅰ级卵子:卵室中卵黄沉积部分<1/2卵室总体积;Ⅱ级卵子:卵室中卵黄沉积部分≥1/2卵室总体积,但未充满整个卵室;Ⅲ级卵子:卵黄沉积部分已充满整个卵室,即卵子已成熟。Ⅰ级和Ⅱ级为未成熟卵,Ⅲ级为成熟卵。
1.3 数据统计与分析
采用统计分析软件SAS 9.0对数据进行比较分析。寄生蜂的卵幼虫历期、蛹歷期、未成熟历期和卵子发生情况均采用非参数检验(Kruskal-Wallis test检验)检验两种品系的差异显著性;体长采用单因素方差分析,利用统计软件中单因素方差分析(One-way ANOVA)进行差异显著性检验;所有的检验都在P=0.05水平下进行。
2 结果与分析
2.1 不同温度下两种品系未成熟期的发育历期
2.1.1 不同温度下同一品系寄生蜂发育历期比较
温度对孤雌产雌品系、两性品系雌蜂和两性品系雄蜂的发育历期均有显著影响,表现为随着温度的升高,发育历期逐渐缩短(表1)。孤雌产雌品系的卵幼虫期(χ2=101.657 0,df=4,P<0.000 1)、蛹期(χ2=103.100 4,df=4,P<0.000 1)和未成熟期(χ2=104.587 2,df=4,P<0.000 1)在不同温度下存在显著差异。不同温度下两性品系雌蜂的卵幼虫期(χ2=62.887 3,df=4,P<0.000 1)、蛹期(χ2=68.567 1,df=4,P<0.000 1)和未成熟期(χ2=65.089 2,df=4,P<0.000 1)也存在显著性差异,但卵幼虫期在26℃和30℃间没有显著差异,蛹期在18℃和22℃间没有显著差异。5个温度下两性品系雄蜂的卵幼虫期、蛹期和未成熟期的显著性检验结果分别为:χ2=93.177 0,df=4,P<0.000 1;χ2=90.389 0,df=4,P<0.000 1;χ2=95.566 9,df=4,P<0.000 1,同一虫态不同温度下的发育历期两两之间存在显著差异。
2.1.2 同一温度条件下品系间和品系内的寄生蜂发育历期比较
同一温度下,两性品系雌蜂和雄蜂的发育历期存在差异(表1)。孤雌产雌品系、两性品系雌蜂和两性品系雄蜂之间的卵幼虫期(χ2=22.473 6,df=2,P<0.000 1)、蛹期(χ2=10.043 5,df=2,P=0.006 6)和未成熟期(χ2=18.041 5,df=2,P=0.000 1),在18℃条件下均分别存在显著差异;在22℃条件下,则卵幼虫期(χ2=8.903 5,df=2,P=0.011 7)和未成熟期(χ2=6.4497,df=2,P=0.000 2)分别存在显著差异,孤雌产雌品系和两性品系雌蜂的卵幼虫期均长于两性品系雄蜂,两性品系雌蜂的未成熟期长于孤雌产雌品系和两性品系雄蜂,而蛹期(χ2=5.072 6,df=2,P=0.079 2)则无显著差异;在26℃条件下,卵幼虫期(χ2=17.140 7,df=2,P=0.000 2)、蛹期(χ2=16.742 5,df=2,P=0.000 2)和未成熟期(χ2=35.381 7,df=2,P<0.000 1)均分别存在显著差异;在30℃条件下,卵幼虫期(χ2=19.576 3,df=2,P<0.000 1)和未成熟期(χ2=15.504 8,df=2,P=0.000 4)分别存在显著差异,而蛹期无显著差异(χ2=2.260 8,df=2,P=0.322 9);在34℃条件下,卵幼虫期无显著差异(χ2=0.513 9,df=2,P=0.773 4),而蛹期(χ2=10.157 2,df=2,P=0.006 2)和未成熟期(χ2=9.755 1,df=2,P=0.007 6)则分别存在显著差异,两性品系雌蜂和雄蜂的蛹期与未成熟期均短于孤雌产雌品系。
孤雌产雌品系和两性品系雌蜂的卵幼虫期在18、26和30℃条件下均分别存在显著差异,孤雌产雌品系的卵幼虫期短;而在22℃和34℃条件下,则无显著差异;蛹期在18、22、26和30℃条件下,分别均无显著差异,而在34℃条件下,则存在显著差异,孤雌产雌品系的蛹期长;未成熟期在18、22、30和34℃条件下,存在显著差异,前3个温度,孤雌产雌品系的发育历期短,而在34℃条件下,则两性品系的发育历期短,而在26℃条件下,则二者无显著差异。
总体上,两性品系雌蜂的卵幼虫期、蛹期和未成熟期的发育历期均分别长于两性品系雄蜂;但卵幼虫期在22℃和34℃,蛹期在22、30℃和34℃,以及未成熟期在34℃条件下,两性品系雌蜂和雄蜂没有显著性差异。
1) 表中数据为平均值±标准误。TH-♀:孤雌产雌品系雌蜂;AR-♀:两性品系雌蜂;AR-♂:两性品系雄蜂;表中的大写字母表示同一品系寄生蜂不同温度下的差异显著性,小写字母表示同一温度下不同品系寄生蜂的差异显著性。下同。
Data in the table are means±SE. TH-♀: Thelytokous female; AR-♀: Arrhenotokous female; AR-♂: Arrhenotokous male. The capital letters indicate significant difference for the same wasp strain under five temperature conditions; the lowercase letters indicate significant difference for the different wasp strains at the same temperature. The same below.
2.2 不同温度下两种品系的个体大小
2.2.1 不同温度下同一品系寄生蜂的个体大小比较
孤雌产雌品系的体长整体上随温度升高呈现先增加后减少的趋势,在26℃条件下最长,但不同温度条件下体长无显著性差异(F4, 117=2.40,P=0.054 1)(表2)。两性品系雌蜂和雄蜂的体长分别先减少而后增加而后再减少,且不同温度条件下两性品系雌蜂(F4, 108=5.62,P<0.000 1)和雄蜂(F4, 131=6.48,P<0.000 1)的体长均分别差异显著,其中两性品系雌蜂体长在30℃下最长,雄蜂体长在26℃最长,而在22℃下,两者均最短。
2.2.2 同一温度条件下不同品系寄生蜂的个体大小比较
两种品系的个体大小存在差异(表2)。在5个温度条件的同一温度下,两性品系雌蜂的体长均分别显著长于孤雌产雌品系和两性品系雄蜂的体长;而孤雌产雌品系的体长在18、22和34℃下的体长均分别显著长于两性品系雄蜂体长,在26℃和30℃下的两者体长无显著差异。
2.3 不同温度下两种品系初羽化雌蜂的卵子发生情况
2.3.1 不同温度下同一品系的雌蜂卵子发生情况比较
两种品系初羽化雌蜂的卵子数均较少,温度影响两种品系的卵子发生,适度高温促进卵子数的增加(表3)。对孤雌产雌品系来说,温度显著影响初羽化雌蜂的Ⅰ级卵子数(χ2=34.157 0,df=4,P<0.000 1)和Ⅲ级卵子数(χ2=12.969 1,df=4,P=0.011 4),但对Ⅱ级卵子数无显著影响(χ2=0.123 2,df=4,P=0.940 3);Ⅰ级卵子数在34℃条件下显著多于其余4个温度处理,在30℃条件下显著多于18、22和26℃处理;18、22和26℃处理间无显著差异;Ⅱ级卵子数在30℃条件下显著多于18℃处理,22、26和34℃间无显著差异;Ⅲ级卵子数在26℃条件下显著高于其余4个温度处理,18、22、30和34℃条件下Ⅲ级卵子数量无显著差異。
对两性品系雌蜂来说,温度显著影响初羽化雌蜂的Ⅰ级卵子数(χ2=15.980 6,df=4,P=0.003 0)和Ⅱ级卵子数(χ2=15.452 8,df=4,P=0.003 8),但对Ⅲ级卵子数无显著影响(χ2=3.352 7,df=4,P=0.500 6);Ⅰ级卵子数在30℃条件下显著多于其余4个温度处理;18、22、26和34℃处理间无显著差异;Ⅱ级卵子数在30℃条件下显著高于18、22和26℃处理,34℃处理显著高于18℃,30℃处理与34℃无显著性差异,18、22和26℃处理无显著性差异;Ⅲ级卵子数在5个温度间均无显著差异,但卵子数整体上随温度升高呈现先上升后下降的趋势,26℃成熟卵子量相对最高。
[7] SHAHREKI Z, RAKHSHANI E, SASAKAWA M. A contribution to the agromyzid leaf miners (Diptera: Agromyzidae) of Kermanshah, Iran [J]. Journal of the Entomological Research Society, 2013, 40(15):101107.
[8] MAZUMDAR S, BHUIYA B A. Parasitoids (Hymenoptera) of leafminer flies (Diptera: Agromyzidae) from Bangladesh [J]. Journal of Threatened Taxa, 2016, 8(4): 87148718.
[9] CHEN Xuexin, LANG Fayong, XU Zhihong, et al. The occurrence of leafminers and their parasitoids on vegetables and weeds in Hangzhou area, Southeast China [J]. BioControl, 2003, 48(5): 515527.
[10]康樂. 斑潜蝇的生态学与持续控制[M]. 北京: 科学出版社, 1996.
[11]相君成, 雷仲仁, 王海鸿, 等. 三种外来入侵斑潜蝇种间竞争研究进展[J]. 生态学报, 2012, 32(5): 16161622.
[12]王伟, 王文霞, 刘万学, 等. 芙新姬小蜂生物学特性及其应用研究进展[J]. 中国生物防治学报, 2012, 28(4): 575582.
[13]刘万学, 王文霞, 王伟, 等. 潜蝇姬小蜂属寄生蜂对潜叶蝇的控害特性及应用[J]. 昆虫学报, 2013, 56(4): 427437.
[14]曹利军, 宫亚军, 朱亮, 等. 豌豆彩潜蝇幼期各虫态的形态学研究[J]. 昆虫学报, 2014, 57(5): 594600.
[15]PARRELLA M P, HEINZ K M, FERRENTINO G W. Biological control of Liriomyza trifolii on glasshouse chrysanthemums [J]. Bulletin SROP, 1987, 10(2): 149151.
[16]FERGUSON J S. Development and stability of insecticide resistance in the leafminer Liriomyza trifolii (Diptera: Agromyzidae) to cyromazine, abamectin, and spinosad [J]. Journal of Economic Entomology, 2004, 97(1): 112119.
[17]LIU Tongxian, KANG Le, HEINZ K M, et al. Biological control of Liriomyza leafminers: progress and perspective [J]. Perspectives in Agriculture, Veterinary Science, Nutrition and Natural Resources, 2009, 4(4): 116.
[18]FERGUSON S, PINEDA O. Putative polymerase chain reaction markers for insecticide resistance in the leafminer Liriomyza trifolii (Diptera: Agromyzidae) to cyromazine and abamectin [J]. Journal of Economic Entomology, 2010, 103(6): 21972203.
[19]GAO Yulin, LEI Zhongren, ABE Y, et al. Species displacements are common to two invasive species of leafminer fly in China, Japan, and the United States [J]. Journal of Economic Entomology, 2011, 104(6): 17711773.
[20]ZHANG Yibo, LU Shulong, LIU Wanxue, et al. Comparing immature development and life history traits in two coexisting host-feeding parasitoids, Diglyphus isaea and Neochrysocharis formosa (Hymenoptera: Eulophidae) [J]. Journal of Integrative Agriculture, 2014, 13(12): 26902700.
[21]LIU Wanxue, WANG Wenxia, ZHANG Yibo, et al. Adult diet affects the life history and host-killing behavior of a host-feeding parasitoid [J]. Biological Control, 2015, 81: 5864.
[22]肖悦, 王文霞, 张毅波, 等. 补充非寄主食物对芙新姬小蜂和潜蝇姬小蜂控害行为权衡的影响[J]. 环境昆虫学报, 2016, 38(6): 12311236.
[23]刘培培, 庄欣鑫, 肖悦, 等. 高温下成虫食物对芙新姬小蜂生活史及控害潜力影响[J]. 环境昆虫学报, 2018, 40(2): 452460.
[24]LIU Wanxue, WANG Wenxia, WANG Wei, et al. Characteristics and application of Diglyphus parasitoids (Hymenoptera: Eulophidae: Eulophinae) in controlling the agromyzid leafminers [J]. Acta Entomologica Sinica, 2013, 4(4): 427437.
[25]TAGAMI Y, DOI M, SUGIYAMA K, et al. Survey of leafminers and their parasitoids to find endosymbionts for improvement of biological control [J]. Biological Control, 2006, 38(2): 210216.
[26]杨月梅, 轩景丽, 叶福宇, 等. 中国新发现芙新姬小蜂孤雌产雌品系的分子鉴定及其内共生菌Rickettsia的检测[J]. 昆虫学报, 2017, 60(5): 582593.
[27]BODIN A, JALOUX B, DELBECQUE J P, et al. Reproduction in a variable environment: how does Eupelmus vuilleti, a parasitoid wasp, adjust oogenesis to host availability? [J]. Journal of Insect Physiology, 2009, 55(7): 643648.
[28]LIU Wanxue, WANG Wei, CHENG Lisheng, et al. Contrasting patterns of ovarian development and oogenesis in two sympatric host-feeding parasitoids, Diglyphus isaea and Neochrysocharis formosa (Hymenoptera: Eulophidae) [J]. Applied Entomology and Zoology, 2014, 49(2): 305314.
[29]HEIMPEL G E, DE BOER J G. Sex determination in the Hymenoptera [J]. Annual Review of Entomology, 2008, 53(1): 209230.
[30]VAN DER KOOI CASPER J, MATTHEY-DORET C, SCHWANDER T. Evolution and comparative ecology of parthenogenesis in haplodiploid arthropods [J]. Evolution Letters, 2017, 1(6): 304316.
[31]STOUTHAMER R, LENTEREN J C V. The use of unisexual wasps in biological control [M]∥VAN LENTEREN J C. Quality control and production of biological control agents: theory and testing procedures. CABI Publishing, 2003:93113.
[32]MA W J, SCHWANDER T. Patterns and mechanisms in instances of endosymbiont-induced parthenogenesis [J]. Journal of Evolutionary Biology, 2017, 30(5): 868888.
[33]YE Fuyu, ZHU Chaodong, YEFREMOVA Z, et al. Life history and biocontrol potential of the first female-producing parthenogenetic species of Diglyphus (Hymenoptera: Eulophidae) against agromyzid leafminers [J/OL]. Scientific Reports, 2018, 8(1): 3222. DOI:10.1038/s41598018209723.
[34]ADACHI-HAGIMORI T, MIURA K, ABE Y. Gene flow between sexual and asexual strains of parasitic wasps: a possible case of sympatric speciation caused by a parthenogenesis-inducing bacterium [J]. Journal of Evolutionary Biology, 2011, 24(6): 12541262.
[35]JERVIS M, FERNS P. Towards a general perspective on life-history evolution and diversification in parasitoid wasps [J]. Biological Journal of the Linnean Society, 2011, 104(2): 443461.
[36]HEIMPEL G E, COLLIER T R. The evolution of host-feeding behaviour in insect parasitoids [J]. Biological Reviews of the Cambridge Philosophical Society, 1996, 71(3): 373400.
(責任编辑:田 喆)
收稿日期: 20190302 修订日期: 20190516
基金项目:国家自然科学基金(31772236);国家重点研发计划(2016YFC1201200);北京市自然科学基金(6142016)
致 谢: 参加本试验部分工作的还有江代礼、谭翰杰、张能和纪烨斌等同学,特此一并致谢。
通信作者 E-mail:guojianyang@caas.cn
#为并列第一作者

