玻璃体腔注射TA对光化学诱导大鼠BRVO模型血管生成及Notch通路的影响
韩莎莎, 张贺鹏, 李跃峰
0引言
视网膜静脉阻塞(retinal vein occlusion,RVO)是视网膜血管病变造成的眼部血管病,影响视力,严重时使患者失明[1],视网膜分支静脉阻塞(branch retinal vein occlusion,BRVO)是其中一种类型,可通过治疗缓解症状。曲安奈德(triamcinolone acetonide,TA)属于肾上腺皮质激素类药物,因抗炎和抗过敏作用强且时间久在眼科疾病中应用广泛,可减少BRVO患者眼内新生血管生成[2],但具体作用机制尚不明确。新生血管受多种基因调控,其中血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是作用最强、特异性最高的血管生长因子之一,几乎参与血管形成的所有步骤[3];Notch信号通路在血管生成中的作用已明确,可促进血管生成[4],能促进VEGF激活从而发挥促血管生成作用等[5]。本研究通过构建化学诱导大鼠BRVO模型,观察TA对BRVO大鼠的新生血管的抑制作用并探讨其作用机制,旨在揭示其抑制血管新生的分子机制。
1材料和方法
1.1材料
1.1.1实验动物雄性SD大鼠购自广州医科大学实验动物中心,许可证号:SYXK(粤)2016-0158,体质量200~230g,SPF级。所有大鼠均饲养于温度23℃±2℃、湿度50%±10%,光照/黑暗12h/12h环境中,均自由饮水饮食。所有实验均经本院动物实验伦理委员会批准。
1.1.2试剂与仪器眼内灌注液(美国Alcon,进口注册标准:YZB/USA 0661),孟加拉红钠盐(上海北诺生物科技有限公司,货号:330000-1G),戊巴比妥钠缓冲液(吉林省神经精神病医院制药厂,国药准字:H1400546),40mg/mL TA注射液(昆明积大制药股份有限公司,国药准字:H53021604),荧光素钠注射液(广州白云山明兴制药有限公司,国药准字:H44023401),匀浆缓冲液(上海谷研实业有限公司,货号:GOY-0993),一抗VEGF、血管内皮生长因子受体(VEGF receptor 2,VEGFR2)、Notch1、Jagged1、DLL4、GADPH,二抗羊抗兔、羊抗鼠(英国abcam)。
眼科裂隙灯显微镜(意大利CSO,型号:SL990/SL980),Tonolab系眼压计(上海玉研科学仪器有限公司,型号:iCare Tonnlab),眼底荧光造影仪(日本Canon、型号:CF-60UD)、光学相干断层扫描仪(日本Topcon,型号:3D OCT-1 Maestro)、蛋白印记(Western Blot,WB)曝光仪(上海天能科技有限公司,型号:Tanon4600)。
1.2方法
1.2.1制备光化学诱导BRVO大鼠模型实验前对所有大鼠眼科裂隙灯显微镜下检查眼部,未发现异常。60只大鼠参照文献中方法右眼单眼构建BRVO模型[6-7]。实验前用眼内灌注液配置好质量浓度为50mg/mL的孟加拉红钠盐,4℃避光保存备用。术前用2.5%戊巴比妥钠缓冲液45mg/kg腹腔注射麻醉并扩瞳。尾静脉注射孟加拉红钠盐溶液50mg/kg,1min后放置角膜接触三面镜。显微镜下按照龙盘等[6]操作方法寻找视盘颞侧第一个视网膜静脉主干分叉,光凝波长647nm、功率360mW、光斑大小100μm、持续时间0.05s激光光凝,单点光凝20点。镜下观察血流中断、形成静脉血栓,完全阻塞3个视网膜分支静脉即为造模成功。造模后4只死亡、3只白内障、1只视网膜凹陷、4只视网膜脱落严重,造模成功48只做后续实验。空白对照组14只大鼠注射同样体积的眼内灌注液处理。
1.2.2实验分组按随机数字法分为BRVO模型组14只、TA组34只,TA组术后按参照文献中方法给药8μL TA[8]。30G针头颞侧角膜缘后0.5mm做一穿刺口,微量注射器从穿刺口垂直进针约1.5mm,针尖可观察到在玻璃体内,缓慢注入8μL TA,显微镊子轻夹穿刺口片刻易于穿刺口闭合。TA组分别在玻璃体腔注射TA后1、7、21d进行观察。BRVO模型组和空白对照组按上述方法注入等体积、等渗眼内灌注液,BRVO模型组在光凝后1d做对照实验,空白对照组同一天进行实验。
每组随机选4只大鼠眼压计测量眼压状况;眼底彩照、荧光素眼底血管造影(fundus fluorescein angiography,FFA)及光学相干断层扫描(optical coherence tomography,OCT)观察大鼠眼底血管情况。空白对照组、BRVO组另外10只,TA组其余大鼠中TA注射1、7、21d选10只WB检测血管生成相关因子VEGF、VEGFR2,Notch通路重要因子Notch1、Jagged1、DLL4蛋白表达情况。
1.2.3眼压计测量眼压状况空白对照组、BRVO模型组、玻璃体腔注射TA后1、7、21d组分别在早上9∶00按1.2.1方法麻醉大鼠,麻醉10min后眼压计测每只大鼠右眼眼压,每只眼睛测量3次,取平均值。
1.2.4 FFA及OCT检测大鼠眼底血管情况各组大鼠检测眼压后散瞳,10% 2mL/kg荧光素钠注射液腹腔注射,待荧光素钠循环至眼底,眼底荧光造影仪按规范操作以视盘和激光光凝点为中心对大鼠右眼行FFA检查;FFA检查后行OCT检查,之后再行眼底照相。测量损伤处视网膜及损伤250μm处视网膜厚度,由两位操作熟练的工作人员测量和分析结果,取两位测量人员测量平均值为损伤处视网膜和损伤250μm处视网膜厚度。
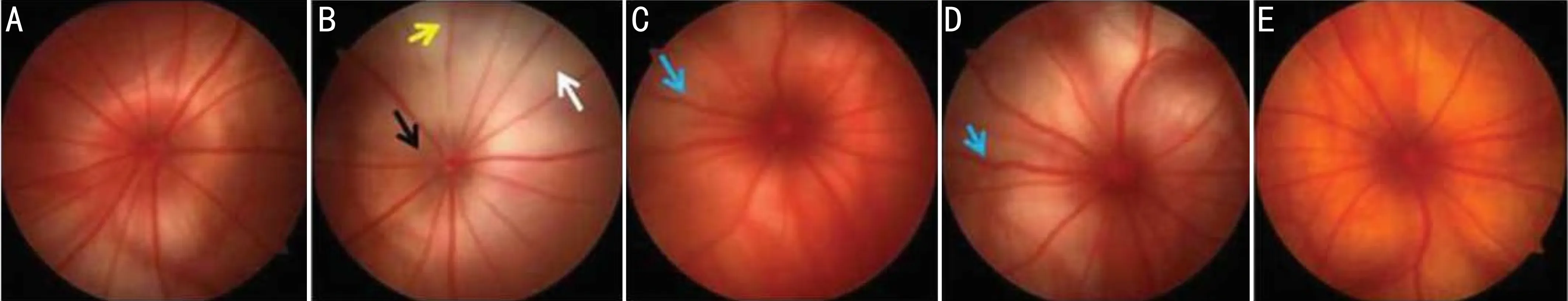
图1 各组大鼠眼底照相观察视网膜情况比较 A:空白对照组;B:BRVO模型组;C:玻璃体腔注射TA后1d组;D:玻璃体腔注射TA后7d组;E:玻璃体腔注射TA后21d组。白色箭头:视网膜变白;黑色箭头:视盘凹消失;黄色箭头:视网膜血管收缩;蓝色箭头:血管扩张和弯曲。

图2 各组大鼠FFA情况比较 A:空白对照组;B:BRVO模型组;C:玻璃体腔注射TA后1d组;D:玻璃体腔注射TA后7d组;E:玻璃体腔注射TA后21d组。黑色箭头:荧光渗漏;白色箭头:血管扩张和弯曲;矩形:血管阻塞。
1.2.5 WB检测大鼠视网膜VEGF、VEGFR2、Notch1、Jagged1、DLL4蛋白表达情况各组选取10只大鼠快速处死,解剖显微镜下摘取大鼠右眼视网膜,WB检测大鼠视网膜VEGF、VEGFR2、Notch1、Jagged1、DLL4蛋白表达情况。-80℃冰箱保存待用。
冰箱中取出视网膜,每个组织加100μL匀浆缓冲液,冰上匀浆,低温离心机4℃、10000r/min离心15min,取上清放入新的离心管中测总蛋白。每孔总蛋白上样量20μL,经SDS-凝胶电泳分离后,蛋白质转至PVDF膜上,5%脱脂奶粉室温封闭2h,3%牛血清白蛋白稀释VEGF、VEGFR2、Notch1、Jagged1、DLL4、GADPH,一抗4℃孵育过夜;加入对应二抗室温孵育1h。WB曝光仪检测目标蛋白信号并分析。
统计学分析:采用SPSS 22.0软件进行统计学分析,计量数据均采用均数±标准差表示,先采用单因素方差分析各组间总体比较,若存在差异则使用Dunnett-t检验行组间两两比较,以P<0.05为差异有统计学意义。
2结果
2.1各组大鼠各项指标比较各组大鼠眼压比较差异有统计学意义(F=3.3817,P=0.025)。各组大鼠损伤处视网膜厚度比较差异有统计学意义(F=5.292,P=0.007)。各组大鼠损伤250μm处视网膜厚度比较差异有统计学意义(F=10.982,P<0.001)。各组大鼠VEGF蛋白含量比较差异有统计学意义(F=73.272,P<0.001)。各组大鼠VEGFR2蛋白含量比较差异有统计学意义(F=23.636,P<0.001), 见表1。
2.2各组大鼠眼底照相情况比较空白对照组眼底血管排列整齐、状态清晰。BRVO模型组眼底出现水肿,视网膜变白,血管排列紊乱,并伴随有视盘凹消失、视网膜血管收缩症状。玻璃体腔注射TA后1d组水肿减轻,视网膜苍白减少,出现血管扩张和弯曲,视网膜血管紊乱。玻璃体腔注射TA后7d组视网膜变白加重,血管扩张和弯曲现象严重。玻璃体腔注射TA后21d组血管弯曲减轻、视网膜变白消失,视盘凹恢复,见图1。
2.3各组大鼠FFA情况比较正常组视网膜荧光在血管中均匀分布。BRVO模型组视网膜血管荧光素渗漏明显。玻璃体腔注射TA后1d组未观察到荧光渗漏情况,但血管扩张弯曲严重、血管部分血管荧光不完整。玻璃体腔注射TA后7、21d组无荧光现象,血管弯曲现象逐渐缓解,见图2。
2.4各组大鼠OCT检查比较与正常对照组相比,BRVO模型组损伤处视网膜、损伤250μm处视网膜厚度增加,差异均有统计学意义(P=0.050、0.016)。与BRVO模型组相比,玻璃体腔注射TA后1d组损伤250μm处视网膜厚度减少,差异有统计学意义(P=0.048);玻璃体腔注射TA后7、21d组损伤处视网膜、损伤250μm处视网膜厚度均减少,差异均有统计学意义(P<0.05),见表1,图3。
2.5各组大鼠视网膜血管生成相关因子VEGF、VEGFR2蛋白表达情况与空白对照组相比,BRVO模型组VEGF、VEGFR2蛋白表达升高,差异均有统计学意义(P<0.05)。与BRVO模型组相比,玻璃体腔注射TA后1、7d组VEGFR2蛋白表达降低,玻璃体腔注射TA后21d组VEGF、VEGFR2蛋白表达均降低,差异均有统计学意义(P<0.05),见表1,图4。
2.6各组大鼠视网膜Notch通路重要因子Notch1、Jagged1、DLL4蛋白表达情况与空白对照组相比,BRVO模型组Notch1、Jagged1蛋白表达升高,DLL4蛋白表达降低,差异均有统计学意义(P<0.05)。与BRVO模型组相比,玻璃体腔注射TA后1、7、21d组Notch1、Jagged1蛋白表达降低,玻璃体腔注射TA后TA7、21d组DLL4蛋白表达升高,差异均有统计学意义(P<0.05),见表2,图5。
李夏[16]针对真空碳热还原法提锌进行了研究。先采用真空碳热还原法提取锌,得到含锌、氯化钠、氯化钾及部分微量金属的冷凝物;再经过水洗去除冷凝物中的氯化钠、氯化钾;随后采用真空蒸馏法去除铅、铝等微量金属元素,得到含碳和锌的成分,利用熔析法去除碳,得到锌;最后,真空控氧法得到纳米氧化锌。该方法较为新颖,但真空碳还原的要求较高,难以实现工业化生产。
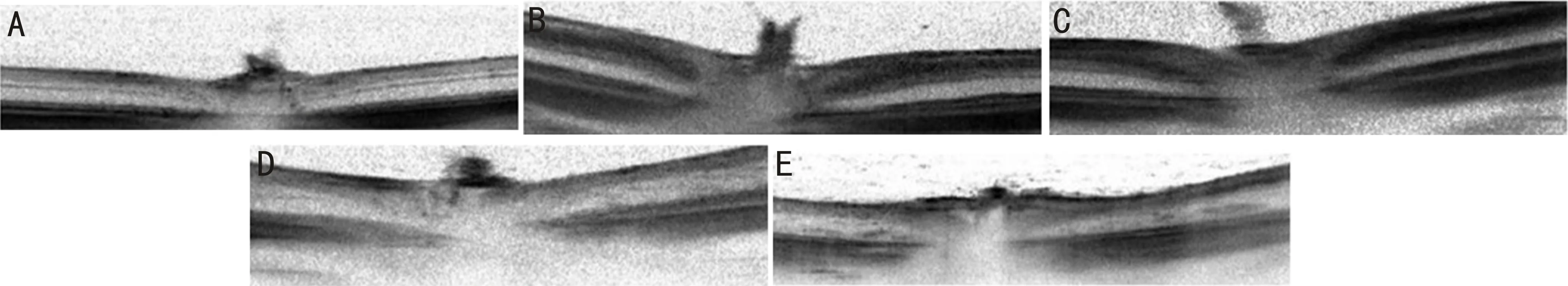
图3 各组大鼠OCT检查比较 A:空白对照组;B:BRVO模型组;C:玻璃体腔注射TA后1d组;D:玻璃体腔注射TA后7d组;E:玻璃体腔注射TA后21d组。
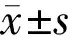

组别眼压(n=4,mmHg)损伤处视网膜厚度(n=4,μm)损伤250μm处视网膜厚度(n=4,μm)VEGF(n=10)VEGFR2(n=10)空白对照组17.58±0.85186.88±51.56191.52±16.320.04±0.020.39±0.13BRVO模型组23.85±3.66a286.77±63.22a245.53±27.88a0.76±0.21a0.56±0.09a玻璃体腔注射TA后1d组25.63±5.62217.85±69.37208.17±11.52c0.81±0.130.47±0.08c玻璃体腔注射TA后7d组21.56±3.57110.88±57.34c167.56±16.41c0.68±0.120.35±0.11c玻璃体腔注射TA后21d组18.81±0.86c156.23±42.56c186.68±11.56c0.21±0.09c0.17±0.04c F3.38175.29210.98273.27223.636P0.0250.007<0.001<0.001<0.001
注:aP<0.05vs空白对照组;cP<0.05vsBRVO模型组。

图4 各组大鼠视网膜VEGF、VEGFR2表达情况。
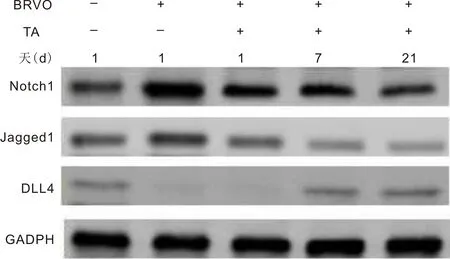
图5 各组大鼠视网膜Notch通路重要因子Notch1、Jagged1、DLL4蛋白表达情况。
3讨论
RVO属常见的眼底血管病,临床表现为视网膜血液瘀滞、静脉迂曲扩张、视网膜出血和水肿等血管异常症状,会导致患者视力下降或部分视野缺陷,分为中央RVO和BRVO,且BRVO发病率高于中央RVO[9]。Khayat等[10]研究结果发现,视网膜缺血会造成视力丧失、增加新血管并发症风险。本研究发现BRVO模型组眼底彩照发现视网膜变白,血管排列紊乱,视盘凹消失,视网膜血管收缩,FFA发现视网膜血管荧光素渗漏明显、出现血管不完整,阻塞现象,造模成功。进一步研究发现,BRVO模型组损伤处视网膜、损伤250μm处视网膜厚度增加,眼压升高,BRVO使眼压升高,视网膜受到损害,血管出现异常。玻璃体腔注射TA可缓解大鼠BRVO症状[11],TA作为肾上腺皮质激素类药物,可减轻充血,降低毛细血管的通透性,在眼科疾病中应用广泛,可缓解BRVO引起的血管增生现象[12]。本研究发现,与BRVO模型组相比,随着时间延长,TA使视网膜水肿减轻、视网膜苍白减少、血管扩张和弯曲、视盘凹恢复,血管弯曲现象逐渐缓解,损伤处视网膜、损伤250μm处视网膜厚度降低,眼压降低。提示TA可使眼底血管水肿、视网膜血管收缩现象逐渐好转,可缓解视网膜及其250μm处视网膜损伤症状,可缓解BRVO带来眼压升高症状,对治疗BRVO有一定的疗效,但具体机制尚未清楚。


组别Notch1Jagged1DLL4空白对照组0.24±0.060.17±0.060.12±0.03BRVO模型组1.21±0.42a0.36±0.08a0.01±0.00a玻璃体腔注射TA后1d组0.68±0.21c0.16±0.04c0.02±0.01玻璃体腔注射TA后7d组0.63±0.19c0.13±0.02c0.11±0.02c玻璃体腔注射TA后21d组0.28±0.06c0.12±0.02c0.13±0.02cF28.95638.99293.611P<0.001<0.001<0.001
注:aP<0.05vs空白对照组;cP<0.05vsBRVO模型组。
VEGF是血管生成中最关键的血管生成刺激因子,几乎参与所有生理和病理性血管生成过程,已被验证可以促进血管生成[13]。VEGFR2是VEGF介导血管生成的主要受体,VEGF过表达可激活VEGFR2,激活后的VEGFR2可促进内皮细胞分裂、促进细胞增殖,进而促进血管生成[14]。临床上抗VEGF注射联合玻璃体切除的动静脉鞘管切开术可用于治疗BRVO[15]。本研究发现,与空白对照组相比,BRVO模型组VEGF、VEGFR2蛋白表达升高。与BRVO模型组相比,玻璃体腔注射TA后7d组VEGFR2蛋白表达降低,玻璃体腔注射TA后21d组VEGF、VEGFR2蛋白表达降低。提示BRVO可使促血管生成因子VEGF、VEGFR2表达量升高进而促进血管形成,加快BRVO疾病进程;TA可降低促血管生成因子生成,缓解血管生成,从而治疗BRVO。
Notch信号通路可使血管稳定性加强、促进血管平滑肌细胞分化以及促进血管动静脉分化,加速血管生成[16]。在信号通路中Notch1可促进血管新生及血管发展,Jagged1和DLL4是Notch信号通路中两个重要配体,在血管形成中存在平衡关系,起相反作用。Jagged1能促进血管动脉化和促进造血干细胞形成,可抑制DLL4的激活从而加强血管生成作用,同时还发现可激活VEGF[17]。DLL4可抑制血管出芽过程中端细胞的形成从而抑制血管新生[18]。但是尚未发现Notch信号通路在BRVO中相关研究。本研究发现,与空白对照组相比,BRVO模型组Notch1、Jagged1蛋白表达升高,DLL4蛋白表达降低,提示BRVO可能通过激活Notch信号通路,促进血管动脉化和促进造血干细胞形成、抑制端细胞形成、从而加速血管形成。与BRVO模型组相比,玻璃体腔注射TA后1、7、21d组Notch1、Jagged1蛋白表达降低,玻璃体腔注射TA后7、21d组DLL4蛋白表达升高,提示TA可缓解BRVO激活的Notch信号通路,减少血管动脉化和造血干细胞生成,促进端细胞形成,抑制血管形成;同时抑制血管生成刺激因子VEGF的表达,使血管生成相关细胞的分裂、增殖受到抑制,进而抑制血管形成,达到缓解BRVO疾病目的。
综上所述,TA可能通过抑制Notch通路激活,抑制VEGF表达,减轻血管生成,实现对BRVO保护作用。本研究只对BRVO模型组光凝1d进行了研究,没有做后期对照研究,是本文不足之处,也是下一步研究重点;且深入探讨Notch通路与VEGF的作用机制是下一步需要深入探讨的内容。

