STAT5通路抑制剂对脂多糖诱导RAW264.7细胞的保护作用研究
卢永申,魏 明
0 引言
细胞内与心脑血管以及神经信号传递有关的物质中,一氧化氮(NO)占有相当重要的地位[1-3],但在机体的炎性病变过程中,高负荷的NO能够使身体机能遭受到较大的损伤,实验发现,当机体内积聚过多的NO时,其线粒体的功能损伤,同时,细胞自行凋亡[4-5]。在严重败血症中,过量的NO可以使细胞产生严重损伤[6]。诱导型的一氧化氮合酶(iNOS)能够促进高浓度的NO产生,生成的高浓度NO可以与超氧阴离子相互作用产生过氧化亚硝基阴离子,从而使细胞中的脂类物质过度氧化、蛋白质的酪氨酸发生硝基化及巯基氧化等,进而导致体内多类炎性病变的产生[7],所以,严格把控机体内NO的含量对避免NO造成的毒性伤害有至关重要的作用。STAT5通路抑制剂是一种多巴胺受体的拮抗剂,在临床治疗上多用于精神分裂症患者。在2011年,Nelson等[8]首次提出,其作为STAT5通路的抑制剂,具有治疗慢性髓系白血病的药效。基于此,我们推测STAT5通路抑制剂对巨噬细胞iNOS的表达也可能有调节的作用。本实验用脂多糖(LPS)使小鼠巨噬细胞发生炎性反应,从而构建模型[9],以STAT5通路抑制剂为工具药物来探究STAT5通路对iNOS表达的内在调节效果。
1 材料与方法
1.1 细胞来源 小鼠巨噬细胞株RAW264.7购于中国科学院细胞库。
1.2 药品、试剂以及主要仪器 STAT5通路抑制剂对照品以及LPS均购自Sigma公司(America),双抗、DMEM培养基以及胎牛血清购自Gibco公司(America),总RNA提取试剂Trizol、逆转录试剂盒和SYBR Green qPCR Super Mix-UDG kit试剂购自大连宝生物工程公司,Griess检测试剂盒、四甲基偶氮唑蓝(MTT)、蛋白质裂解液、二喹啉甲酸(BCA)蛋白质测试剂盒和羊抗兔的二抗均购自碧云天生物公司,磷酸化STAT5(p-STAT5)和总量STAT5单抗购自Bioworld公司(America),iNOS和甘油醛-3-磷酸脱氢酶(GAPDH)单抗购自Cell Signaling Technology公司(America)。实时定量荧光聚合酶链式反应(RT-PCR)仪ABI 7500型,购自America Applied Biosystems公司,多功能酶标仪购自America Bio-Rad公司。
1.3 细胞培养 使用带有双抗(100 μg/ml青霉素+100 μg/ml链霉素)以及10%胎牛血清的DMEM培养基培育RAW264.7细胞,然后将其放于5%CO2、37 ℃的细胞培养箱里恒温培养,当其孵育到融合度达到70%~80%之后开始传代培养。
1.4 MTT方法测定细胞活性 将对数生长期RAW264.7细胞按照104个/孔接种到96孔板中,细胞贴壁过夜,分别加入0、2.5、5.0、10 μmol/L的STAT5通路抑制剂反应24 h后,单孔中加入20 μl MTT液(5 mg/ml),于37 ℃下培养4 h,除去板中的营养液,给予150 μl二甲基亚砜(DMSO),将细胞放在摇床上摇动10 min使结晶物质完全溶解,之后用酶标仪在波长450 nm处测定光密度(OD)。
1.5 Griess方法测定细胞中NO的含量 参照文献[9-10]将对数生长期的RAW264.7细胞用2×105个/孔的密度接种于24孔板上,细胞贴壁过夜,分别设为空白对照组、STAT5通路抑制剂(10 μmol/L)对照组(STAT5通路抑制剂对照组)、LPS诱导(LPS 1 μg/ml)组(LPS诱导组),其中LPS诱导组分为4个亚组[1 μg/ml LPS诱导组(LPS诱导组)、1 μg/ml LPS+2.5 μmol/L STAT5通路抑制剂组(STAT5通路抑制剂组低浓度组)、1 μg/ml LPS+5 μmol/L STAT5通路抑制剂组(STAT5通路抑制剂组中浓度组)、1 μg/ml LPS+10 μmol/L STAT5通路抑制剂组(STAT5通路抑制剂组高浓度组)],在LPS诱导前30 min使用STAT5通路抑制剂进行处理,每组设3个复孔。细胞放于培养箱中培养24 h,测定各组培养上清液的NO含量。按照公式计算NO抑制率。
1.6 RT-PCR检测细胞中iNOS mRNA的表达 将对数生长期的RAW264.7细胞以1×106个/孔的密度种到6孔板里,细胞贴壁生长过夜,按照“1.5”项方法分别进行分组以及给药。放于培养箱中培养6 h之后,用Trizol方法提取细胞总量RNA,然后将提取出的RNA进行定量后用逆转录方法取得cDNA。用RT-PCR仪操作qPCR。由上海英潍捷基公司进行引物制作,iNOS上游的引物序列:5′-TCCATGACTCCCAGCACA-3′,下游的序列:5′-CCATCTCCTGCATTTCTTCC-3′,长度557 bp;GAPDH上游的序列:5′-GGTGAAGGTCGGTGTGAACG-3′,下游的序列:5′-CTCGCTCCTGGAAGATGGTG-3′,长度107 bp。反应条件:50 ℃ 2 min,95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环。扩增后以溶解曲线判定扩增产物的特异性效果。数据均应用相对定量的ΔΔCt方法来处理,使用iNOS mRNA/GAPDH作为评价方法,同时计算出iNOS mRNA的抑制率。
1.7 Western blot检测细胞中iNOS、STAT5以及p-STAT5蛋白表达水平 将对数生长期的RAW264.7细胞按照“1.6”项的接种方法接种培养,同时按照“1.5”项方法分别进行分组以及给药。采用蛋白提取试剂盒的方法提取每组细胞中总蛋白,用BCA蛋白定量法检测样品中蛋白质的量。用20~50 μg的总蛋白加入上样缓冲液加热至沸腾后,进行SDS-PAGE的电泳,用半干转法把胶条中的蛋白转移到PVDF膜上,再用5%的脱脂奶粉于25 ℃下封闭1 h,用封闭液将相对应的一抗进行稀释,同时反应1 h,洗膜之后添加用辣根过氧化物酶标记的二抗,于25 ℃下培养1 h,洗膜之后用电化学发光(ECL)试剂盒进行发光操作,X片曝光成像。应用凝胶分析软件算出压片条带的灰度值,以iNOS/GAPDH、p-STAT5/STAT5计算各个组蛋白质的相对表达量。

2 结果
2.1 STAT5通路抑制剂对RAW264.7细胞活性的作用 0、2.5、5.0、10 μmol/L的STAT5通路抑制剂和/或1 μg/ml LPS对RAW264.7细胞进行处理,结果发现,STAT5通路抑制剂和/或LPS均不影响细胞活性(P>0.05),表明STAT5通路抑制剂和/或LPS对RAW264.7细胞没有明显的细胞毒性反应,见表1。因此,本研究以下使用的STAT5通路抑制剂对照为10 μmol/L,LPS为1 μg/ml。
2.2 STAT5通路抑制剂对RAW264.7细胞中NO产生和释放的作用 RAW264.7细胞培养24 h后,空白对照组、STAT5通路抑制剂对照组、LPS诱导组以及STAT5通路抑制剂低、中、高浓度组细胞中NO的含量差异有统计学意义(F=25.69,P<0.05);低、中、高浓度STAT5通路抑制剂对RAW264.7细胞中释放NO的抑制率差异有统计学意义(F=132.49,P<0.05)。相较于空白对照组,LPS诱导组细胞中NO的量明显升高,差异有统计学意义(P<0.05)。与LPS诱导组比较,STAT5通路抑制剂中、高浓度组细胞中NO含量降低,差异有统计学意义(P<0.05),见表2、图1。

表1 STAT5通路抑制剂或/和脂多糖对RAW264.7细胞活性的影响(n=3)

图1 STAT5通路抑制剂对细胞中NO释放量的影响
注:A.空白对照组;B.STAT5通路抑制剂对照组;C.LPS诱导组;D.STAT5通路抑制剂低浓度组;E. STAT5通路抑制剂中浓度组;F. STAT5通路抑制剂高浓度组(下同)。与空白对照组比较,#P<0.05
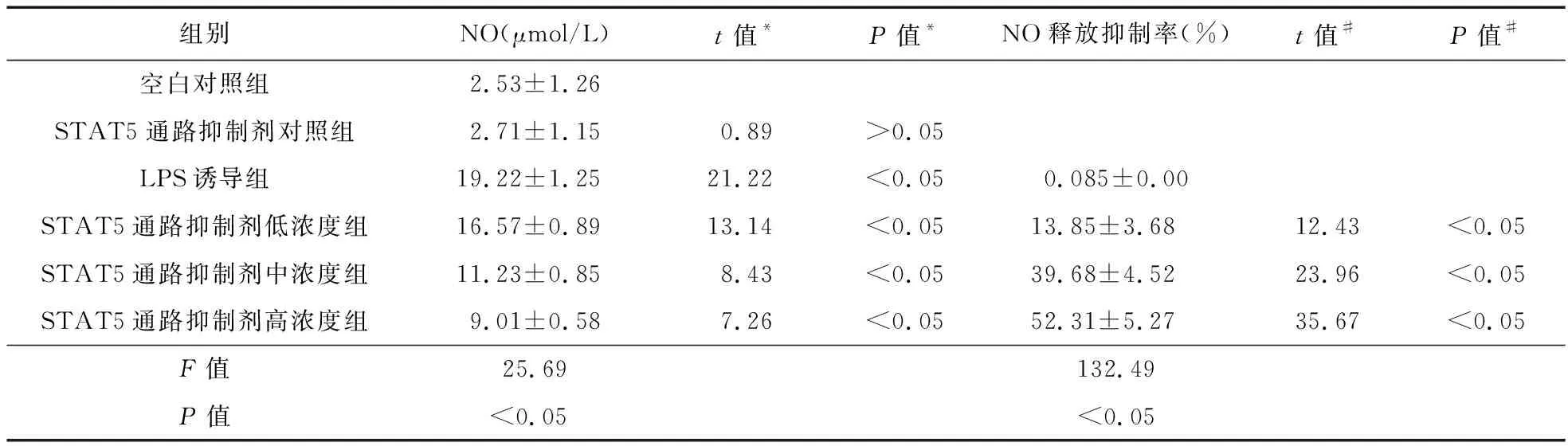
表2 STAT5通路抑制剂对细胞中NO释放量的影响(n=3)
注:*与空白对照组比较;#与LPS诱导组比较
2.3 STAT5通路抑制剂对RAW264.7细胞中iNOS mRNA以及蛋白质表达的作用 RAW264.7细胞培养24 h后,空白对照组、STAT5通路抑制剂对照组、LPS诱导组及STAT5通路抑制剂低、中、高浓度组细胞中内iNOS mRNA以及蛋白质的表达量比较差异有统计学意义(F=123.59、23.37,P<0.05);与空白对照组比较,LPS诱导组细胞iNOS mRNA以及蛋白质的表达量升高,差异有统计学意义(P<0.05)。与LPS诱导组比较,STAT5通路抑制剂中、高浓度组细胞iNOS mRNA及蛋白质的表达水平有所下降,差异有统计学意义(P<0.05)。见表3、图2、图3。

图2 各组细胞中iNOS mRNA表达

图3 各组细胞中iNOS蛋白表达
表3 各组细胞中iNOS mRNA以及蛋白质表达(n=3)

组别iNOS mRNA/GAPDHt值*P值*iNOS蛋白/GAPDHt值*P值*空白对照组1.00±0.001.00±0.00STAT5通路抑制剂对照组1.04±0.090.93>0.051.01±0.030.91>0.05LPS诱导组100.01±23.3489.26<0.0512.07±3.1212.54<0.05STAT5通路抑制剂低浓度组83.27±15.9868.37<0.059.15±2.018.76<0.05STAT5通路抑制剂中浓度组59.84±5.6748.76<0.058.15±1.897.28<0.05STAT5通路抑制剂高浓度组44.25±6.2933.48<0.054.26±1.295.12<0.05F值123.5932.37P值<0.05<0.05
注:*与空白对照比较
2.4 STAT5通路抑制剂对RAW264.7细胞内p-STAT5/STAT5的作用 RAW264.7细胞培养24 h后,空白对照组、STAT5通路抑制剂对照组、LPS诱导组以及STAT5通路抑制剂低、中、高浓度组的细胞内p-STAT5/STAT5表达差异有统计学意义(F=12.07,P<0.05)。与空白对照组比较,LPS诱导组细胞的p-STAT5/STAT5显著升高,差异有统计学意义(P<0.05)。与LPS诱导组比较,STAT5通路抑制剂中、高浓度组细胞的p-STAT5/STAT5明显下降,且差异有统计学意义(P<0.05)。见表4、图4。
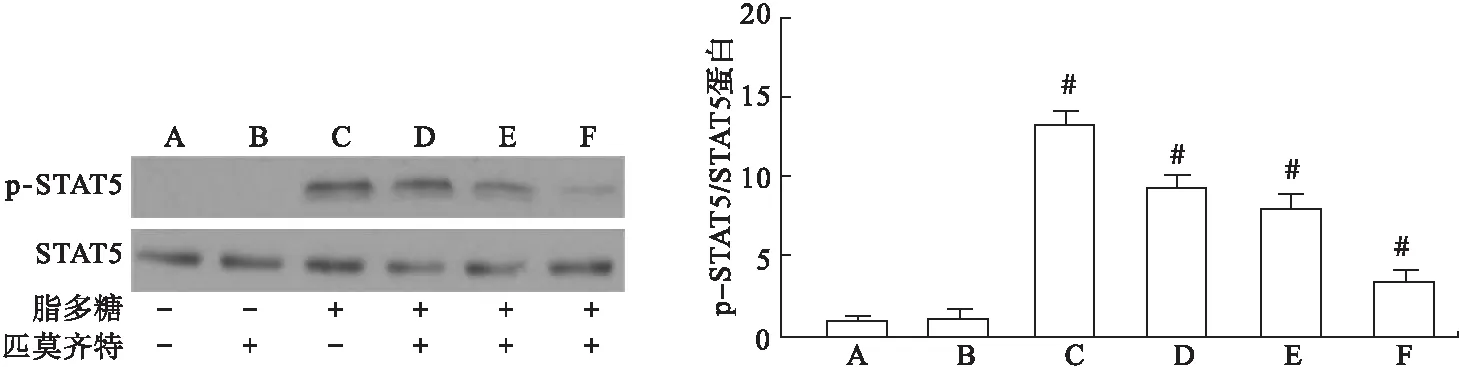
图4 各组细胞中p-STAT5/STAT5蛋白表达

表4 STAT5通路抑制剂对细胞内p-STAT5/STAT5蛋白的作用(n=3)
注:*与空白对照组比较
3 讨论
应对外界的多种创伤性刺激,满足机体自我防护的复杂防御过程是炎症的本质特征。而巨噬细胞在炎症发生发展的整个过程中都发挥了相当重要的作用。一方面通过抗原识别和递呈激活免疫系统,还可以产生许多炎性物质介导大范围的炎症级联过程。在炎症的发展过程中,NO作为一种重要的炎症因子发挥了重要作用。实验表明,敲除相应的基因或采用药物干预治疗等方法阻碍NO的合成能够显著缓解患者或实验动物的炎症病变[11-12]。
大部分的细胞基因转录受到抑制是由于在转录因子的激活过程中一个或多个信号转导分子被阻断造成的[13-14]。为了探讨STAT5抑制剂对RAW264.7细胞活性的影响,本实验以2.5、5.0、10 μmol/L的STAT5抑制剂和/或1 μg/ml LPS对RAW264.7细胞进行处理,发现STAT5抑制剂和/或LPS均不影响细胞活性,表明STAT5抑制剂和/或LPS对RAW264.7细胞没有明显的细胞毒性反应。为判断STAT5信号转导通路对iNOS的表达能否产生调节效果,我们检测了STAT5通路抑制剂对RAW264.7细胞内iNOS表达和NO释放量的作用。本研究结果显示,STAT5通路抑制剂在2.5~10 μmol/L的线性范围中能够通过调节药物的剂量来阻碍LPS诱导的iNOS蛋白质及其mRNA的表达,以及RAW264.7细胞内NO的产生与释放。同时也探究了STAT5通路抑制剂对p-STAT5蛋白表达的作用。研究表明,p-STAT5蛋白在受到LPS刺激3 h之后到达峰值[15],本实验结果提示,STAT5通路抑制剂降低了由LPS诱导的p-STAT5蛋白质的表达量,但MTT实验数据表明,上述STAT5通路抑制剂的抑制性效果是由于其自身药效的活性作用,并非通过细胞毒作用实现的。所以我们推测STAT5通路抑制剂降低NO的产出量可能成为其对STAT5通路抑制效果的最好解释。
综上,STAT5通路抑制剂能够阻碍经LPS诱导的iNOS mRNA以及蛋白质的表达,从而降低NO的产出量。对于经NO介导的炎性病变的临床治疗,减少p-STAT5蛋白质的表达量可能是一个新的治疗策略。

