小剂量红霉素对香烟烟雾诱导肺气肿中缺氧诱导因子-1α的抑制作用及其机制
顾冬雪,谷 秀,张雪云
0 引言
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种以慢性气道炎症为本质的慢性气道疾病,表现为不完全可逆的气流受限,严重者伴有呼吸衰竭,乃至死亡。近年来COPD的发病率不断增加,其发病机制十分复杂,确切病因不清楚,因目前还没有特效药物能遏制其病情的进行性发展,亟待寻找有效的可逆转病情的治疗药物。大环内酯类抗生素是临床中较为常用的抗感染药物,但目前诸多研究阐明了该类药物的抗感染之外的抗炎作用,尤其是作用于慢性气道性疾病,如弥漫性泛细支气管炎等[1];目前亦有研究显示了其在COPD中的抗炎作用[2],笔者前期的研究显示,小剂量红霉素可通过MAPK途径抑制烟雾诱导的大鼠肺气肿的形成[3]。但目前对于红霉素作用于肺气肿形成及发展的机制尚未完全明确。低氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)是机体在低氧等条件下产生的转录因子,维持着体内氧稳态,可调控与血管生成、糖代谢、细胞增殖等相关的多种基因表达[4]。近年来,国外对HIF-1α的研究显示,其与炎症反应有密切的联系[5],诸多研究显示,HIF-1α可能参与了炎症性疾病的发生发展。本文通过香烟烟雾诱导大鼠慢性气道炎症模型,给予红霉素干预后,观察HIF-1α的改变及其机制。
1 研究方法
1.1 动物模型的制备 所有实验均按照中国医科大学动物研究伦理委员会的指导进行。从中国医科大学实验动物中心获得雄性Wistar大鼠[9~10周龄,(200±18)g],在SPF饲养环境中饲养。实验动物于实验前1周开始饲养。大鼠分笼(每笼10只)饲养,室温维持在23~26 ℃左右,饲养期间大鼠自由摄食及饮水,室内光线12 h规则变化。大鼠随机分为3组,每组8只:正常对照组(C组),香烟烟雾模型组(CS组),红霉素+香烟烟雾模型(ERY+CS组)。CS组大鼠暴露于16支香烟(万宝路;美国纽约州;每支香烟中含有0.9 mg尼古丁,14 mg一氧化碳和12 mg焦油)烟雾中;烟雾镜v/V%为8%),每天2次,每周6 d,共12周,每次30 min,然后将滤网移除。ERY+CS组大鼠暴露于CS 12周,每天口服1次ERY(Sigma-Aldrich;Merck,德国)灌胃,剂量为100 mg/kg。从12周暴露期的第1天开始,在香烟烟雾暴露前0.5 h进行药物治疗。对照组每天盐水作为对照灌胃。每天观察各组大鼠被毛、活动性、饮食、咳嗽等一般情况。在第12周结束时,在麻醉下[40 mg/kg戊巴比妥(Sigma-Aldrich;Merck,德国)]腹腔注射后放血处死大鼠,分离肺组织。取右叶保存于-80 ℃。大鼠肺的左叶(未灌洗)在含5 mM CaCl2+1 mM MgCl2的冰冷盐水中短暂洗涤,中性甲醛固定。通过结扎右主支气管,对大鼠进行左侧单侧肺灌洗,每次2 ml生理盐水,灌洗肺泡3次后回抽放入EP管中,再抽取生理盐水2 ml重复上述动作2次,每次灌洗后立即回吸,反复共3次,最终的回收量约为4.5 ml肺泡灌洗液(BALF)(回收率约75%),将所有回吸液置于10 ml EP管中,立即进行离心,1 000 r/min,离心10 min,留取上清液,弃去细胞沉渣。分装保存于-80 ℃备用。
1.2 病理学评估 肺组织经固定、脱水、透明、浸蜡、包埋、切片,切片厚度为4 μm。切片后经脱蜡,梯度酒精复水,HE染色,在光学显微镜下进行观察。计算标本平均肺泡数(MAN)及肺平均内衬间隔(MLI):每组选取3只典型大鼠进行病理切片及HE染色,每张切片随机镜检3个视野,在视野中心划十字交叉线,计算划线总长(L)、测量的视野面积(S)、计数与交叉线相交的肺泡隔数(NS),以及计数各视野的肺泡总数(Na),平均肺泡数MAN=Na/S;平均内衬间隔MLI=L/NS,表示肺泡平均内径;二者用于测量大鼠肺气肿的病理学严重程度。
1.3 酶联免疫吸附(ELISA)法测定BALF中TNF-α及IL-8含量 按照ELISA试剂盒的说明进行操作,测定BALF中TNF-α及IL-8的含量。
1.4 免疫组化及Western检测肺组织HIF-1α的表达 免疫组化染色按S-P试剂盒说明进行。右肺上叶用RIPA缓冲液(CST,马萨诸塞州,美国)以100 mg组织∶1 ml裂解缓冲液的比例溶解。随后4 ℃离心,条件为1 500×g,20 min。定蛋白后等量上样,SDS-PAGE分离,随后通过电印迹将蛋白质转移到PVDF膜上。将膜在室温下用封闭缓冲液[含0.1%Tween-20的3%脱脂牛奶在TBS(pH 7.4)]中封闭1 h,随后在4 ℃下与抗HIF-Aα或β-actin的抗体孵育过夜,洗膜后二抗孵育2 h,使用Enhanced Chemiluminescence Plus试剂盒,并使用Las-3000发光图像分析仪(Fujifilm,日本东京)进行分析。使用Image J软件对条带强度进行定量。相对于对照组中的水平计算蛋白质表达的倍数变化。
1.5 大鼠肺功能测定 依据文献描述[6]测定0.3 s用力呼气量(FEV0.3)以及0.3 s用力呼气量占用力肺活量比值(FEV0.3/FVC)。给予大鼠10%水合氯醛麻醉后,暴露气管,置入Y型导管,描记大鼠平静呼吸,在1次呼气末注射6 ml空气后,快速脱开,记录FEV0.3及FEV0.3/FVC。
2 结果
2.1 病理形态学改变 在大体标本中,与C组相比较,CS组大鼠肺体积明显增大,表面苍白,局部可见肺大疱。使用红霉素干预后,肺部肺气肿改变明显好转(图1A~图1C)。
对比显微镜下病理学改变可见,与C组相对比,CS组大鼠气道黏膜纤毛上皮倒伏,有不同程度的脱落,气道被膜下腺体增生、肥大,杯状细胞增多以及黏膜上皮形态改变,由柱状逐渐扁平化,出现局部鳞状上皮化生。肺内气道壁及小血管周围肺泡区周围有炎症细胞浸润,肺泡管、肺泡囊及肺泡明显扩大,肺泡壁可见断裂。ERY+CS组可见肺气肿形态的改善(图1D~图1I)。各组间MLI及MAN改变如图1G~图1H所示。与C组相比,CS组MLI及MAN均明显扩大(P<0.05);与CS组相比,ERY+CS组MLI及MAN均明显好转(P<0.05)。
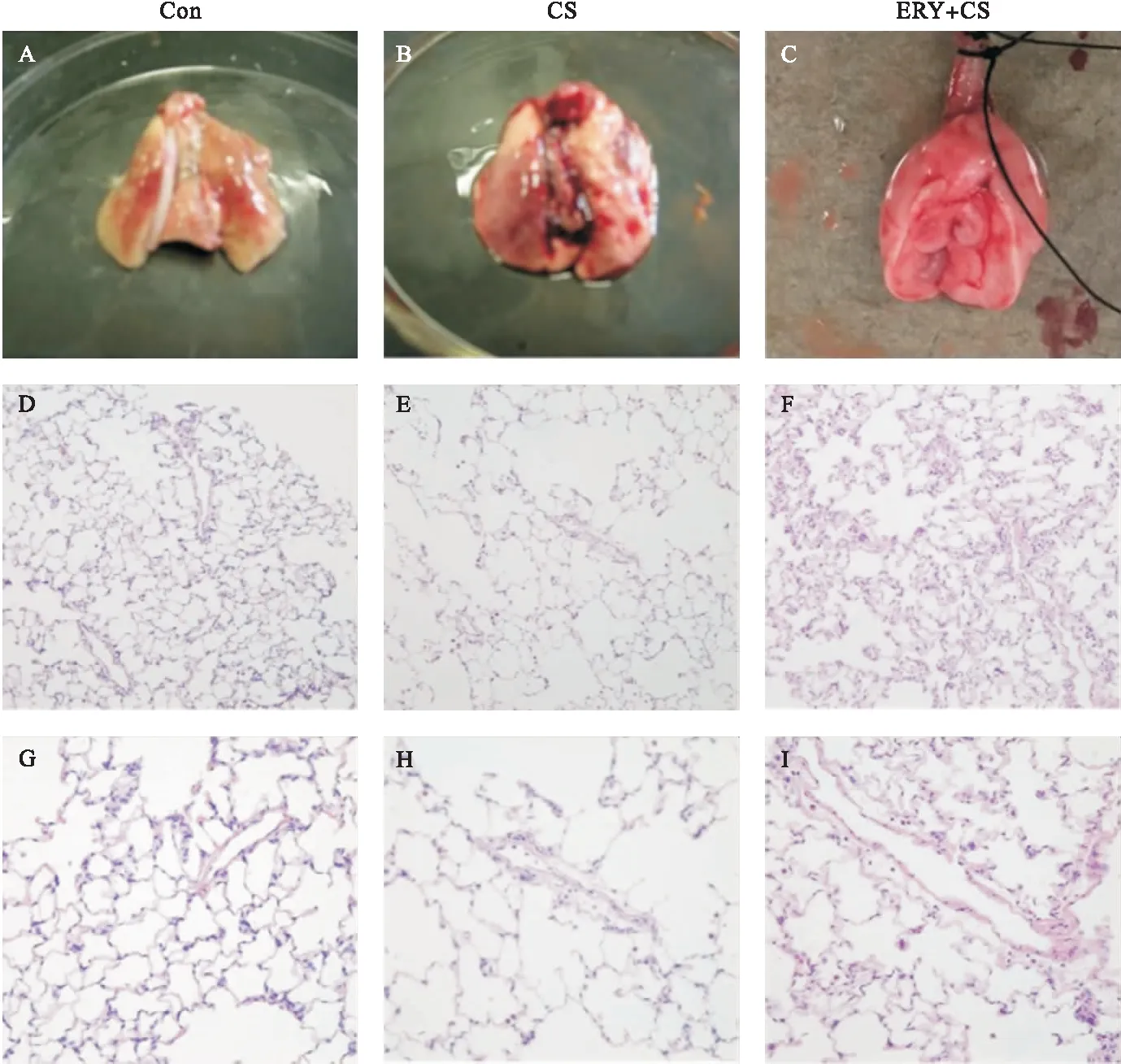
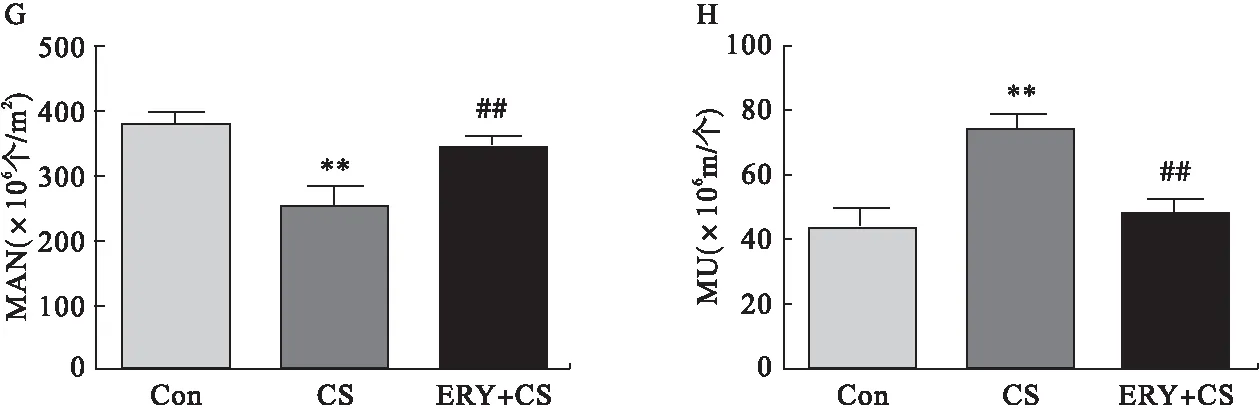
图1 红霉素对香烟烟雾诱导大鼠肺气肿改变的影响
2.2 BALF中TNF-α、IL-8蛋白的表达及大鼠肺功能结果 与C组比较,CS组大鼠BALF中炎症介质TNF-α及IL-8表达均明显增高(P<0.01);经红霉素干预后,炎症介质TNF-α及IL-8表达有所降低(P<0.01),见图2A~图2B。香烟烟雾暴露后,大鼠肺功能呈现明显的阻塞性通气功能障碍,FEV0.3及FEV0.3/FVC均降低(P<0.01);经红霉素干预治疗后,大鼠肺功能明显改善(P<0.01),见图2C~图2D。
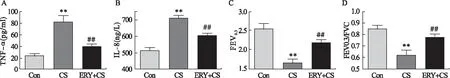
图2 红霉素对香烟烟雾诱导大鼠肺功能及BALF中炎症介质表达的影响
2.3 HIF-1α表达结果 免疫组化及Western blot结果表明,香烟烟雾诱导后;大鼠肺气肿组织中HIF-α蛋白表达均明显增高(P<0.01);红霉素干预后,香烟烟雾诱导的HIF-α的增高较前降低(P<0.05)。见图3。

图3 红霉素对香烟烟雾诱导大鼠HIF-1α表达的影响
3 讨论
HIF-1是细胞在缺氧条件下产生的一种转录因子,HIF-1由条件性表达的HIF-1α和结构性表达的HIF-1β两个亚基组成,HIF-1α是其活性亚基,对氧分压较敏感,正常氧分压环境中HIF-1α极不稳定,容易降解,难以检测[7]。低氧环境下,脯氨酸羟化酶活性被抑制,HIF-1α降解被抑制,从而转移至胞核内,与HIF-1β形成HIF-1分子,发挥转录因子作用来调节靶基因表达[7]。
近年来国外对HIF-1α的研究显示,其与炎症反应有密切的联系,机体乏氧后注射LPS,大鼠肺泡内间隔中性粒细胞数增高,炎症反应更为明显,LPS给药6 h后,肝脏HIF-1α表达增加,3 h后血清IL-1β和CRP水平升高[8]。本实验结果显示,烟熏诱导肺气肿模型大鼠肺组织中HIF-1α蛋白表达呈阳性,其表达水平与TNF-α呈正相关,与大鼠肺功能呈负相关,提示在烟雾暴露下也可使HIF-1α表达,HIF-1α可能参与了COPD慢性炎症的发生、发展。与本研究结果相似,一项研究对比了COPD及非COPD患者的肺组织,COPD患者的肺组织中HIF-1α表达增加,且与VEGF及其受体的表达呈正相关[9]。另外,HIF-1α的表达增加反映了COPD的严重程度[9]。通过检测患者BALF中HIF-1α、EGFR及炎症因子的表达以及细胞的体外实验发现,HIF-1α在COPD中过表达,通过激活EGFR/PI3K/AKT途径上调了炎症因子的表达[10]。COPD的肺部炎症诱导激活的EGFR/PI3K/AKT通路进一步上调了反馈环中的HIF-1α表达,从而加剧了COPD的病理变化[10]。
迄今为止,多项基于大环内酯类药物应用于COPD患者的研究均显示,大环内酯类药物治疗可显著减轻病情,可能有助于减轻这一群体的疾病负担[11-13]。此外,与其他药物共同使用时,红霉素可以通过抑制PI3K/AKT途径和增强HDAC2的活性来增强COPD模型大鼠中布地奈德的抗炎活性[14]。鉴于此,本研究对比分析了烟雾暴露后的大鼠肺气肿经红霉素干预后的效果及潜在机制。结果表明,应用红霉素口服治疗后,大鼠肺功能、肺部炎症介质以及气肿病理改变均得到改善,由香烟烟雾所诱导的HIF-1α增高也得到抑制,从而对肺部的炎症及损伤起到保护性作用,且可能通过HIF-1α调控了相应的靶基因表达,从而发挥保护性作用。
综上,小剂量红霉素可通过调控抑制肺部HIF-1α的表达,从而发挥对香烟烟雾诱导的肺气肿的保护性作用,进而改善患者的肺部炎症反应,改善肺功能,发挥抗炎作用。

