经前期综合征与奖赏进程失调——来自脑电的证据*
侯璐璐 陈莅蓉 周仁来
经前期综合征与奖赏进程失调——来自脑电的证据
侯璐璐 陈莅蓉 周仁来
(南京大学心理学系, 南京 210023)
研究表明, 经前期综合征(Premenstrual syndromes, PMS)女性的情绪平衡性存在问题, 而现有研究多从负性情绪上升的角度考察PMS的发病机制, 而对其正性情绪缺损的关注不足。鉴于正性情绪与奖赏进程密切相关, 本研究试图从奖赏进程失调的角度考察PMS女性与健康女性的差异以及该差异是否存在阶段特异性的问题, 以期从正性情绪缺损的角度揭示其发病机制。具体而言, 分别选取PMS女性与健康女性23名和22名, 考察两组被试在黄体晚期(即经前期)和卵泡早期(即经后期)正性情绪以及完成赌博任务时的脑电数据时域和频域的差异。主观问卷结果显示, PMS女性的愉快和平静情绪低于健康女性, 并且情绪平衡性也低于健康女性, 但无明显的阶段特异性。时域分析结果显示, PMS组在经前期收到奖赏反馈后奖赏正波(reward positivity, RewP)的波幅和差异波(即奖赏条件和惩罚条件下的差值)的波幅均低于健康女性, 进一步的相关分析结果显示, 对于PMS组来说, 经前期奖赏条件下的RewP波幅和差异波波幅与经前期的情绪平衡性显著正相关。频域分析的结果则发现PMS组在经前期奖赏条件下的θ频段(4~7 Hz, 250~400 ms)能量低于健康组。研究表明, PMS女性在经前期的奖赏加工进程存在异常, 表现为对奖赏反馈的预期增强, 而在收到奖赏反馈后又出现了钝化反应, 且奖赏进程的失调与情绪平衡性相关。本研究为理解PMS女性奖赏进程失调的动态加工时程和神经震荡特征及其与情绪平衡性的关系提供了初步的神经生理证据。
经前期综合征; 月经周期; 黄体晚期; 正性情绪; 奖赏进程; 奖赏正波; θ频段; 时频分析
1 引言
女性从青春期开始, 伴随着子宫内膜增厚和脱落的周期性变化, 阴道出现周期性流血称为月经, 月经的周期变化就是月经周期。女性月经周期以月经来潮第1天为周期的开始, 到下次月经来为止, 以排卵日为界, 可将其划分为卵泡期(排卵前)和黄体期(排卵后)。经前期综合征(premenstrual syndrome, PMS)是指女性在黄体晚期周期性地出现一系列身体、情绪和行为方面的不适症状, 这些症状在月经开始前一个星期内达到顶峰, 在月经来潮之后好转或消失(Dueñas et al., 2011)。Direkvand- Moghadam, Sayehmiri, Delpisheh和Sattar (2014)的元分析结果表明, 在育龄女性中, 全世界范围内PMS的发病率平均为47.8%, 中国的发病率为21%, 且有逐年增长的趋势。对PMS女性的研究发现, PMS女性在经前期同时具有正性情绪下降(Chen & Zhou, 2016; Metcalf & Livesey, 1995; Rubinow et al., 1986)和负性情绪上升的特征(Eggert, Witthöft, Hiller, & Kleinstäuber, 2016; Gingnell, Morell, Bannbers, Wikström, & Poromaa, 2012); 既有对负性刺激的杏仁核反应增强, 也有对正性刺激的腹侧纹状体反应减弱(Protopopescu et al., 2008), 也就是说可能情绪的平衡性存在失调。情绪平衡性(affect balance)是指正负性情绪之间的平衡(Schimmack, 2008), 一般被计算为“正性情绪/(正性情绪+负性情绪)” (Garamoni et al., 1991)或者“正性情绪−负性情绪” (Koydemir, Şimşek, Schütz, & Tipandjan, 2013; Liu, Wang, & Lü, 2013), 对抑郁症的研究已经发现, 抑郁症患者的情绪平衡性低于健康人群, 且与自我报告的症状严重性负相关(Garamoni et al., 1991), 并在治疗后可以恢复到与健康人群相当的水平(Garamoni, Reynolds, Thase, Frank, & Fasiczka, 1992; Schwartz et al., 2002; Zhou et al., 2012)。综上, 情绪障碍的产生与正负性情绪的失衡有关, 在PMS女性中这个失衡则进一步体现为正性情绪的下降和负性情绪的上升。然而, 目前关于PMS机制的研究大多是从负性情绪上升的角度出发, 发现相较于健康女性, PMS女性对实验中引起的负性情绪进行更多的自我关注(Craner, Sigmon, & Martinson, 2015), 并倾向于采用非适应性的情绪调节方式(自责、沉思和灾难化)对产生的负性情绪进行调节(Eggert et al., 2016; Wu, Liang, Wang, Zhao, & Zhou, 2016), 而对其正性情绪下降的机制研究较为缺乏。
此外, 根据Fredrickson (1998)的拓宽和建构模型(broaden and build model), 正性情绪可以拓宽注意范围, 为个体的发展建构生理、智力和社会资源, 并且通过分解或撤销心理和生理上对(由不再相关的负性情绪引起的)特定行为的准备, 放松(不再相关的)负性情绪对个人身心的影响。实证研究的结果也发现, 正性情绪的诱发可以加快被试在看到负性视频后生理反应的恢复(Fredrickson, Mancuso, Branigan, & Tugade, 2000; Fredrickson & Levenson, 1998)。也就是说, 正性情绪可能不仅独立作用于PMS经前期症状的产生, 还会通过影响负性情绪的恢复进一步影响黄体晚期PMS的症状严重性。因此, 对PMS女性正性情绪缺失的研究是必不可少的。
正性情绪和奖赏密切相关, 当获得奖赏时通常会产生正性情绪(Berridge & Robinson, 2003); 而正性情绪的产生也常常与脑内奖赏通路的激活有关, 当听到令人愉悦的音乐(Blood & Zatorre, 2001; Salimpoor, Benovoy, Larcher, Dagher, & Zatorre, 2011)或观看恋人的图片(Aron et al., 2005)时会激活脑内奖赏回路。此外, 经典的情绪性脑区——杏仁核对其他脑区有广泛的投射, 如腹侧纹状体 (Alheid, 2003)、腹侧被盖区(Amaral & Price, 1984)等, 这些区域又在奖赏加工中起着重要的作用(Murray, 2007)。因此, PMS女性在经前期正性情绪下降可能是其对奖赏类刺激的反应不足引起的。
事件相关电位(event-related potential, ERP)技术具有精确到毫秒的时间分辨率, 在奖赏进程的研究中具有很大的优势。近年来, 研究者们采用ERP技术对奖赏进程的电生理指标进行了一系列的研究, 并且发现收到奖赏反馈后300 ms左右位于中央前部的奖赏正波(reward positivity, RewP)可以作为奖赏进程的稳定的电生理指标。已有对抑郁症等情绪障碍群体的研究中, 已经发现RewP的异常与抑郁有关(Bress, Foti, Kotov, Klein, & Hajcak, 2013; Liu et al., 2014; Nelson, Perlman, Klein, Kotov, & Hajcak, 2016; Proudfit, 2015), 例如Liu等(2014) 比较了27个重度抑郁症(major depressive disorder, MDD)患者和健康组个体在赌博任务中的RewP, 结果显示在面对奖赏的反馈时, MDD患者的RewP的波幅比健康组低, 而面对惩罚的反馈时则差异不显著, 并且在面对奖赏反馈时RewP的波幅与快感缺失以及抑郁症状相关显著。另外一些研究显示, 收到奖赏反馈后较低的RewP波幅可以预测几年后抑郁症的发生(Bress et al., 2013; Nelson et al., 2016)和更多的抑郁症状(Morgan, Olino, Mcmakin, Ryan, & Forbes, 2013; Nelson et al., 2016)。
此外, 对一个事件的震荡反应可以划分为两种类型的活动, 一种是锁时锁相的诱发震荡, 另一种为锁时非锁相的引发震荡。而ERP只能反映锁时锁相的信息, 对另外一些锁时非锁相的信息则很难反应出来。以往研究表明, RewP与内侧额叶的θ频段(4~7 Hz)的震荡有关, θ频段的能量在惩罚条件下高于奖赏条件下(Cohen, Elger, & Ranganath, 2007; Marco-Pallares et al., 2008)。比起RewP, θ震荡活动的头皮分布稍微向右侧偏, 更靠前端分布(Nieuwenhuis, Slagter, von Geusau, Heslenfeld, & Holroyd, 2005)。之前Padrão, Mallorquí, Cucurell, Marco-Pallares和Rodriguez-Fornells (2013)对于快感缺失人群的研究发现, 在获得最大的奖赏反馈后(范式涉及不同高低等级的奖赏和惩罚反馈), 其内侧前额叶θ频段能量急剧增加, 作者认为这反映了快感缺失人群已经建立的固有的消极预期与收到大量奖赏反馈时冲突和认知控制的增加。而Andreou等(2015)对边缘人格障碍的人群进行研究则发现, 其对惩罚反馈的θ频段能量降低, 作者认为这反映了其对反馈效价(即奖赏或惩罚)的处理存在缺损障碍。总之, 虽然对于θ震荡的具体功能尚未达成一致, 但是目前结果基本可以认为其与个体在赌博任务中收到的金钱反馈, 尤其是无预期状态下的负性反馈有关。
综上所述, 现有研究虽然初步揭示了PMS女性存在正性情绪下降的特征, 但其正性情绪下降的原因则鲜有探讨。本研究从奖赏进程的角度出发, 试图回答“PMS女性为什么在黄体晚期正性情绪体验下降”这一问题。为了更深入地考察PMS女性和健康女性在奖赏加工中的时间动态过程和神经震荡上的差异, 记录了PMS女性和健康女性在经前期和经后期完成简单赌博任务时的脑电数据, 并对其进行时域和频域的分析。基于以往研究, 在时域指标上, 我们假设PMS女性经前期奖赏条件下的RewP波幅低于健康组。而在频域指标上, 由于现在尚存争议, 我们假设, 如果θ频段震荡与预期和反馈的冲突有关, 则PMS女性经前期奖赏条件下的θ频段震荡高于健康女性, 过高的奖赏预期可能导致了其收到奖赏反馈时RewP波幅的下降以及正性情绪的降低; 如果θ频段震荡仅仅反映了对反馈效价进行处理的功能, 则PMS女性经前期奖赏条件下的θ频段震荡低于健康女性, 对奖赏类刺激的反应不足导致其正性情绪下降。
2 方法
2.1 被试
本研究采用根据John Bancroft诊断标准(Bancroft, 1993)编制的经前期综合征问卷对大学生进行筛查, 最终, 在完成筛查的259名女大学生(包含本科生与研究生)中, 有44名女大学生吻合PMS的诊断标准。然后根据筛查情况, 对两组女性的身体质量指数(body mass index, BMI)和年龄进行了匹配, 最终自愿参加实验的30名PMS女性和30名健康女性被纳入实验。然后删除中途退出(PMS组2人, 健康组3人)和其中有任何一种条件少于10个有效试次的被试(PMS组5人, 健康组5人), 最终纳入分析的两组被试分别为23人和22人。两组被试在经前期综合征问卷上得分存在显著差异,(43) = 13.07,< 0.001, PMS组(14.39 ± 3.70)的得分高于健康组(3.05 ± 1.73)。
所有被试的入组标准如下:月经周期规律, 周期长度为25~35天(自我报告在过去的6个月内月经周期的波动不超过3天); 最近没有使用处方药(包括口服避孕药、抗抑郁药和其他精神药物); 医院体检筛查没有器质性疾病, 最近没有慢性或急性疼痛症状, 没有内分泌疾病(包括糖尿病或甲状腺疾病), 以及没有其他慢性病; 自我报告没有进行抑郁治疗, 且经贝克焦虑量表(BAI)和贝克抑郁量表(BDI)筛查, 无明显抑郁和焦虑(即BDI分数不高于21分, BAI标准分不高于45分)。该研究得到南京大学伦理委员会批准。所有被试在实验前均签署了知情同意书, 并在实验结束获得相应的报酬。
2.2 实验材料
2.2.1 经前期综合征问卷(PSS)
采用Bancroft (1993)编制的, 赵更力、王临虹和渠川琰(1998)修订的经前期综合征问卷(Premenstrual Syndrome Scale, PSS), 涵盖躯体和心理两类症状, 以全面考察女性末次月经前14天内出现的经前不适症状。该问卷包含12个条目, 采用Likert 4点计分, 从“无症状” (得0分)到“症状严重影响生活、学习和工作, 需要治疗” (得3分), 得分越高表明该症状越严重, 问卷总分为6~10分反映为轻度PMS, 11~20分反映为中度PMS, > 20分反映为重度PMS。经过修订, 该问卷信度良好, α系数为0.80 (Wu et al., 2016)。经检验, 在本研究中, 该问卷的α系数为0.91。
2.2.2 贝克抑郁量表(BDI)
采用Beck (1967)编制的, 张雨新、王燕和钱铭怡(1990)修订的贝克抑郁量表(Beck Depression Inventory, BDI)对参与者的抑郁情绪进行评估。该量表包含21个条目, 采用Likert 4点计分方式, 从“无” (得0分)到“极重” (得3分), 得分越高表明其抑郁程度越高。问卷总分≤4分反映为无抑郁或极轻微; 5~13分反映为轻度抑郁; 14~20分反映为中度抑郁; ≥21分反映为重度抑郁。该量表在大学生群体中有良好的信度, α系数为0.85, 一周后的重测信度分别为0.73。经检验, 在本研究中, 该问卷的α系数为0.90。
2.2.3 贝克焦虑量表(BAI)
采用Beck, Epstein, Brown和Steer (1988)编制的, 郑健荣等人(2002)修订的贝克焦虑量表(Beck Anxiety Inventory, BAI)对参与者的焦虑情绪进行评估。该量表包含21个项目, 采用Likert 4点计分方式, 从“无” (得1分)到“极重”得4分), 得分越高表明其焦虑程度越高。不同于BDI的计分方式, 焦虑自评问卷得分采用标准分, 即各个题目加总得到粗分, 然后通过Y = int (1.19X)得到标准分。问卷标准分≥ 45分是判断界限, 表明个体存在明显焦虑心态且焦虑水平较高。经过中文版的修订, 该量表有良好的信度, α系数为0.95 (郑健荣等, 2002)。经检验,在本研究中, 该问卷的α系数为0.94。
2.2.4 正负性情绪量表(PANAS)
采用Watson, Clark和Tellegen (1988)编制的, 由黄丽、杨廷忠和季忠民(2003)修订的正负性情绪量表(The Positive and Negative Affect Schedule, PANAS), 测量参与者在过去一周体验到的情绪强度。PANAS包含正性情绪(PA)和负性情绪(NA)两个分量表, 共20个项目, 采取Likert 5点记分, 从“表示非常轻微或根本没有” (得1分)到“非常强烈” (得5分), 得分越高表明该种情绪体验越强烈。该量表具有良好的信效度, 总问卷、正性情绪分量表和负性情绪分量表的α系数在0.82~0.85之间, 重测信度为0.47。经检验, 在本研究中, 经前测试正性情绪分量表和负性情绪分量表的α系数分别为0.92和0.89; 经后测试正性情绪分量表和负性情绪分量表的α系数分别为0.87和0.94。
2.2.5 基本情绪问卷
采用吴梦莹等(2014)自编的问卷考察被试的基本情绪体验。共9个条目, 其中2个总体维度测量总体愉悦度和唤醒度, 另外7个条目考察基本情绪(愉悦、愤怒、恐惧、悲伤、平静、厌恶、惊奇), 采用Likert 9点计分, 从“非常不” (记1分)到“非常” (记9分), 得分越高表明该种体验越强烈。
2.2.6 斯奈思−汉密尔顿快感量表(SHAPS)
采用Snaith等人(1995)编制的, Liu, Wang, Zhu, Li和Chan (2012)修订的斯奈思−汉密尔顿快感量表(Snaith-Hamilton Pleasure Scale, SHAPS), 考察被试最近一段时间内在兴趣/娱乐、社会交往、感觉体验和食品/饮料这4个方面的快乐体验, 包含14个条目, 采取Likert 4点计分, 从“非常同意” (记1分)到“非常不同意” (记4分), 得分越高表明快感缺失越严重。该量表具有良好的信效度, 分半信度为0.74。经检验, 经前和经后测试, 该问卷的α系数分别为0.86和0.82。
2.3 奖赏实验范式
采用如图1所示的赌博范式。在实验过程中, 被试要对两扇相同的门猜测哪扇门后边会有奖励, 猜对的情况下会有金钱奖赏。具体而言, 被试首先进行选择, 选择结束后出现一个1000 ms的注视点, 紧接着出现反馈界面, 如果被试猜对了, 则出现一个向上的绿色箭头, 表示赢得1元; 如果被试猜错了, 则出现一个向下的红色箭头, 表示输掉0.5元, 反馈界面的呈现时间为2000 ms。反馈之后, 出现一个1500 ms的注视点, 紧接着被试自己按键开始下一回合。奖赏和惩罚条件各20个试次, 以随机的方式呈现, 实验共包含40个试次。
2.4 脑电数据的采集和处理
脑电采用Curry 7-40导记录系统, DC模式进行数据采集。脑电记录时各电极参考于接地点(在FPz和Fz连线的中点上), 垂直眼电(VEOG)电极分别置于左眼眶上和眶下正中, 水平眼电(HEOG)置于左右外眦。数据的采样率为1000 Hz, 记录的带宽为低通100 Hz, 实验中所有电极的电阻保持在10 kΩ以下。
采集完成后, 利用EEGLAB (Delorme & Makeig, 2004; https://sccn.ucsd.edu/eeglab/index.php)对数据进行预处理, 具体而言, 首先, 将数据进行重参考, 将双侧乳突作为参考电极; 其次, 对数据进行30 Hz的低通滤波和1 Hz的高通滤波; 然后, 运用插值法对坏掉的电极点数据进行替换, 并将坏段进行剔除; 最后运用ICA将眼电成分剔除。然后对两种条件的数据进行叠加平均, 分别存储奖赏条件和惩罚条件的结果。需要注意的是, 一些研究者采用本研究所采用的范式做时域分析(如Bress et al., 2013; Bress, Smith, Foti, Klein, & Hajcak, 2012), 选取了−200~0 ms做基线校正, 但是又有研究表明在作出按键反应和反馈出现前200 ms会出现一个刺激前负波(如, Brunia & Damen, 1988), 结合反馈出现前(−1000~0 ms)的波形图, 本研究最终选择−500~ −200 ms的数据进行基线校正。每个条件下保留的有效试次如表1所示。
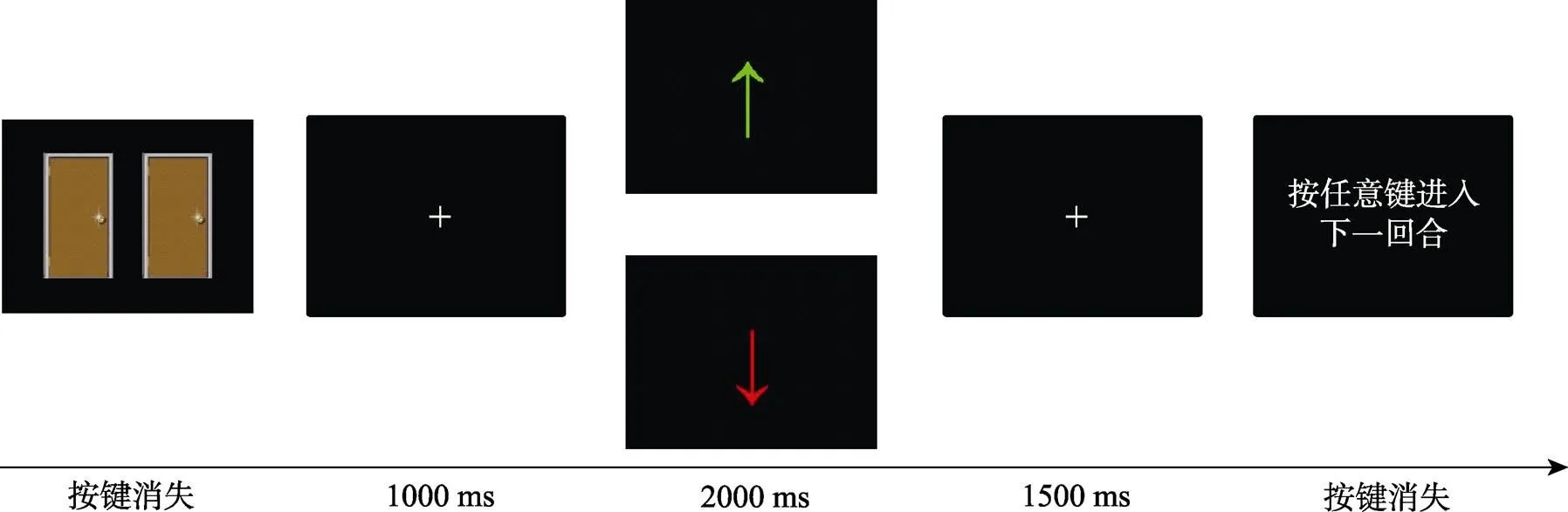
图1 单一试次流程图
参考以往的研究, 将RewP波幅最大的FCz电极点作为分析目标(Holroyd & Krigolson, 2007; Liu et al., 2014)。首先, 选取反馈呈现后250~350 ms的时间窗口对奖赏和惩罚条件下的平均波幅进行统计分析, 然后对250~350 ms时间窗口的差异波(奖赏条件−惩罚条件)进行统计分析(Bress et al., 2013; Bress et al., 2012; Foti & Hajcak, 2009; Holroyd & Krigolson, 2007; Holroyd, Pakzadvaezi, & Krigolson, 2008; Liu et al., 2014)。
时频分析采用短时傅里叶变换的方法, 使用窗宽为200 ms的汉宁窗。对每个试次, 在每个时间点(−1000~800 ms, 以1 ms为步长)、每个频段(1~30 Hz, 以1 Hz为步长)进行一次短时傅里叶变换。由此产生的频谱图, 代表了信号功率在每个时−频点的时间和频率的联合函数, 即P (t, f) = ||f(t, f)||, 包括大脑对相位锁定(事件相关电位)和非相位锁定(事件相关同步和失同步)的反应(Hu, Xiao, Zhang, Mouraux, & Iannetti, 2014; Mouraux & Iannetti, 2008)。根据Cohen (2014)的观点, 一般用于时频分析的基线, 不建议短于300 ms, 且要注意避免试次边缘可能出现的边际效应和刺激出现附近可能出现的窗函数泄漏问题。因此, 参考以往一些进行了时频分析的研究(如, Cona et al., 2020), 最终本研究选取−500~−200 ms的数据作为基线进行校正。参考以往研究(Cohen et al., 2007; Marco-Pallares et al., 2008), 结合本研究产生的频谱图, 选取250~ 400 ms的θ频段(4~7 Hz)平均能量进行统计分析。
2.5 测试日期
根据被试在前期筛选过程中报告的上两次月经来潮时间和月经周期长度来推知被试本次月经来潮时间。每名被试需要参加两次实验, 分别在本次月经来潮前1~4天(经前期)和本次月经结束后1~4 天(经后期)。被试首次参加实验时所处的阶段在被试间平衡。若被试在参加经前实验前月经来潮, 则重新预约时间, 但保证被试在两个连续的月经周期中完成两次实验。被试到达实验室后, 首先签署知情同意书, 然后完成主观问卷的填写和ERP数据的采集, 并且在被试离开实验室前完成唾液的收集。
2.6 激素测试
要求被试在取样的前一天避免吃高脂肪、高蛋白类食物, 避免饮酒。取样前半小时不得进食、饮水。每次采集唾液不少于1 ml, 采集完成后将唾液样本保存在−20℃的冰箱中, 待所有唾液样本收集完毕后, 送入联科生物进行分析。采用竞争性酶联免疫吸附测定法(c-ELISA), 试剂盒由美国Cayman公司提供, 对唾液样本中的雌二醇和孕酮含量进行检验, 单位为pg/ml, 其批内和批间变异均低于12%。
2.7 数据分析
对于量表和行为数据, 首先采用独立样本检验, 对两组被试人口学变量和PSS量表得分进行比较; 其次, 采用2(阶段:经前期、经后期) × 2(组别:PMS、健康)重复测量方差分析对量表数据和激素水平进行分析; 最后, 采用2(实验条件:奖赏、惩罚) × 2(阶段:经前期、经后期) × 2(组别:PMS、健康)重复测量方差分析, 分析实验条件、阶段和组别对被试选择(左/右)和反应时的影响。由于反应时和激素水平不符合正态分布, 因此进行log10转换后进行统计分析, 表中仍然呈现原始数据。
对于脑电数据, 采用2(实验条件:奖赏、惩罚) × 2(阶段:经前期、经后期) × 2(组别:PMS、健康)对RewP波幅和θ频段能量进行重复测量方差分析, 并采用2(阶段:经前期、经后期) × 2(组别:PMS、健康) 对RewP差异波波幅和θ频段能量的差值进行重复测量方差分析。
最后, 分别计算PMS组和健康组在两个阶段的奖赏、惩罚条件RewP波幅和差异波波幅以及两个阶段的奖赏、惩罚条件θ频段能量及其差值与主观问卷的相关。
所有的数据分析均使用SPSS 22.0软件包进行, 重复测量方差分析球形检验检验不通过则采用Greenhouse-Geisser法矫正, 涉及多重比较的问题, 使用Bonferroni进行校正, 显著性水平使用< 0.05, 效应量用η和Cohen’表示。
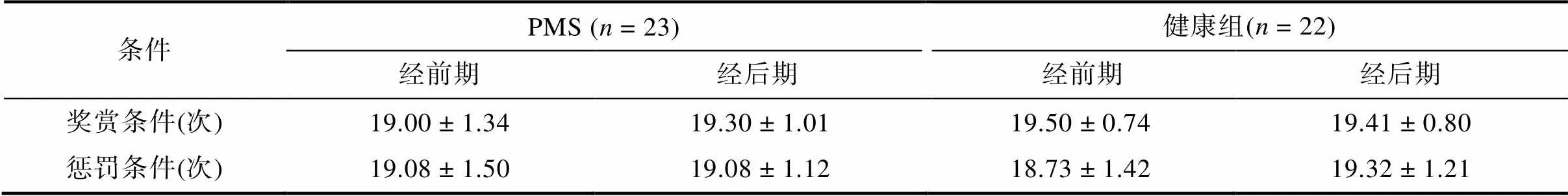
表1 时域分析和频域分析每种条件有效试次数(M ± SD)
3 结果
3.1 人口学变量
对人口学变量进行独立样本检验, 结果显示PMS组和健康组在年龄、BMI、月经持续时间和月经周期长度上差异不显著,s (43) < 0.95,s > 0.35。
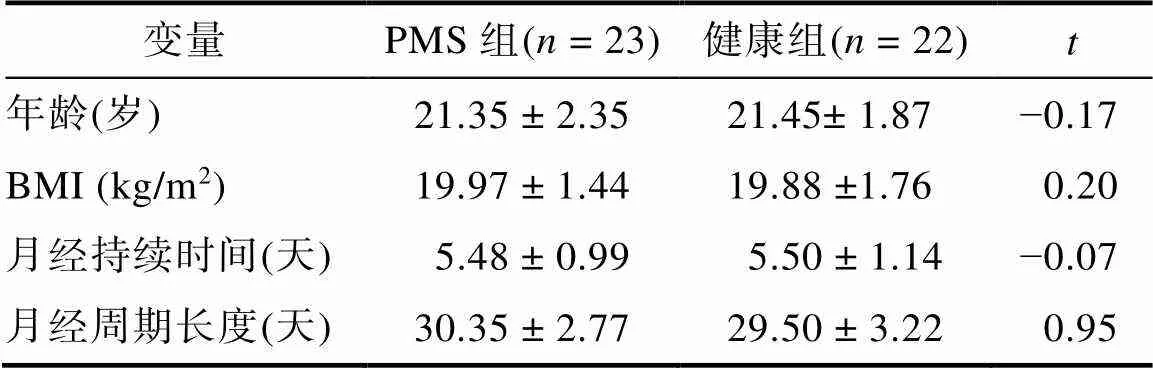
表2 人口学变量(M ± SD)
3.2 主观问卷和激素水平结果
重复测量方差分析结果显示, 对于PANAS -NA来说, 组别的主效应显著,(1, 43) = 14.46,< 0.001, η= 0.25; 其他效应均不显著,s (1, 43) < 0.02,s > 0.89; 对于PANAS-PA来说, 各个效应均不显著,s (1, 43) < 2.33,s > 0.14。对于PANAS-AB来说, 组别的主效应显著,(1, 43) = 4.18,= 0.047, η= 0.09; 其他效应均不显著,s (1, 43) < 0.12,s > 0.74。
对于基本情绪量表−愉悦度来说, 组别的主效应显著,(1, 43) = 10.06,= 0.003, η= 0.19; 其他效应均不显著,s (1, 43) < 0.02,s > 0.89。对于基本情绪量表−唤醒度来说, 各个效应均不显著,s (1, 43) < 0.81,s > 0.37。对于基本情绪量表−愉快来说, 组别的主效应显著,(1, 43) = 4.15,= 0.048, η= 0.09; 其他效应均不显著,s (1, 43) < 0.74,s > 0.40。对于基本情绪量表−愤怒来说, 组别的主效应显著,(1, 43) = 10.35,= 0.002, η= 0.19; 其他效应均不显著,s (1, 43) < 0.49,s > 0.49。对于基本情绪量表−恐惧来说, 组别的主效应显著,(1, 43) = 7.42,= 0.01, η= 0.15; 其他效应均不显著,s (1, 43) < 1.64,s > 0.21。对于基本情绪量表−悲伤来说, 组别的主效应显著,(1, 43) = 8.42,= 0.01, η= 0.16; 其他效应均不显著,s (1, 43) < 1.10,s > 0.30。对于基本情绪量表−平静来说, 组别的主效应边缘显著,(1, 43) = 3.17,= 0.08, η= 0.07; 其他效应均不显著,s (1, 43) < 2.03,s > 0.16。对于基本情绪量表−厌恶来说, 组别的主效应显著,(1, 43) = 6.64,= 0.01, η= 0.13; 其他效应均不显著,s (1, 43) < 0.74,s > 0.40。对于基本情绪量表−惊奇来说, 各个效应均不显著,s (1, 43) < 1.68,s > 0.20。对于SHAPS来说, 组别的主效应边缘显著,(1, 43) = 3.52,= 0.07, η= 0.08; 其他效应均不显著,s (1, 43) < 0.24,s > 0.63。
激素结果显示, 对于孕酮来说, 阶段主效应显著,(1, 43) = 20.16,< 0.001, η= 0.32; 其他效应均不显著,s (1, 43) < 0.20,s > 0.66。对于雌二醇来说, 所有效应均不显著,s (1, 43) < 1.97,s > 0.17。PMS组和健康组在经前期和经后期在各个量表上的得分和激素结果如表3所示。
3.3 行为结果
行为结果如表4所示, 两组被试的选择和反应时均不存在显著效应,s (1, 43) < 2.00,s > 0.16。
3.4 ERP结果
对奖赏和惩罚条件下RewP波幅进行的重复测量方差分析结果显示, 条件的主效应显著,(1, 43) = 68.60,< 0.001, η= 0.62; 阶段的主效应边缘显著,(1, 43) = 3.43,= 0.07, η= 0.07; 条件×阶段×组别的交互效应显著,(1, 43) = 5.30,= 0.03, η= 0.11。进一步的简单简单效应显示, 对于经前期来说, PMS组奖赏条件下的RewP波幅低于健康组,(1, 43) = 3.70,= 0.06, Cohen’= 0.57; 其他条件都不存在组别的差异,s (1, 43) < 1.16,s > 0.29。对于PMS组来说, 奖赏条件下的RewP波幅的阶段差异显著,(1, 43) = 3.96,= 0.05, Cohen’= 0.42; 其他条件都不存在阶段的差异,s (1, 43) < 1.94,> 0.17。对于两组两个阶段来说, 两种条件均存在显著差异,s (1, 43) > 13.16,s < 0.01。
对差异波波幅进行的重复测量方差分析结果显示, 阶段的主效应不显著,(1, 43) = 0.72,= 0.40; 组别的主效应边缘显著,(1, 43) = 3.23,= 0.07, η= 0.07; 阶段×组别的交互效应显著,(1, 43) = 5.30,= 0.03, η= 0.11。进一步的简单效应显示, 在经前期, PMS组差异波的波幅低于健康组,(1, 43) = 8.30,= 0.006, Cohen’= 0.85; 而在经后期差异则不显著,(1, 43) = 0.38,= 0.54。对于PMS组来说, 阶段差异显著,(1, 43) = 5.07,= 0.03, Cohen’= 0.49; 而健康组不存在显著的阶段差异,(1, 43) = 1.03,= 0.32。健康组和PMS组在经前期、经后期在奖赏、惩罚条件下的波形图以及差异波的波形图、地形图如图2所示, 平均波幅如表5所示。
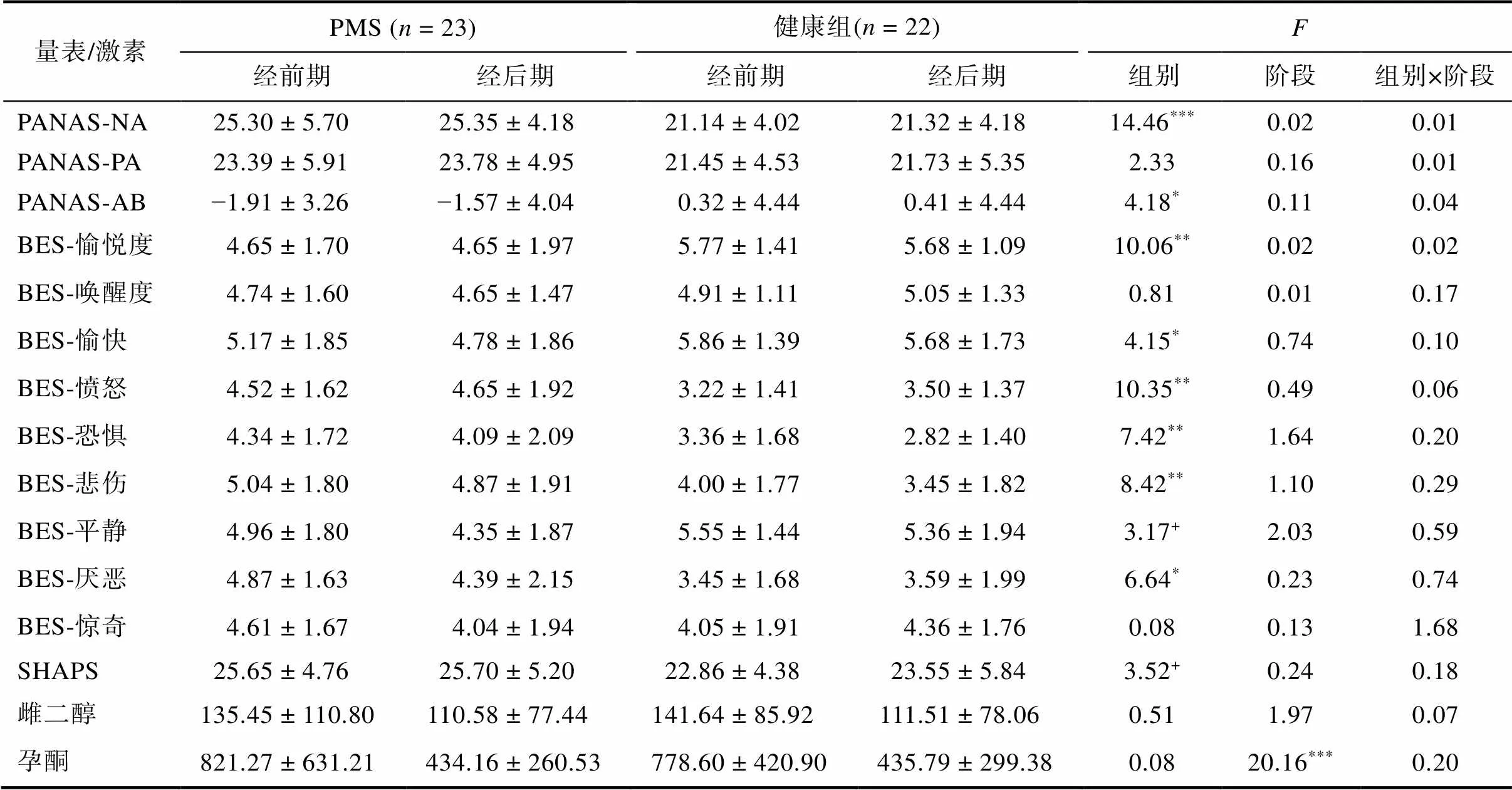
表3 主观问卷和激素结果(M ± SD)
注:PANAS-AB的计算公式为(PANAS-PA) − (PANAS-NA); BES代表基本情绪问卷(basic emotion scale); 雌二醇和孕酮为原始数据, 统计分析采用log10转换的数据, 单位均为pg /ml;< 0.10,< 0.05,< 0.01,< 0.001。
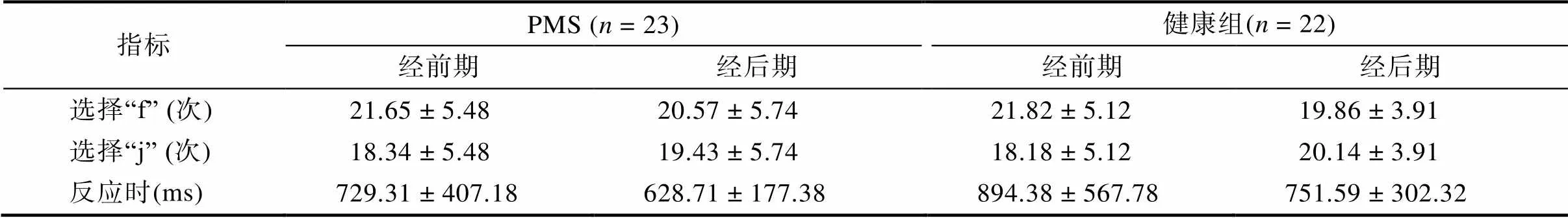
表4 奖赏实验范式行为数据(M ± SD)
注:反应时数据进行log10转换后进行统计分析, 表中仍然呈现原始时间。
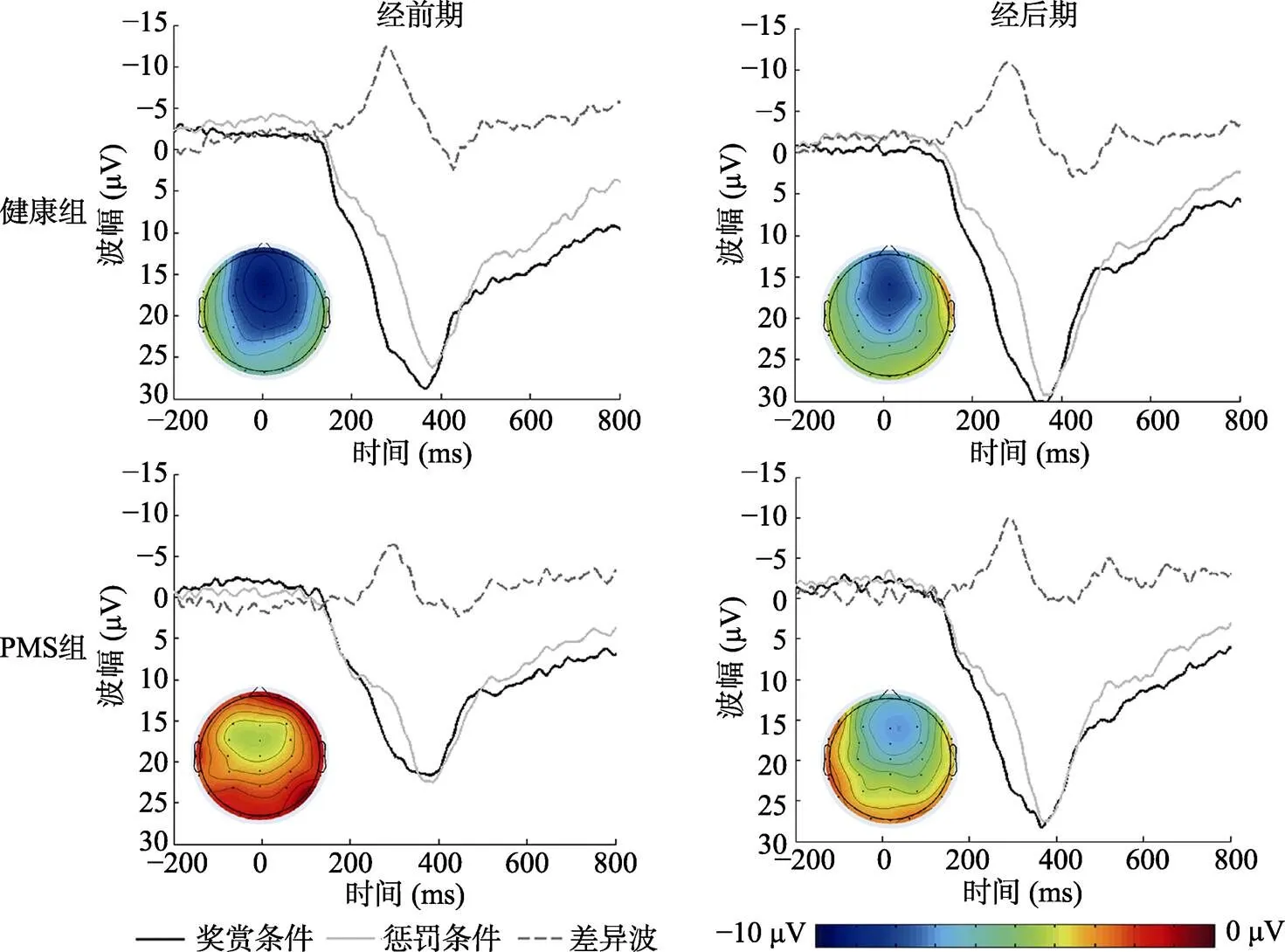
图2 健康组和PMS组在经前期和经后期的波形图与地形图, 其中地形图为差异波250~350 ms的平均地形图(为了方便显示, 图中差异波为惩罚条件−奖赏条件)。
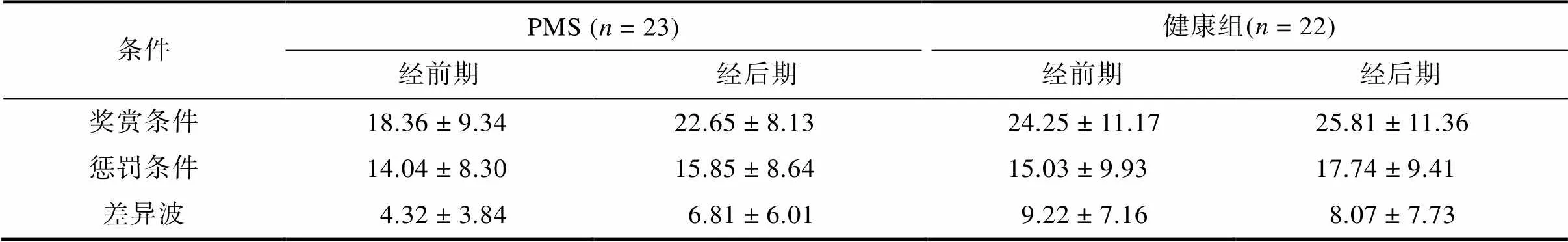
表5 PMS组和健康组在经前期和经后期奖赏、惩罚条件和差异波的平均波幅(M ± SD)
注:差异波的波幅为奖赏条件−惩罚条件, 表中数据单位为μV。
相关分析结果显示, 对于PMS组来说, 经前期奖赏条件下的RewP波幅(= 0.44,= 0.04)和差异波波幅(= 0.53,= 0.01)与经前期的情绪平衡相关(见图3), 而对于健康组来说则相关系数不显著(s > 0.14)。
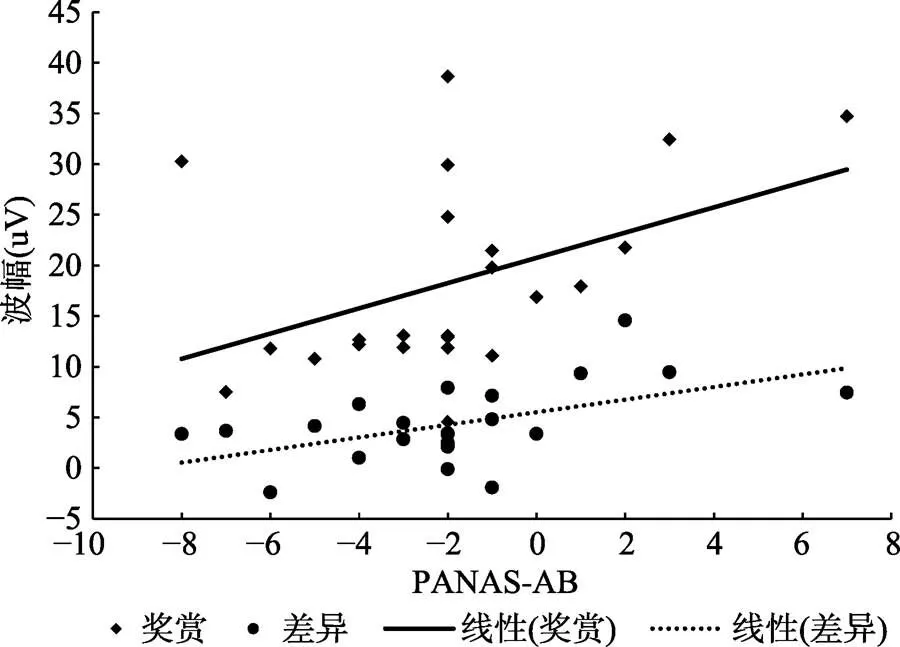
图3 PMS组经前期奖赏条件和差异波的平均波幅与PANAS-AB的相关, 差异波的波幅为奖赏条件−惩罚条件。
3.5 频域分析结果
对奖赏和惩罚条件下250~400 ms的θ频段能量进行的重复测量方差分析结果显示, 条件的主效应显著,(1, 43) = 27.23,< 0.001, η= 0.39; 条件×阶段×组别的交互效应显著,(1, 43) = 4.09,= 0.049, η= 0.09。进一步的简单简单效应显示, 对于经前期奖赏条件来说, 存在组间差异,(1, 43) = 7.54,= 0.009, Cohen’= 0.81; 其他条件不存在组间差异,s (1, 43) < 1.04,s > 0.31。在各种条件下, 均不存在显著的阶段差异,s (1, 43) < 2.81,s > 0.10。对于两组两个阶段来说, 两种条件均存在显著或者边缘显著的差异,s (1, 43) > 3.64,s < 0.06。
对250~400 ms的θ频段能量的差值进行的重复测量方差分析结果显示, 阶段的主效应和组别的主效应均不显著,s (1, 43) < 0.68,s > 0.41; 阶段×组别的交互效应显著,(1, 43) = 4.09,= 0.049, η= 0.09。但进一步的简单效应未显示显著的阶段差异和组间差异,s (1, 43) < 2.73,s > 0.11。健康组和PMS组在经前期、经后期θ频段能量差值的频谱图及其地形图如图4所示, 相关的θ频段能量如表6所示。
4 讨论
主观问卷结果显示, PMS女性在愤怒、恐惧、悲伤、厌恶以及负性情绪的得分高于健康女性, 在愉快与平静这两种正性情绪且总体情绪的愉悦度上低于健康组女性, 快感缺失量表得分高于健康女性, 这一结果与已往采用自评量表(Ducasse et al., 2016; Metcalf & Livesey, 1995; Rubinow et al., 1986)以及实验室研究的结果类似(Eggert, Kleinstäuber, Hiller, & Witthöft, 2017; Eggert et al., 2016; Protopopescu et al., 2008)。例如, Rubinow等人(1986)让20名PMS女性和8名健康组女性采用一个双相视觉模拟量表连续两个周期记录其情绪状态(最抑郁记为0分, 最高兴记为100分), 结果显示, 月经来潮前3天, 显示出了显著的组别差异, 健康组女性的得分显著高于PMS女性, 而在其他时间段则差异不显著。Metcalf和Livesey (1995)采用类似的方法让48名PMS女性和44名健康对照组女性记录整个月经周期内的情绪变化, 对其记录的正性情绪进行聚类分析发现, 对于PMS女性来说, 在月经周期的第11天左右正性情绪达到一个峰值, 而对于健康女性来说, 则无明显的峰值, 也就是说PMS女性在卵泡期的正性情绪显著高于经前期, 而健康组则无明显变化。Chen和Zhou (2016)采用图片观看范式, 发现PMS女性在图片呈现后400~800 ms这个时间窗口, 随着时间的增加, PMS女性对正性图片的激活呈现逐渐减小的趋势, 但健康女性则对正性图片的激活呈现不断增加的趋势, 也就是说PMS女性对正性图片的反应难以维持。其中, PMS的重度形式——经前期心境不良障碍(premenstrual dysphoric disorder, PMDD)已被收录到美国精神障碍诊断与统计手册第五版中作为抑郁症的一种亚型(APA, 2000), 对生活质量造成严重损害(Yamada, & Kamagata, 2017)。Petersen等人(2016)针对PMDD女性的一项调查也表明, PMDD女性在正性情绪量表上的得分显著比健康组女性低, Protopopescu等(2008)采用情绪Go/No-go任务发现, 与健康女性相比, PMDD女性在黄体晚期对正性刺激的腹侧纹状体反应减弱。此外, 本研究参照Koydemir等人(2013)和Liu等人(2013)的做法, 计算了被试的情绪平衡性, 发现PMS女性情绪平衡性确实低于健康女性, 体验到较多的负性情绪与较少的正性情绪。但是, 所有的问卷都没有得到阶段的特异性, 这可能与问卷测量, 尤其是实验室条件下的问卷测量敏感度不够有关, 并且仅挑选了每个月经阶段的一天, 可能结果不够精确。虽然未完全支持假设, 但是基本可以确认, PMS女性确实存在正性情绪缺失的问题。
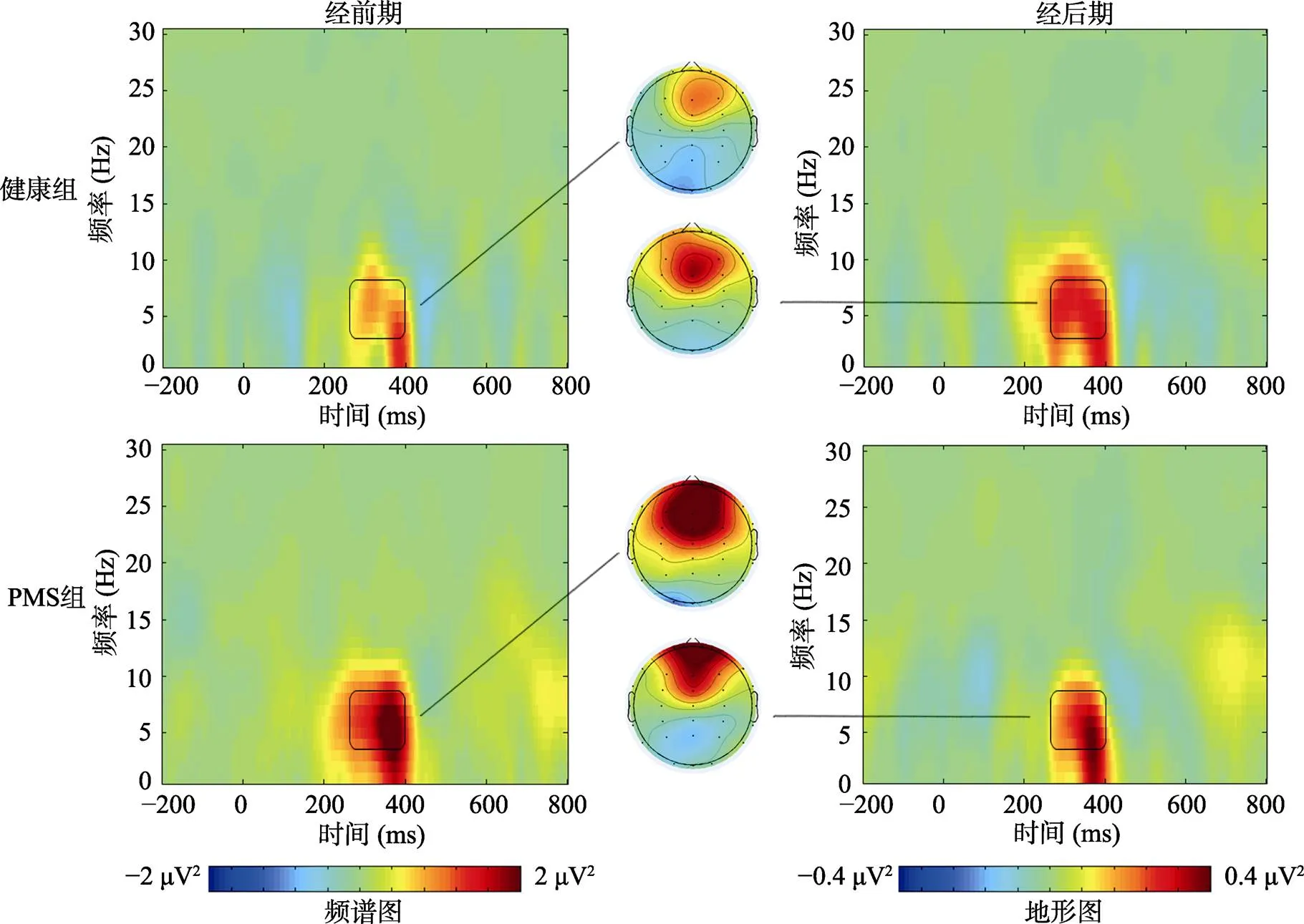
图4 健康组和PMS组在经前期和经后期θ频段能量差值的频谱图及其地形图(250~400 ms, 图中差值为惩罚条件−奖赏条件)

表6 PMS组和健康组在经前期和经后期奖赏、惩罚条件θ频段能量及其差值(M ± SD)
注:θ频段能量差值为奖赏条件−惩罚条件, 表中数据单位为μV。
时域结果显示, PMS组在经前期奖赏条件下250~350 ms的平均波幅低于健康组, 差异波的平均波幅低于健康女性, 进一步的相关分析结果显示, 经前期奖赏条件下的RewP波幅和差异波波幅与经前期的情绪平衡性相关。由于PMS的症状在黄体期出现, 而在其他阶段消失, 并且在(自发的或手术诱发的)无排卵周期中消失(Segebladh, Borgström, Nyberg, Bixo, & Sundströmporomaa, 2009), 所以研究者首先认为PMS是激素波动引起的, 但是后来的研究发现PMS 女性的孕酮、雌二醇等性激素水平与健康女性无显著差异(Gingnell et al., 2012; Huang, Zhou, Wu, Wang, & Zhao, 2014; Rapkin et al., 2011; Wu et al., 2016), 因此, 激素水平的异常并非PMS的主要成因。近年来, 研究者开始关注压力敏感性与PMS的关系, 究其原因, 一方面, 月经周期以及激素的波动与下丘脑−垂体−卵巢(hypothalamic- pituitary-ovarian, HPO)轴的功能有关, 而压力反应则与下丘脑−垂体−肾上腺(hypothalamic-pituitary- adrenal, HPA)轴有关, 鉴于HPO轴和HPA轴具有解剖学重叠, 所以HPO轴对激素的调节活动可能会对主导压力反应的HPA轴造成影响(Viau, 2002); 另一方面, PMS女性比健康组女性对月经具有较高的负性态度(Anjum et al., 2010), 也就是说对于PMS女性来说, 月经成了一种周期性发生的负性事件, 造成了月经到来前PMS女性主观压力感知的增加, 研究表明, 在同样的情况下, PMS女性在经前期比在经后期报告了更高的压力体验(Schmidt & Grover, 1990)。基于生理和心理两方面因素, 可以推测PMS女性在经前期压力敏感性的增加可能是导致其出现情绪障碍的主要原因。针对压力反应的研究, 最早关注HPA轴和自主神经系统(autonomic nervous system, ANS), 然而, 现在越来越多的研究者发现多巴胺系统在压力反应中也起着关键作用(Belujon & Grace, 2015)。多巴胺系统负责处理自然的或人工的奖赏类刺激, 边缘多巴胺介导奖赏刺激的享乐方面(Butler, Weiss, Stout, & Nemeroff, 1990)。针对动物的研究表明, 压力源可以导致多巴胺系统的迅速激活(Rougépont, Piazza, Kharouby, Moal, & Simon, 1993; Valenti, Lodge, & Grace, 2011), 压力源撤销之后, 会出现多巴胺系统的去激活(Chang & Grace, 2013; Moore, Rose, & Grace, 2001), 然而, 如果正常的急性压力源延长或重复出现, 则会导致病理结果。例如, 对接受长期压力的大鼠进行强迫游泳测试(压力情境), 表现出了多巴胺系统活动的减少(Chang & Grace, 2014), 而多巴胺系统的破坏则会导致奖赏反应的缺损(Carey, 1986; Huang & Hsiao, 2002)。Bogdan和Pizzagalli (2006)在大量动物研究的基础上, 进一步提出抑郁症患者快感缺失的出现, 主要是因为压力影响了与奖赏进程相关的多巴胺能路径和结构的功能, 从而降低了刺激对个体的奖励作用(Anisman & Matheson, 2005)。类似地, 本研究的结果可以推测, 对于PMS女性来说, 月经是一种长期的、周期性发生的负性事件, 因此在经前期与奖赏进程相关的多巴胺能路径和结构的功能受到影响, 表现出了收到奖赏反馈后的钝化反应。当然, 至于PMS女性奖赏进程的差异是否是由其在经前期对压力的感知不同导致的, 还有待进一步对压力进行直接测量从而对其因果关系进行研究。
据调查, 女性患抑郁和焦虑障碍的比例是男性的两倍(Altemus, 2006; Kessler et al., 1994), 并且在遭受创伤事件后患创伤后应激障碍的比例也是男性的两倍(Breslau, 2009; Kessler, Sonnega, Bromet, Hughes, & Nelson, 1995; Luxton, Skopp, & Maguen, 2010)。关于情绪障碍的性别差异原因虽未达成共识, 但是很多证据指向月经周期过程中卵巢激素(尤其是孕酮)的周期性变化(Altemus, 2006; Altemus, Sarvaiya, & Epperson, 2014)。这是因为卵巢激素与情绪有关, 一般认为, 孕酮可以提高负性情绪, 而雌二醇可以降低负性情绪(Sakaki & Mather, 2012)。月经周期以排卵期为界, 可以划分为排卵前的卵泡期和排卵后的黄体期。卵泡期的雌二醇和孕酮水平较低, 然后逐渐上升, 雌二醇水平在排卵日达到峰值; 在黄体期, 雌二醇水平有所下降, 达到次峰值, 而孕酮水平逐渐增加, 达到峰值(Farage, Neill, & MacLean, 2009)。一些研究从奖赏的角度探讨情绪的生理周期差异。例如, Dreher等(2007)的研究发现, 在收到奖赏反馈时, 女性在经后期比经前期的中脑、纹状体和额顶皮层的激活强度更高。而Ossewaarde等人(2010)的研究则发现比起经后期, 女性在经前期的纹状体的激活强度更高。可以看出, 虽然Dreher等(2007)和Ossewaarde等(2010)的研究均发现了在月经周期的不同阶段, 女性对奖赏的反应存在差异, 但是方向相反。Mulligan等(2018)的研究采用ERP的技术则没有发现阶段性差异。其中部分原因可能在于使用了不同的范式, 考察了奖赏的不同成分, 一般认为, 奖赏至少可以从时间维度上划分为奖赏预期与奖赏结果两个阶段。奖赏预期, 一般被称为“wanting”, 对应着奖赏的动机层面; 奖赏结果, 又被称为“liking”, 对应着奖赏的情绪层面(Murray, 2007)。第一、三项研究为奖赏结果阶段, 第二项为奖赏预期阶段。其次, 测量的时间不完全一致, 第一项为黄体晚期, 而后两项为黄体中期。最重要的是, 三项研究选择的被试来自不同的国家, Dreher等(2007)的被试来自于法国, Ossewaarde等(2010)的被试来自于荷兰, 而Mulligan等(2018)的被试来自于美国, 其中以亚洲人最多(51.1%)。由Direkvand-Moghadam等(2014)的元分析可知, PMS的检出率在不同的国家存在较大差异, 最高和最低分别为伊朗的98%和法国的12%, 那么在三项研究中之所以得到的结果差异较大, 极有可能是因为所选被试中PMS女性的比例不同, 而健康女性的情绪状态受激素水平的波动影响较少, PMS女性的情绪状态受激素水平的波动影响较大, 例如, Schmedt (1993)研究了促性腺激素释放激素激动剂类似物亮丙脯氨酸对20名PMS女性的卵巢抑制作用, 结果显示, 与基线值和安慰剂组相比, 10名服用亮丙脯氨酸的PMS女性症状明显减轻; 随后, 对10名PMS女性在服用亮丙脯氨酸使症状得到改善的期间给予雌二醇和孕酮激素(每种激素各服用4周), 另外10名则只使用了亮丙脯氨酸(其中5名服用安慰剂激素), 另外有15名健康女性也进行类似的分组, 结果显示, 10名服用亮丙脯氨酸的PMS女性在叠加使用雌二醇或孕酮期间症状明显复发, 但15名健康女性服用相同的治疗方案后, 或5名PMS女性在继续服用亮丙脯氨酸期间服用安慰剂激素后, 情绪无变化。也就是说, 对于PMS女性来说, 症状的出现是其对正常激素变化的异常反应。本研究将女性分为PMS女性和健康女性考察其在结果阶段奖赏进程的差异, 不仅为PMS的发病机制提供新的证据, 而且为解决生理周期和奖赏之间的关系的争议起到了重要的作用。当然, 由于条件所限, 本研究采用唾液样本对被试的性激素水平进行测试, 只能反映游离态水平, 未来的研究中可以采用连续测量或者以血样为样本的方式对性激素水平进行测量, 更精确地探讨激素水平与奖赏进程的关系。
此外, 与多巴胺系统密切相关的感觉门控系统——惊反射的前脉冲抑制也受到了激素水平的影响。惊反射是人对突然或有害的惊吓刺激的退缩反射(Davis, 1980), 而前脉冲抑制是指当有较弱的、非惊吓性的刺激出现在惊吓刺激之前时对惊反射的抑制(Hoffman & Ison, 1980)。研究表明, 前脉冲抑制受到性激素的影响, 雌二醇和孕酮的上升均会导致前脉冲抑制的降低(Swerdlow, Hartman, & Auerbach, 1997; Kumari et al., 2010)。基于此, 一些研究对惊反射和月经周期的关系进行研究, 例如Wu等人(2019)的研究表明, 雌二醇和孕酮水平都较高的经前期的前脉冲抑制显著低于月经期。而前脉冲抑制与多巴胺系统密切相关, 许多前脉冲抑制存在缺陷的精神疾病也存在多巴胺系统的缺陷, 如精神分裂症等(综述如Garcia-Sanchez, Martinez- Gras, Rodriguez-Jimenez, & Rubio, 2011)。Kask, Gulinello, Bäckström, Geyer和Sundström-Poromaa (2008)对PMDD女性的前脉冲抑制和健康女性的前脉冲抑制进行对比发现, PMDD女性在黄体期的前脉冲抑制显著低于健康组, 而在卵泡期则不存在差异, 这也反映出其经前期多巴胺系统的缺损, 与本研究时域分析的结果互相印证, 且说明对于PMS/ PMDD女性来说, 多巴胺系统的异常一方面导致底层的感觉门控系统的缺损另一方面导致了高阶的奖赏进程的缺损。
频域分析的结果表明, PMS组在经前期奖赏条件下250~400 ms的θ频段能量低于健康组。目前对于θ震荡活动有两种解释:一种认为θ震荡活动与违反预期有关(Tzur & Berger, 2009), 因为已有研究表明θ震荡活动的增加与认知控制(Botvinick, Braver, Barch, Carter, & Cohen, 2001)、冲突发现(Ridderinkhof, Ullsperger, Crone, & Nieuwenhuis, 2004)以及预测行动价值的期望偏差计算(Matsumoto, Matsumoto, Abe, & Tanaka, 2007; Oliveira, McDonald, & Goodman, 2007)有关。已有对于快感缺失人群的研究认为θ震荡活动的意外增强可能反映了他们收到的奖赏反馈违反了其负面预期, 当一个意想不到的奖赏反馈出现时, 它可能会在先前的(负性)期望之间引发内部冲突, 从而引发了较大的θ震荡活动(Padrão et al., 2013)。另一种理论解释认为, θ震荡活动与预期无关(Andreou et al., 2015), 诱发的RewP和引发的θ震荡活动反映了不同的认知加工过程, 具体而言, RewP反映了多巴胺介导的强化信号从中脑传递到前部扣带回皮层的过程(Holroyd & Coles, 2002), 而θ震荡活动与一般意外事件的认知进程相对应(Hajihosseini & Holroyd, 2013)。本研究的结果支持第一种解释, 即认为PMS女性在经前期对奖赏反馈的预期高于健康女性, 所以在收到奖赏反馈时产生的认知冲突更小, 从而θ频段能量更低。此外, Kumar等(2014)的研究表明, 应激增加了纹状体和杏仁核在奖赏预期阶段的激活, 但减少了纹状体在奖赏结果阶段的激活, 也就是说压力对奖赏预期和奖赏结果的影响是完全不同甚至相反的。从此出发, 可以推断PMS女性经前期处于“应激”状态下, 从而奖赏反馈的预期高于健康女性。更进一步来说, PMS女性对奖赏反馈的“过度预期”可能是其收到奖赏反馈时RewP波幅下降(对于PMS组经前期奖赏条件下来说, RewP波幅和θ频段能量相关显著,= 0.51,< 0.001, 而健康组则相关不显著)的原因。结合时域分析和频域分析得到的结果, 基本可以推断每个月周期性的激素波动和月经来潮对于PMS女性来说是压力性事件, 而压力对奖赏预期和奖赏结果阶段造成了相反的影响, 使其对奖赏的预期更为强烈而在收到奖赏的反馈时反应更为钝化, 从而造成其在经前期正性情绪的下降和情绪平衡性的失调。但是过度预期和反应钝化之间是否确实存在因果关系, 还有待进一步对奖赏预期阶段以及两者之间关系更为直观的研究和证据。
综上所述, RewP波幅以及θ频段能量与奖赏进程的加工有关, 而本研究结果显示在经前期, PMS女性RewP波幅以及θ频段能量均低于健康女性, 并且其RewP波幅与情绪的平衡性相关。我们的研究结果在理论和实践中都有重要的意义。从理论上来说, 一方面可有助于深入了解PMS女性情绪失调的神经机制, 尤其是从奖赏进程失调的角度考察了其正性情绪缺失的原因; 另一方面, 将女性分为PMS女性和健康女性, 有助于解决“激素的周期性变化与奖赏进程的关系”这一问题, 从而为考察情绪障碍的性别差异问题提供新的思路。从实践上来说, 可以为PMS女性的情绪障碍的干预问题提供依据, 为以往基于降低负性情绪的干预方案加以补充和丰富。下一步还可以从以下几个方面对PMS女性的奖赏进程异常的神经机制进行研究:(1)选择其他年龄段的女性群体, 尤其是激素波动最为剧烈的青春期女性和绝经期女性等作为研究对象以补充本研究得到的结论。(2)加入其他社会性奖赏刺激(如恋人的面孔等), 考察PMS女性对非金钱奖赏进行加工时的神经生理活动。(3)选用其他同时包含预期阶段和结果阶段的范式, 如金钱奖赏延迟任务(monetary incentive delay task, MIDT)等, 直接考察PMS女性和健康女性在奖赏预期阶段的差异, 以及PMS女性在奖赏预期阶段的过度反应是否与奖赏结果阶段的钝化反应有关。(4)进行追踪研究, 考察经前期奖赏进程失调对PMS的发生与否、病程长短的因果关系。(5)对PMS女性和健康女性在月经周期的压力水平进行测量, 从而直接考察PMS女性面临的压力与奖赏进程之间的关系。
Alheid, G. F. (2003). Extended amygdala and basal forebrain.(1), 185– 205.
Altemus, M. (2006). Sex differences in depression and anxiety disorders: Potential biological determinants.(4), 534–538.
Altemus, M., Sarvaiya, N., & Epperson, C. N. (2014). Sex differences in anxiety and depression clinical perspectives.(3), 320–330.
Amaral, D. G., & Price, J. L. (1984). Amygdalo-cortical projections in the monkey (Macaca fascicularis).(4), 465–496.
Andreou, C., Kleinert, J., Steinmann, S., Fuger, U., Leicht, G., & Mulert, C. (2015). Oscillatory responses to reward processing in borderline personality disorder.(8), 575–586.
Anisman, H., & Matheson, K. (2005). Stress, depression, and anhedonia: Caveats concerning animal models.(4-5), 525–546.
Anjum, F., Zehra, N., Haider, G., Rani, S., Siddique, A. A., & Munir, A. A. (2010). Attitudes towards menstruation among young women.(3), 619–622.
APA. (2000).4th edition-text revision.
Aron, A., Fisher, H., Mashek, D. J., Strong, G., Li, H., & Brown, L. L. (2005). Reward, motivation, and emotion systems associated with early-stage intense romantic love.(1), 327–337.
Bancroft, J. (1993). The premenstrual syndrome-A reappraisal of the concept and the evidence., 1–47.
Beck, A. T. (1967). Depression: Causes and treatment.(4), 765–786.
Beck, A. T., Epstein, N., Brown, G., & Steer, R. A. (1988). An inventory for measuring clinical anxiety: Psychometric properties.(6), 893–897.
Belujon, P., & Grace, A. A. (2015). Regulation of dopamine system responsivity and its adaptive and pathological response to stress.(1805), 20142516.
Berridge, K. C., & Robinson, T. E. (2003). Parsing reward.(9), 507–513.
Blood, A. J., & Zatorre, R. J. (2001). Intensely pleasurable responses to music correlate with activity in brain regions implicated in reward and emotion.(20), 11818–11823.
Bogdan, R., & Pizzagalli, D. A. (2006). Acute stress reduces reward responsiveness: Implications for depression.(10), 1147–1154.
Botvinick, M. M., Braver, T. S., Barch, D. M., Carter, C. S., & Cohen, J. D. (2001). Conflict monitoring and cognitive control.(3), 624–652.
Breslau, N. (2009). The epidemiology of trauma, PTSD, and other posttrauma disorders.(3), 198–210.
Bress, J. N., Foti, D., Kotov, R., Klein, D. N., & Hajcak, G. (2013). Blunted neural response to rewards prospectively predicts depression in adolescent girls.(1), 74–81.
Bress, J. N., Smith, E., Foti, D., Klein, D. N., & Hajcak, G. (2012). Neural response to reward and depressive symptoms in late childhood to early adolescence.(1), 156–162.
Brunia, C. H. M., & Damen, E. J. P. (1988). Distribution of slow brain potentials related to motor preparation and stimulus anticipation in a time estimation task.(3), 234–243.
Butler, P. D., Weiss, J. M., Stout, J. C., & Nemeroff, C. B. (1990). Corticotropin-releasing factor produces fear- enhancing and behavioral activating effects following infusion into the locus coeruleus.(1), 176–183.
Carey, R. J. (1986). An examination of parkinsonian versus anhedonia contributions to self-stimulation impairments induced by dopamine dysfunction.(2), 117–125.
Chang, C. H., & Grace, A. A. (2013). Amygdala β- noradrenergic receptors modulate delayed downregulation of dopamine activity following restraint.(4), 1441–1450.
Chang, C. H., & Grace, A. A. (2014). Amygdala-Ventral pallidum pathway decreases dopamine activity after chronic mild stress in rats.(3), 223–230.
Chen, L., & Zhou, R. (2016, June).Poster session presented at the annual meeting of the Organization for Human Brain Mapping, Geneva, Switzerland.
Cohen, M. X. (2014).MIT press.
Cohen, M. X., Elger, C. E., & Ranganath, C. (2007). Reward expectation modulates feedback-related negativity and EEG spectra.(2), 968–978.
Cona, G., Chiossi, F., di Tomasso, S., Pellegrino, G., Piccione, F., Bisiacchi, P., & Arcara, G. (2020). Theta and alpha oscillations as signatures of internal and external attention to delayed intentions: A magnetoencephalography (MEG) study., 116295.
Craner, J. R., Sigmon, S. T., & Martinson, A. A. (2015). Self-focused attention in response to laboratory stressors among women with premenstrual disorders.(4), 595–606.
Davis, M. (1980). Neurochemical modulation of sensory- motor reactivity: Acoustic and tactile startle reflexes.(2), 241–263.
Delorme, A., & Makeig, S. (2004). EEGLAB: An open source toolbox for analysis of single-trial EEG dynamics including independent component analysis.(1), 9–21.
Direkvand-Moghadam, A., Sayehmiri, K., Delpisheh, A., & Sattar, K. (2014). Epidemiology of premenstrual syndrome (PMS)-A systematic review and meta-analysis study.(2), 106– 109.
Dreher, J.-C., Schmidt, P. J., Kohn, P., Furman, D., Rubinow, D., & Berman, K. F. (2007). Menstrual cycle phase modulates reward-related neural function in women.(7), 2465–2470.
Ducasse, D., Jaussent, I., Olié, E., Guillaume, S., Lopezcastroman, J., & Courtet, P. (2016). Personality traits of suicidality are associated with premenstrual syndrome and premenstrual dysphoric disorder in a suicidal women sample.(2), e0148653.
Dueñas, J. L., Lete, I., Bermejo, R., Arbat, A., Pérezcampos, E., Martínezsalmeán, J., ... Coll, C. (2011). Prevalence of premenstrual syndrome and premenstrual dysphoric disorder in a representative cohort of Spanish women of fertile age.(1), 72–77.
Eggert, L., Kleinstäuber, M., Hiller, W., & Witthöft, M. (2017). Emotional interference and attentional processing in premenstrual syndrome., 77–87.
Eggert, L., Witthöft, M., Hiller, W., & Kleinstäuber, M. (2016). Emotion regulation in women with premenstrual syndrome (PMS): Explicit and implicit assessments.,(6), 747–763.
Farage, M. A., Neill, S., & MacLean, A. B. (2009). Physiological changes associated with the menstrual cycle: A review.(1), 58–72.
Foti, D., & Hajcak, G. (2009). Depression and reduced sensitivity to non-rewards versus rewards: Evidence from event-related potentials.(1), 1–8.
Fredrickson, B. L. (1998). What good are positive emotions?(3), 300–319.
Fredrickson, B. L., & Levenson, R. W. (1998). Positive emotions speed recovery from the cardiovascular sequelae of negative emotions.(2), 191– 220.
Fredrickson, B. L., Mancuso, R. A., Branigan, C., & Tugade, M. M. (2000). The undoing effect of positive emotions.(4), 237–258.
Garamoni, G. L., Reynolds, C. F., Thase, M. E., Frank, E., & Fasiczka, A. L. (1992). Shifts in affective balance during cognitive therapy of major depression.(2), 260–266.
Garamoni, G. L., Reynolds III, C. F., Thase, M. E., Frank, E., Berman, S. R., & Fasiczka, A. L. (1991). The balance of positive and negative affects in major depression: A further test of the states of mind model.(2), 99–108.
Garcia-Sanchez, F., Martinez-Gras, I., Rodriguez-Jimenez, R., & Rubio, G. (2011). Prepulse inhibition of the startle response/reflex in neuropsychiatric disorders.(7), 422–432.
Gingnell, M., Morell, A., Bannbers, E., Wikström, J., & Poromaa, I. S. (2012). Menstrual cycle effects on amygdala reactivity to emotional stimulation in premenstrual dysphoric disorder.(4), 400–406.
Hajihosseini, A., & Holroyd, C. B. (2013). Frontal midline theta and N 200 amplitude reflect complementary information about expectancy and outcome evaluation.(6), 550–562.
Hoffman, H. S., & Ison, J. R. (1980). Reflex modification in the domain of startle: I. Some empirical findings and their implications for how the nervous system processes sensory input.(2), 175-189.
Holroyd, C. B., & Coles, M. G. H. (2002). The neural basis of human error processing: Reinforcement learning, dopamine, and the error-related negativity.(4), 679–709.
Holroyd, C. B., & Krigolson, O. E. (2007). Reward prediction error signals associated with a modified time estimation task.(6), 913–917.
Holroyd, C. B., Pakzadvaezi, K. L., & Krigolson, O. E. (2008). The feedback correct-related positivity: Sensitivity of the event-related brain potential to unexpected positive feedback.(5), 688–697.
Hu, L., Xiao, P., Zhang, Z. G., Mouraux, A., & Iannetti, G. D. (2014). Single-trial time–frequency analysis of electrocortical signals: Baseline correction and beyond.(1), 876–887.
Huang, A. C. W., & Hsiao, S. (2002). Haloperidol attenuates rewarding and aversively conditioned suppression of saccharin solution intake: Reevaluation of the anhedonia hypothesis of dopamine blocking.(116), 646–650.
Huang, L., Yang, T. Z., & Ji, Z. M. (2003). Applicability of the positive and negative affect scale in Chinese.(1), 54–56.
[黄丽, 杨廷忠, 季忠民. (2003). 正性负性情绪量表的中国人群适用性研究.(1), 54–56.]
Huang, Y., Zhou, R., Wu, M., Wang, Q., & Zhao, Y. (2014). Premenstrual syndrome is associated with blunted cortisol reactivity to the TSST.(2), 160–168.
Kask, K., Gulinello, M., Bäckström, T., Geyer, M. A., & Sundström-Poromaa, I. (2008). Patients with premenstrual dysphoric disorder have increased startle response across both cycle phases and lower levels of prepulse inhibition during the late luteal phase of the menstrual cycle.(9), 2283–2290.
Kessler, R. C., McGonagle, K. A., Nelson, C. B., Hughes, M., Swartz, M., & Blazer, D. G. (1994). Sex and depression in the national comorbidity survey. II: Cohort effects.(1), 15–26.
Kessler, R. C., Sonnega, A., Bromet, E., Hughes, M., & Nelson, C. B. (1995). Posttraumatic stress disorder in the National Comorbidity Survey.(12), 1048–1060.
Koydemir, S., Şimşek, Ö. F., Schütz, A., & Tipandjan, A. (2013). Differences in how trait emotional intelligence predicts life satisfaction: The role of affect balance versus social support in India and Germany.(1), 51–66.
Kumar, P., Berghorst, L. H., Nickerson, L. D., Dutra, S. J., Goer, F. K., Greve, D. N., & Pizzagalli, D. A. (2014). Differential effects of acute stress on anticipatory and consummatory phases of reward processing., 1–12.
Kumari, V., Konstantinou, J., Papadopoulos, A., Aasen, I., Poon, L., Halari, R., & Cleare, A. J. (2010). Evidence for a role of progesterone in menstrual cycle-related variability in prepulse inhibition in healthy young women.5(4), 929–937.
Liu, W. H., Wang, L. Z., Shang, H. R., Shen, Y., Li, Z., Cheung, E. F., & Chan, R. C. (2014). The influence of anhedonia on feedback negativity in major depressive disorder.(4), 213–220.
Liu, W. H., Wang, L. Z., Zhu, Y. H., Li, M. H., & Chan, R. C. (2012). Clinical utility of the Snaith-Hamilton pleasure scale in the Chinese settings.(1), 184.
Liu, Y., Wang, Z., & Lü, W. (2013). Resilience and affect balance as mediators between trait emotional intelligence and life satisfaction.(7), 850–855.
Luxton, D. D., Skopp, N. A., & Maguen, S. (2010). Gender differences in depression and PTSD symptoms following combat exposure.(11), 1027– 1033.
Marco-Pallares, J., Cucurell, D., Cunillera, T., García, R., Andrés-Pueyo, A., Münte, T. F., & Rodríguez-Fornells, A. (2008). Human oscillatory activity associated to reward processing in a gambling task.(1), 241-248.
Matsumoto, M., Matsumoto, K., Abe, H., & Tanaka, K. (2007). Medial prefrontal cell activity signaling prediction errors of action values.(5), 647–656.
Metcalf, M. G., & Livesey, J. H. (1995). Distribution of positive moods in women with the premenstrual syndrome and in normal women.(5), 609–618.
Moore, H., Rose, H. J., & Grace, A. A. (2001). Chronic cold stress reduces the spontaneous activity of ventral tegmental dopamine neurons.(4), 410– 419.
Morgan, J. K., Olino, T. M., Mcmakin, D. L., Ryan, N. D., & Forbes, E. E. (2013). Neural response to reward as a predictor of increases in depressive symptoms in adolescence.(4), 66–74.
Mouraux, A., & Iannetti, G. D. (2008). Across-trial averaging of event-related EEG responses and beyond.(7), 1041–1054.
Mulligan, E. M., Nelson, B. D., Infantolino, Z. P., Luking, K. R., Sharma, R., & Hajcak, G. (2018). Effects of menstrual cycle phase on electrocortical response to reward and depressive symptoms in women.(12), e13268.
Murray, E. A. (2007). The amygdala, reward and emotion.(11), 489–497.
Nelson, B. D., Perlman, G., Klein, D. N., Kotov, R., & Hajcak, G. (2016). Blunted neural response to rewards as a prospective predictor of the development of depression in adolescent girls.(12), 1223–1230.
Nieuwenhuis, S., Slagter, H. A., von Geusau, N. J. A., Heslenfeld, D. J., & Holroyd, C. B. (2005). Knowing good from bad: Differential activation of human cortical areas by positive and negative outcomes.(11), 3161–3168.
Oliveira, F. T. P., McDonald, J. J., & Goodman, D. (2007). Performance monitoring in the anterior cingulate is not all error related: Expectancy deviation and the representation of action-outcome associations.(12), 1994–2004.
Ossewaarde, L., van Wingen, G. A., Kooijman, S. C., Bäckström, T., Fernández, G., & Hermans, E. J. (2010). Changes in functioning of mesolimbic incentive processing circuits during the premenstrual phase.(5), 612–620.
Padrão, G., Mallorquí, A., Cucurell, D., Marco-Pallares, J., & Rodriguez-Fornells, A. (2013). Neurophysiological differences in reward processing in anhedonics.(1), 102–115.
Petersen, N., London, E. D., Liang, L., Ghahremani, D. G., Gerards, R., Goldman, L., & Rapkin, A. J. (2016). Emotion regulation in women with premenstrual dysphoric disorder.(5), 891–898.
Protopopescu, X., Tuescher, O., Pan, H., Epstein, J., Root, J., Chang, L., ... Sibersweig, D. (2008). Toward a functional neuroanatomy of premenstrual dysphoric disorder.(1-2), 87–94.
Proudfit, G. H. (2015). The reward positivity: From basic research on reward to a biomarker for depression.(4), 449–459.
Rapkin, A. J., Berman, S. M., Mandelkern, M. A., Silverman, D. H. S., Morgan, M., & London, E. D. (2011). Neuroimaging evidence of cerebellar involvement in premenstrual dysphoric disorder.(4), 374–380.
Ridderinkhof, K. R., Ullsperger, M., Crone, E. A., & Nieuwenhuis, S. (2004). The role of the medial frontal cortex in cognitive control.(5695), 443–447.
Rougépont, F., Piazza, P. V., Kharouby, M., Moal, M. L., & Simon, H. (1993). Higher and longer stress-induced increase in dopamine concentrations in the nucleus accumbens of animals predisposed to amphetamine self-administration: A microdialysis study.(1), 169–174.
Rubinow, D. R., Roybyrne, P., Hoban, M. C., Grover, G. N., Stambler, N., & Post, R. M. (1986). Premenstrual mood changes: Characteristic patterns in women with and without premenstrual syndrome.(2), 85–90.
Sakaki, M., & Mather, M. (2012). How reward and emotional stimuli induce different reactions across the menstrual cycle.(1), 1–17.
Salimpoor, V. N., Benovoy, M., Larcher, K., Dagher, A., & Zatorre, R. J. (2011). Anatomically distinct dopamine release during anticipation and experience of peak emotion to music.(2), 257–262.
Schimmack, U. (2008). The structure of subjective well-being. In M. Eid & R. J. Larsen (Eds.),(pp. 97–123). Guilford Press.
Schmidt, P. J., & Grover, G. N. (1990). State-dependent alterations in the perception of life events in menstrual- related mood disorders.(2), 230–234.
Schmedt, P. (1993). Differential behavioral effects of gonadal steroids in women with and in those without premenstraul syndrome.(4), 209–216.
Schwartz, R. M., Reynolds III, C. F., Thase, M. E., Frank, E., Fasiczka, A. L., & Haaga, D. A. (2002). Optimal and normal affect balance in psychotherapy of major depression: Evaluation of the balanced states of mind model.(4), 439–450.
Segebladh, B., Borgström, A., Nyberg, S., Bixo, M., & Sundströmporomaa, I. (2009). Evaluation of different add- back estradiol and progesterone treatments to gonadotropin- releasing hormone agonist treatment in patients with premenstrual dysphoric disorder.(2), 139.e1- 139.e8.
Snaith, R. P., Hamilton, M., Morley, S., Humayan, A., Hargreaves, D., & Trigwell, P.. (1995). A scale for the assessment of hedonic tone the Snaith-Hamilton pleasure scale.(1), 99–103.
Swerdlow, N. R., Hartman, P. L., & Auerbach, P. P. (1997). Changes in sensorimotor inhibition across the menstrual cycle: Implications for neuropsychiatric disorders.(4), 452–460.
Tzur, G., & Berger, A. (2009). Fast and slow brain rhythms in rule/expectation violation tasks: Focusing on evaluation processes by excluding motor action.(2), 420–428.
Valenti, O., Lodge, D. J., & Grace, A. A. (2011). Aversive stimuli alter ventral tegmental area dopamine neuron activity via a common action in the ventral hippocampus.(11), 4280–4289.
Viau, V. (2002). Functional cross-talk between the hypothalamic-pituitary-gonadal and -adrenal axes.(6), 506–513.
Watson, D., Clark, L. A., & Tellegen, A. (1988). Development and validation of brief measures of positive and negative affect: The PANAS scales.(6), 1063–1070.
Wu, C., Ding, Y., Chen, B., Gao, Y., Wang, Q., Wu, Z., ... Li, L. (2019). Both Val158Met polymorphism of catechol-o- methyltransferase gene and menstrual cycle affect prepulse inhibition but not attentional modulation of prepulse inhibition in younger-adult females.396–406.
Wu, M., Liang, Y., Wang, Q., Zhao, Y., & Zhou, R. (2016). Emotion dysregulation of women with premenstrual syndrome., 38501.
Wu, M. Y., Zhou, R. L., Huang, Y. M., Wang, Q. G., Zhao, Y., & Liu, Y. F. (2014). Effects of menstrual cycle and neuroticism on emotional responses of healthy women.(1), 58–68.
[吴梦莹, 周仁来, 黄雅梅, 王庆国, 赵燕, 刘雁峰. (2014). 神经质程度和月经周期对女性主观情绪和生理反应的影响.(1), 58–68.]
Yamada, K., & Kamagata, E. (2017). Reduction of quality- adjusted life years (QALYs) in patients with premenstrual dysphoric disorder (PMDD).6(11), 3069–3073.
Zhang, Y. X., Wang, Y., & Qian, M. Y. (1990). Reliability and validity of Beck depression inventory (BDI) examined in Chinese samples.(4), 164–168.
[张雨新, 王燕, 钱铭怡. (1990). Beck抑郁量表的信度和效度.(4), 164–168.]
Zhao, G. L., Wang, L. H., & Qu, C. Y. (1998). Prevalence of premenstrual syndrome in reproductive women and its influential factors.(4), 222–224.
[赵更力, 王临虹, 渠川琰. (1998). 育龄妇女经前期综合征的发生情况及影响因素.(4), 222–224.]
Zheng, J. R., Huang, Z. R., Huang, J. J., Zhuang, X. Q., Wang, D. B., Zheng, S. Y., ... Wu, J. A. (2002). A study of psychometric properties, normative scores and factor structure of Beck anxiety inventory Chinese version.(1), 4–6.
[郑健荣, 黄炽荣, 黄洁晶, 庄香泉, 王得宝, 郑淑仪, ... 吴基安. (2002). 贝克焦虑量表的心理测量学特性、常模分数及因子结构的研究.(1), 4–6.]
Zhou, W., He, G., Gao, J., Yuan, Q., Feng, H., & Zhang, C. K. (2012). The effects of group reminiscence therapy on depression, self-esteem, and affect balance of Chinese community-dwelling elderly.(3), e440–e447.
Altered reward processing in women with premenstrual syndrome: Evidence from ERPs and time-frequency analysis
HOU Lulu; CHEN Lirong; ZHOU Renlai
(Department of Psychology, Nanjing University, Nanjing 210023, China)
Premenstrual syndrome (PMS) refers to a series of physical, emotional, and behavioral symptoms that occur periodically in women during the late luteal phase of the menstrual cycle. It peaks within a week before menses and improves or disappears after the onset of menses. PMS occurs in 30%~40% of females at reproductive-age and can have deleterious effects on the social functioning and interpersonal relationships for those with PMS during the late luteal phase. Therefore, the potential causes and mechanisms of PMS have attracted researchers' attention. Affect balance is an important basis for maintaining mental health and the imbalance of positive and negative affect might be one of the causes of PMS. However, previous studies on the mechanism of PMS mostly focused on the increase of negative affect. Only limited studies explored the decrease of positive affect. Built upon the strong link between positive affect and reward processing, the present study aims to explore the causes of positive affect deficiencies tied to the dysfunctional reward processing during PMS.
Despite the lack of consensus on the diagnostic criteria of PMS, one of the most widely used diagnostic criteria for PMS are from John Bancroft’s recommendations, which have been translated into the PMS Scale in Chinese. Of the 259 women who were asked to self-assess using this scale, 45 right-handed females (23 with PMS and 22 without PMS) with regular menstrual cycle voluntarily participated in this study. After completing a series of questionnaires, a simple gambling task was used to elicit reward positivity (RewP, 250~350 ms), an event-related potential (ERP) component elicited by feedback indicating gain versus loss. All participants completed this task twice, once in the late luteal and the other in the early follicular phase, respectively. In addition to ERP analysis, we also conducted time-frequency analysis to examine the neural oscillations underlying the reward processing.
Questionnaire results showed that women with PMS reported lower levels of happiness and calmness than healthy women, and their affect balance was also lower than that of healthy women, independent of menstrual cycle. Electrophysiological results suggested that in the late luteal phase, compared with healthy women, women with PMS were characterized by reduced RewP responses towards monetary gains, but not towards monetary losses. Further correlational analysis showed that the amplitude of RewP to gain feedback and difference wave amplitude in women with PMS was related to the affect balance in the late luteal phase. Time-frequency analysis showed that the theta-band (4~7 Hz, 250~4000 ms) power to gain feedback in PMS group was lower than that of healthy group in the late luteal phase.
Taken together, the amplitude of RewP and the theta-band power are related to reward processing. Results showed that in the late luteal phase, the amplitude of RewP and the theta-band power in women with PMS were lower than that in healthy women, and the amplitude of RewP was related to affect balance for women with PMS. These results suggest that the altered neurophysiological response in reward processing of women with PMS may be one of the causes of their low positive affect and affect imbalance in the late luteal phase. Our findings provide a basis for PMS intervention from the perspective of increasing positive affect, which supplements and enriches previous interventions mostly based on reducing negative affect.
premenstrual syndrome; menstrual cycle; late luteal phase; positive affect; reward processing; reward positivity; theta-band; time-frequency analysis
2019-09-06
* 江苏高校哲学社会科学重点研究基地重大项目(2015JDXM001)、南京大学双创示范基地重点项目(SCJD0406)和南京大学博士研究生创新创意计划(CXCY18-06)资助。
周仁来, E-mail: rlzhou@nju.edu.cn
B845

