大鲵肌肉ACE抑制肽的制备及其稳定性
王泽奇,杨双盼,冉旭*
四川大学食品工程系(成都 610065)
血管紧张素转化酶(ACE)可将无活性的血管紧张素Ⅰ(Ang Ⅰ)催化成血管紧张素Ⅱ(Ang Ⅱ),Ang Ⅱ会促使平滑肌收缩、醛固酮的分泌,导致血压升高。ACE能通过降解纾缓激肽阻断血压下降通路,ACE抑制剂(ACEI)通过抑制ACE活性,降低Ang Ⅱ生成。因而抑制ACE活性可起到调节血管舒张功能。
通过蛋白酶将蛋白质切割成多肽是制备天然ACEI的主要手段,由于蛋白酶的酶切位点和原料氨基酸组成不同,有超过70种具有ACE抑制作用的多肽被发现,它们来自各种不同的食物原料。如Li等[1]从蚕蛹中得到氨基酸组成序列为Val-Glu-Ile-Ser的多肽,其IC50为28.3 μg/mL;Otte等[2]通过酶解、凝胶色谱、反相高效液相色谱等手段从羊奶发酵制品中得到物种ACE抑制肽,其IC50从1~5 μmol不等。周明等[3]从玉米黄粉中制备得到ACE抑制肽,并利用质谱鉴定得到4个多肽序列,说明从天然食物中获取具有降压功能的产品的可行性。但这些研究大多使用单酶,而尚未有以大鲵为原料制备ACE抑制肽的报道,因此,通过单因素及混料试验,优化复合酶法制备大鲵肌肉ACE抑制肽方法,并探究金属离子和体外模拟胃肠消化道酶系对ACE抑制率稳定性的影响,为大鲵综合化利用提供理论依据,为高血压的辅助治疗提供安全有效的思路。
1 材料与方法
1.1 材料与试剂
人工养殖大鲵(四川溪源水产养殖有限公司);风味蛋白酶、中性蛋白酶、菠萝蛋白酶、碱性蛋白酶、糜蛋白酶、胰蛋白酶;N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG)、血管紧张素转化酶(ACE)(上海底化生物有限公司);氨基酸标准品(Sigma公司);浓盐酸、异硫氰酸苯酯、三乙胺、乙腈(色谱纯)、醋酸钠(国药集团化学试剂有限公司);氯化铝、氯化铁、氯化锌等(成都市蜀都牛牛生物科技有限公司)。
1.2 仪器与设备
1260高效液相色谱仪(安捷伦科技(中国)有限公司);HH4恒温水浴锅(常州国华电器有限公司);TGL-15B告诉台式离心机(上海安亭科学仪器厂);电动搅拌机器(方科仪器有限公司);JA1023型电子天平(上海精科天平厂);Spestra Max 90光吸收酶标仪(美谷分子仪器上海有限公司);LGJ-30F冷冻干燥机(北京松源华兴科技发展有限公司)。
1.3 试验方法
1.3.1 大鲵肌肉多肽制备工艺流程
参考胡廷等[4]的方法并略作修改。将冷冻的大鲵室温解冻,切除爪、脂肪、皮、骨等部位。将肌肉切成肉泥,加入设定液料比的蒸馏水。放入恒温水浴锅保持设定水温。加入酶。辅以电动搅拌机进行酶解。酶解完成后,煮沸10 min以灭酶。待其冷却至室温,以4 000 r/min离心15 min,常压煮沸浓缩至固形物含量10%左右,将上清液通过真空冷冻干燥50 h即得到大鲵肌肉多肽粉,保存于干燥器中。
1.3.2 大鲵肌肉氨基酸测定
取1.0 g左右质量的样品于20 mL水解管中,加入8 mL 6 mol/L盐酸溶液,真空脱气30 min,充氮封管,在110℃下水解24 h,取出冷却开管,用去离子水无损转移到50 mL容量瓶中,并定容。准确取1 mL水解液于小瓶中,于真空中脱酸抽干,加1 mL水抽干,加1 mL水再抽干备用。准确加入10 mL 0.02 mol/L盐酸溶液,充分溶解,准确量取上述溶液500 μL,置于5 mL塑料离心管中,精密加入1 mol/L三乙胺乙腈溶液250 μL,混匀,准确加入0.1 mol/L异硫氰酸苯酯乙腈溶液250 μL,混匀,室温放置1 h,加2 mL正己烷,剧烈振摇,放置10 min,取下层溶液用0.45 μm的滤膜过滤上机分析。
1.3.3 蛋白酶初筛
考虑到酶解条件的简便性和复配时的可操作性,蛋白酶的初筛条件为在最适pH 7左右,可节省调节pH的过程,选择碱性蛋白酶、风味蛋白酶、菠萝蛋白酶、糜蛋白酶、胰蛋白酶、中性蛋白酶进行单因素试验。其余试验条件为温度50℃、pH 7、液料比4∶1 mL/g、酶解时间5 h、酶添加量[E]/[S]=10%。
1.3.4 混料试验确定蛋白酶复配比例
经过单酶试验后,确定酶解物ACE抑制效果最佳的3种酶,利用Design-Expert给出的设计方案进行混料试验,得到三酶混合的情况下最优配比,进一步优化酶解条件。混料试验设计方案见表1。

表1 混料试验设计方案
1.3.5 ACE抑制率的测定
N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG)是与AngⅠ有相似结构的物质,该物质在340 nm处具有最大吸收峰,可被ACE催化分解。因此吸光度的变化速率可以表征FAPGG的分解。FAPGG分解速率的降低可反映多肽对ACE的抑制率。具体操作参考Shalaby等[5]的方法,并略作修改。事先配好50 mmol/L的Tris-HCI缓冲溶液,并加入NaCl,使NaCl浓度0.3 mol/L。以该缓冲溶液为溶剂配置50 mmol/L的FAPGG溶液作为底物。在酶标板孔中依次加入10 μL、0.25 U/L的ACE溶液和10 μL待测样品,考虑到待测样品的量效关系、统一将样品稀释为1 mg/mL。150 μL经过预热的FAPGG溶液,于37℃下反应,每隔1 min测定1次吸光度(Δ)。以超纯水代替待测样品作对照。按照式(1)计算ACE抑制率。
ACE抑制率=(1-Δ试验值/Δ对照值)×100% (1)
1.3.6 金属离子对大鲵肌肉ACE抑制肽抑制效果的影响
将大鲵多肽的浓度确定在1 mg/mL,测定ACE抑制率。分别加入3 mmol/L氯化铜、氯化铁、氯化钾、氯化镁、氯化铝、氯化锌、氯化钠。静置2 h后,测定ACE抑制率。通过活性保持率这一指标表示金属离子对大鲵肌肉ACE抑制肽的影响效果,活性保持率越小,代表该金属离子的对ACE抑制率的负面影响越大。按照式(2)计算活性保持率。
活性保持率=静置后ACE抑制率/静置前ACE抑制率 (2)
1.3.7 体外模拟胃肠消化道酶系对大鲵肌肉ACE抑制肽抑制效果的影响
体外模拟胃肠消化道酶系的方法参考李莹[6]方法并略做修改,将大鲵肌肉ACE抑制肽浓度控制在50 mg/mL,使用1 mol/L盐酸调节至pH 2,加入大鲵多肽粉质量0.5%的胃蛋白酶,在水浴锅中保持37℃,时长2 h。每隔0.5 h取样1次,灭酶10 min,稀释至浓度1 mg/mL测定ACE抑制率。2 h后,使用5 mol/L NaOH溶液调节至pH 7,加入多肽质量0.5%的胰蛋白酶,水浴锅中保持37℃,时长4 h。每隔0.5 h取样1次,灭酶10 min,稀释至浓度1 mg/mL测定ACE抑制率并记录。
1.3.8 数据分析
单因素均进行3次平行试验,使用Excel作图,使用Design-Expert进行响应面设计与分析。用Duncan法进行多重比较,标有不同小写字母者表示组间差异显著(p<0.05);标有相同小写字母表示组间差异不显著(p>0.05)。
2 结果与分析
2.1 大鲵肌肉的氨基酸组成
大鲵肌肉的氨基酸组成如表2所示。有研究表明,ACE抑制肽的活性与N端的疏水性氨基酸及C端的支链氨基酸有关[7]。大鲵肌肉中,支链氨基酸为151.4 mg/g,疏水性氨基酸为380 mg/g,分别占总氨基酸含量的17.7%和44.5%,说明大鲵是潜在的良好ACE抑制肽制备原料。
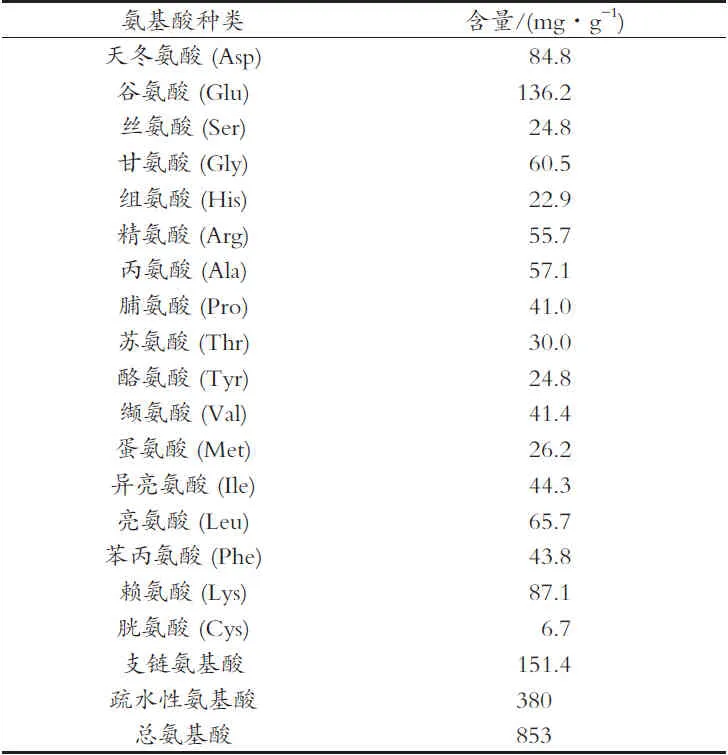
表2 大鲵肌肉氨基酸组成表
2.2 蛋白酶筛选结果
单酶筛选试验的结果如图1所示。结果表明,6种单酶的酶解效果有较为明显差异,分别为风味蛋白酶>菠萝蛋白酶>中性蛋白酶>糜蛋白酶>碱性蛋白酶>胰蛋白酶,各组之间均差异显著(p<0.05)。因而,在后续的三酶配比中选择风味蛋白酶、菠萝蛋白酶及中性蛋白酶进行复配试验。
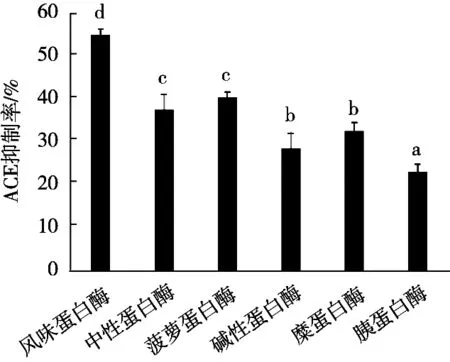
图1 不同单酶对大鲵肌肉酶解产物ACE抑制率的影响
2.3 混料设计试验结果
混料试验结果与方差分析分别见表3和表4,得到的拟合方程为ACE抑制率= 52.700 00A+37.159 59B+ 41.159 59C+88.414 16AB+91.680 82AC+68.868 49BC+ 20.636 99ABC+64.760 50AB(A-B)+25.378 77AC(A-C)+61.650 00BC(B-C)。根据回归方程得到的曲线图和等高线图如图2和3所示,由图可推测,该方程有最大值。对方程取极大值,也就是风味蛋白酶、中性蛋白酶、菠萝蛋白酶质量比为0.54∶0.23∶0.23时,理论ACE抑制率为76.50%。实际试验后得到,此配比下酶解液在1 mg/mL时的ACE抑制率为75.5%,与理论值较为接近,验证了方程具有较理想的拟合效果。经过单因素及混料设计优化后的酶解物在不同浓度下的ACE抑制率如图4所示。大鲵肌肉ACE抑制肽在一定浓度范围内有较好的量效关系。曲线经拟合得到的方程为y=79.462x+6.219,R2=0.928 9。由此计算出其大鲵多肽ACE抑制率的IC50值为0.55 mg/mL。
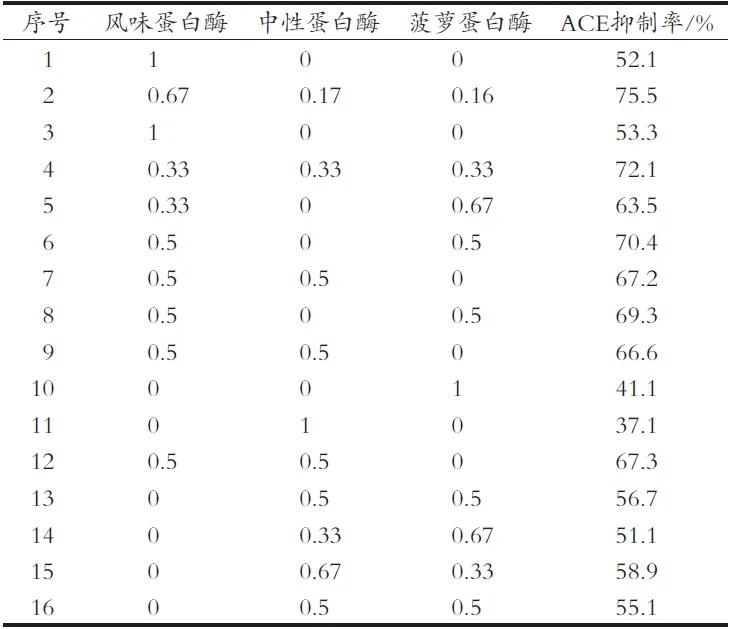
表3 混料设计试验结果
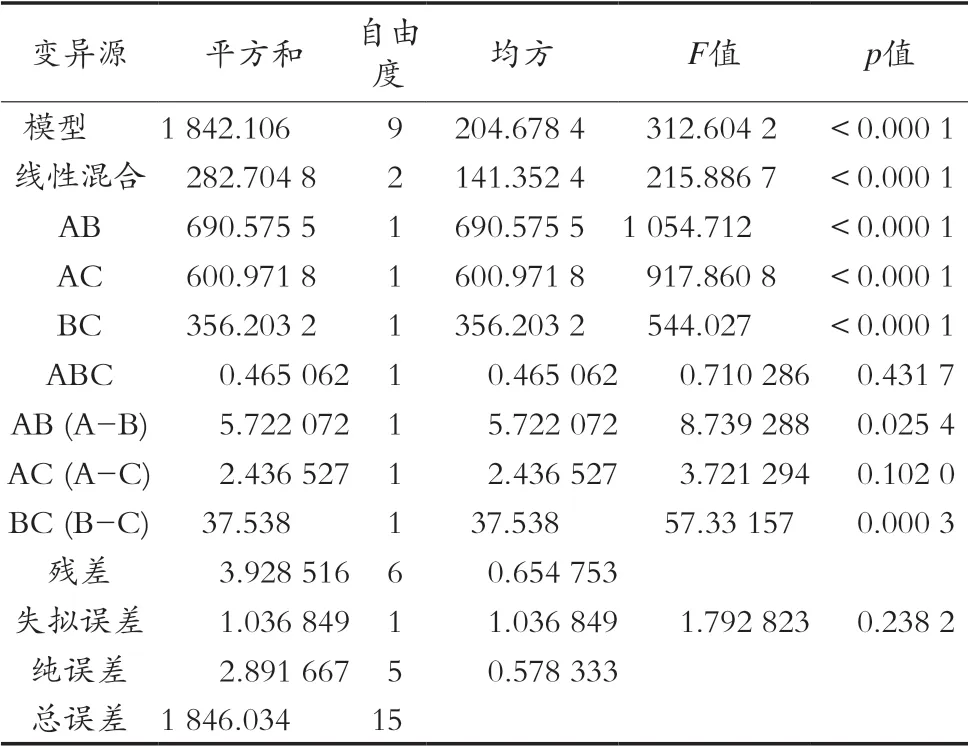
表4 混料试验回归方程方差分析
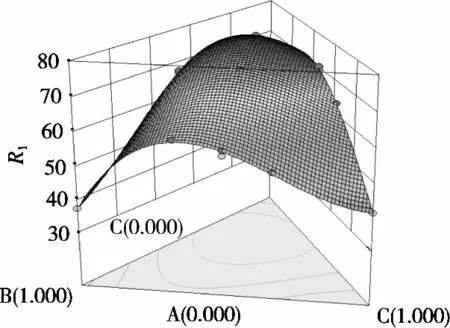
图2 风味蛋白酶、中性蛋白酶、菠萝蛋白酶曲面图
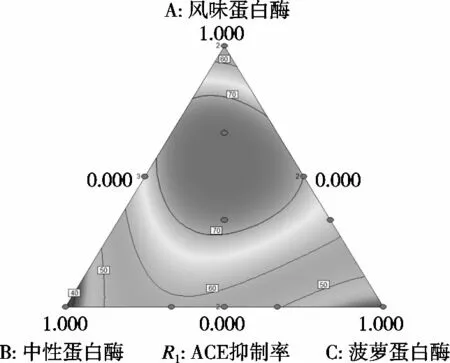
图3 风味蛋白酶、中性蛋白酶、菠萝蛋白酶对ACE抑制率影响的等高线
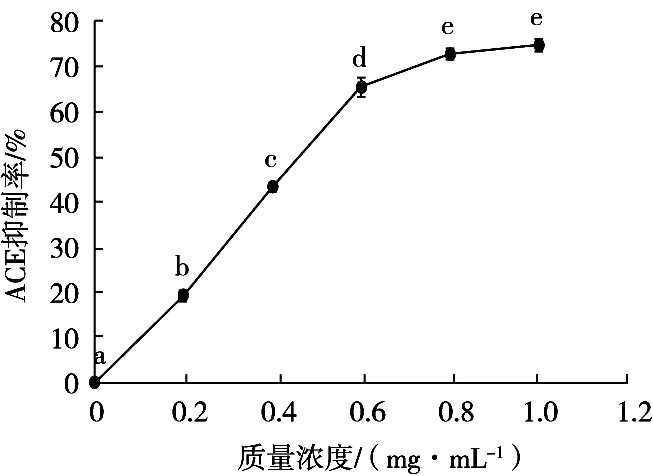
图4 不同浓度大鲵肌肉酶解物的ACE抑制率
2.4 不同金属离子对大鲵肌肉对大鲵肌肉ACE抑制肽抑制效果的影响
如图5所示,金属离子环境均会不同程度降低大鲵多肽的ACE抑制率。但不同金属离子对ACE抑制率的影响有所不同。Zn2+、Al3+、Fe2+对结果的影响较为显著。其中,Zn2+使大鲵多肽的ACE抑制率降低为处理前的57%。Zn2+被认为是ACE活性中心的关键离子。因而处于Zn2+环境可能使ACE活性增强,从而削弱多肽对其抑制率。

图5 不同金属离子对大鲵肌肉ACE抑制肽抑制效果的影响
2.5 体外模拟胃肠消化道对大鲵肌肉ACE抑制肽抑制效果的影响
一般而言,ACE抑制肽必须完整地被肠道吸收才能体内发挥抑制ACE活力的作用。根据在消化道内抑制效果的变化情况,ACE抑制肽可被分为3类——抑制性增强、抑制性降低及抑制性不变[8]。抑制性增强主要是因为胃肠道的环境使多肽进一步降解成抑制效果更好的产物,也被称为前药物肽,而抑制性减弱的原因则相反。抑制性不变的ACE抑制肽源于其能抵抗住胃肠道环境的作用。如李莹[6]从泥鳅蛋白中得到的ACE抑制肽即属于第二种类型,而Pan等[9]从条浒苔蛋白得到的ACE抑制肽就属于第三种类型。试验得到的大鲵肌肉蛋白ACE抑制肽抑制效果在胃肠道的变化情况如图6所示。在经过模拟的胃蛋白酶系时大鲵多肽ACE抑制率没有显著变化。但经过模拟的胰蛋白酶系,其抑制率有明显下降,极低值仅为初始时的一半左右,说明试验得到的ACE抑制肽属于所述类型中的第2种。
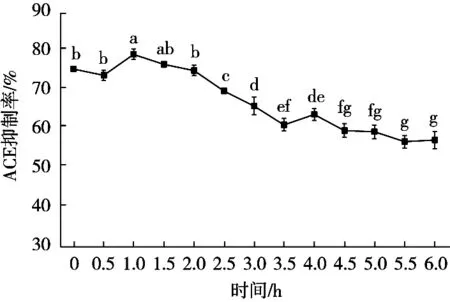
图6 体外模拟胃肠道消化酶系对大鲵肌肉ACE抑制肽抑制效果的影响
3 结论
试验通过单因素和混料设计试验优化大鲵ACE抑制肽的酶解参数。当三酶(风味蛋白酶、中性蛋白酶与菠萝蛋白酶)质量配比为0.54∶0.23∶0.23时,产物具有最高的ACE抑制率,IC50值为0.55 mg/mL。金属离子和体外模拟胃肠消化道酶系对产物ACE抑制率稳定性的影响的试验结果显示,Zn2+、Al3+、Fe2+离子能显著降低大鲵多肽的ACE抑制率,胃蛋白酶系对大鲵多肽的ACE抑制率影响较小,但胰蛋白酶系能显著降低ACE抑制率。

