集落刺激因子治疗终末期酒精性肝病的临床对照研究
周培 于淙 渠淑云
失代偿性酒精性肝病有很高的短期死亡率,Maddrey得分>32分、MELD积分>18分、Glasgow酒精性肝炎评分>8分、ABIC评分>9分均提示预后不良[1]。近些年研究发现,粒细胞集落刺激因子能够有效动员骨髓干细胞至受损肝细胞,促进肝干细胞的增殖和分化,G-CSF还可以通过调控肝脏内各种免疫细胞的能,起到免疫调控作用来改善终末期肝病的肝脏功能,降低其短期死亡率,如它可以使骨髓CD34+干细胞向肝内转移,达到修复受损肝细胞的目的[2]。最近研究表明G-CSF的应用能够改善慢加急性肝衰竭(ACLF)患者的生化学及组织学指标[3]。然而,另Spahr等对失代偿性酒精性肝病的研究表明G-CSF单用或联合骨髓干细胞移植的治疗均没能改善患者肝功能(P>0.05)[4]。因此,我们对G-CSF治疗失代偿性酒精性肝病的安全性及疗效做了相关临床研究。
资料与方法
一、临床资料
收集了2015年10月—2018年12月西藏民族大学附属医院、核工业二一五医院和威海市中心医院感染科住院诊治的36例酒精性肝病患者,所有患者符合酒精性肝病防治指南(2018更新版)诊断标准:①年龄在18~75岁,男女比36:0。②3个月内每天酒精摄取量>100 g/d。③Maddrey得分>32分。④签署了知情同意书的患者。排除标准:①恶性肿瘤患者或有门静脉血栓的患者。②严重的血液系统疾病的患者。③10 d内有糖皮质激素治疗的患者。④10 d内出现了肝肾综合征,3或4级肝性脑病或上消化道出血严重并发症患者。⑤合并其他感染:无法控制的细菌感染、HIV感染、HBV感染、HCV感染。⑥自身免疫性肝病或代谢性肝病。⑦妊娠或哺乳期妇女。⑧既往对G-CSF 过敏。⑨精神病患者或正在参加其他临床试验者。本临床研究通过了上述三家医院伦理委员会批准。按照上述标准本研究用数字表法随机分配到试验组和对照组,试验组18例,对照组18例。对照组给予综合治疗,试验组在综合治疗的同时给予G-CSF治疗。
二、治疗方法
对照组给予保肝、退黄、抗感染、营养支持、限盐等综合治疗(使用多烯磷脂酰胆碱、还原型谷胱甘肽、腺苷蛋氨酸、前列地尔、利尿、白蛋白、血浆等药物);试验组在内科综合治疗的基础上加用G-CSF(齐鲁制药有限公司 国药准号:S19990049)治疗,剂量为5 μg/kg,用法: 1次/12 h,皮下注射,连续7 d。2组治疗过程中均未进行人工肝治疗。
三、观察指标
记录治疗前后患者的一般情况、症状体征、药物副作用、生化指标、CD34+细胞计数、有无出现并发症及生存率等。入院时、治疗后第8 d、1个月、2个月及3个月分别对患者进行MDF、MELD评分并观察3个月生存率。
四、 统计学方法
结 果
一、肝功能和肝功能评分
1、治疗后第8 d试验组治疗前后对比:ALP升高,ALT、AST下降,Alb无明显变化;CD34+计数无明显变化;PT及INR无明显变化;MELD及MDF评分无明显变化。2、治疗后第8 d对照组治疗前后对比:ALP无明显变化,ALT、AST下降,Alb下降;PT及INR无明显变化;CD34+计数无明显变化;MELD及MDF评分无明显变化。3、试验组和对照组第8 d治疗后相比较:ALP无明显变化;ALT、AST下降;CD34+细胞计数下降;PT及INR无明显变化;MELD及MDF评分无明显变化。4、试验组对比对照组MDF及MELD评分在1、2、3个月均有显著降低(P<0.05)。见表1、表2。
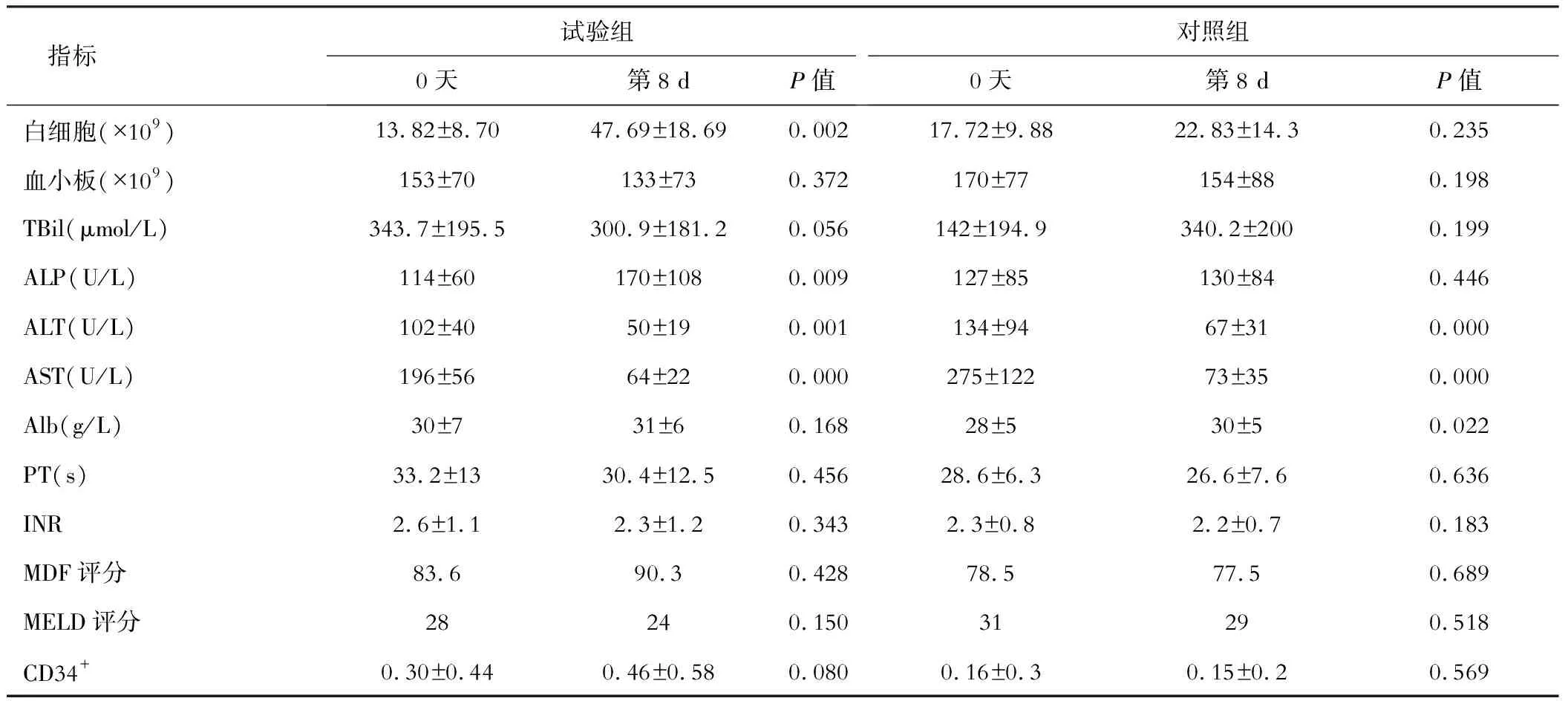
表1 试验组和对照组治疗前后对比

表2 试验组和对照组肝病评分对比
二、生存率和并发症
试验组和对照组90 d内死亡人数分别为3例和14例,试验组中,并发上消化道出血者死亡1例;并发自发性腹膜炎、败血症及肾功能衰竭者死亡1例;并发自发性腹膜炎,肺炎者死亡1例。对照组中,并发上消化道出血者、败血症和肝肾综合征死亡3例;并发肺部感染、败血症及肝肾综合征者死亡4例;并发泌尿系感染及肾功能衰竭者3例;并发败血症休克死亡者4例。用Kaplan-Meier法计算生存率,经log-rank检验,试验组和对照组生存率差异有统计学差异(χ2=14.995,P=0.000),90 d内试验组生存率显著高于对照组。
三、药物不良反应
试验组中耐受性均很好,未出现严重药物不良反应,2例(11.1%)患者出现骨痛,2例(11.1%)患者出现头痛,3例患者(16.6%)在用药后前3 d出现发热,未经处理后体温可自行恢复正常。治疗过程中并未有患者出现血小板减少,治疗7 d后未有患者出现脾大。虽然用G-CSF治疗后白细胞总数升高,但并未增加感染风险,也并没有增加抗菌素的应用率。
讨 论
本研究结果显示,在内科治疗的基础上加用G-CSF治疗能够提高患者生存率。有研究表明,糖皮质激素能够改善终末期酒精性肝病患者28 d的生存率,但对改善90 d及半年的生存率效果不佳[5]。目前对终末期酒精性肝病患者应用糖皮质激素治疗尚存争议,对于酒精性肝病终末期患者可能存在隐匿性感染和加重消化道出血等风险,故本研究内科治疗方案中并未采用糖皮质激素治疗[6]。虽有报道称己酮可可碱可以改善酒精性肝病的生化学指标,但有文献发现己酮可可碱在治疗慢加急肝衰竭患者中有71%的酒精性肝病患者死亡,本研究中患者MDF评分均数为86.3,并发症多,故本研究未应用己酮可可碱作为常规治疗[7]。虽有报道对终末期酒精性肝病肝移植治疗可改善患者生存率,但由于费用较高,供体缺乏,无其他脏器严重损害及移植前需戒酒等条件限定,故本研究患者中在短期内并没有采用肝移植治疗[8]。
2006年,Gaia等首次将G-CSF应用于终末期肝病患者并表示了其治疗的可行性[9]。Cho等[10]研究表明G-CSF能够改善终末期酒精性肝病患者生化指标和生存率,且安全性较好。有研究表明G-CSF能够提高患者CD34+细胞数(CD34+细胞选择性黏附于造血干细胞表面,随着细胞成熟而减少直至消失,计数增多表明造血干细胞数增多),降低C-X-C趋化因子受体4的表达,促使干细胞在肝细胞中增殖,改善患者肝功能[11]。多数研究也表明G-CSF能够促进骨髓干细胞定植与肝脏,促进肝卵圆细胞增殖,使得肝细胞再生,从而减轻肝脏损害,同时有免疫调节作用[12-13]。但Spahr等对终末期酒精性肝病患者给予G-CSF 治疗并未发现肝功能的改善,他们推测可能与患者继续摄入酒精和糖皮质激素治疗4周有关[14]。虽然有报道称G-CSF能够使患者中性粒细胞数升高,能提高患者抗感染能力,但本研究中,试验组和对照组感染例数接近,感染情况复杂,并不能断定G-CSF能提高患者抗感染能力[15]。研究报道G-CSF治疗的副作用,骨痛的发生率为62%~84%,但本研究骨痛发生者仅为2例患者,可能于G-CSF剂量低有关(5 μg/kg),国外常用剂量为12~20 μg·bg-1·d-1[16]。本研究在应用G-CSF过程中有3例患者出现低热,都在用药后前3 d,发热在给药后4~6 h内,持续数小时后不经处理可降至正常,考虑为药物热所致,但终末期肝病患者往往合并细菌感染,故需要进一步鉴别发热原因。
本研究表明,短期应用G-CSF治疗终末期酒精性肝病患者,能够很好改善其肝功能,提高生存率,安全性较高,但其长期安全性需要大样本长期随访来明确。