NOTCH2 基因突变致Hajdu-Cheney 综合征临床特征及随访并文献复习
吴燕明 王 丽 李 群 李 辛 胥雨菲 沈永年 王 剑 王秀敏
1.上海交通大学医学院附属上海儿童医学中心(上海 200127);2.上海市浦东新区人民医院(上海 201299);3.济宁医学院附属医院(山东济宁 272001)
Hajdu-Cheney综合征(Hajdu-Cheney syndrome,HCS,OMIM 102500)又称原发性骨发育不良伴肢端溶骨症。最早分别由1948 年Hajdu 及1965 年Cheney两位放射科医师进行了个案报道[1-2]。HCS 是一种罕见的常染色体显性遗传病,大多数病例呈散发性。其主要临床特点是进行性的局灶性骨质破坏,包括肢端骨溶解和全身骨质疏松。其他临床特点有身材矮小、颅面部异常、听力丧失、先天性心脏病和肾囊肿等[3-5]。HCS是由位于染色体1p12的NOTCH2基因外显子34杂合突变引起[5]。目前为止,国内报道的儿童和成人HCS不超过10例,大多仅限于临床表型的研究,罕见分子遗传学的诊断和分析,国内中文文献中未见儿童HCS基因诊断的研究和报道。本文报告1例HCS患儿的临床表型、影像学检查和基因检测结果,以提高临床医师的认识。
1 临床资料
患儿,男,11岁8月龄,汉族,江西上饶人,因“手指末端发育异常数年伴骨折1个月”于2018 年5月就诊于上海儿童医学中心内分泌遗传代谢科。患儿就诊前1 个月摔跤后出现胸椎压缩性骨折,在当地医院治疗效果不佳。患儿系G3P2,足月顺产,出生体质量4 300 g,出生身长50 cm,无窒息抢救史。15月龄会说话,18 月龄独走,智力无异常。出生后平均每年患肺炎1~2次,无其他疾病史,无手术史。患儿爷爷奶奶为近亲婚配,表兄妹关系;父母非近亲婚配,母孕期身体健康,其他家族成员无类似疾病。有一姐姐,16岁,身体健康。患儿听力无异常,沟通和社交能力均无异常。
体格检查:身高142.4 cm(P25),体质量33.6 kg,神志清,精神反应好,身材匀称,毛发浓密,颅缝未闭合,左侧颅骨软化;特殊面容,浓眉、眼距增宽、眼角下斜、鼻梁低平、鼻翼大、人中长。出牙24颗,牙齿无脱落,颈部粗短,胸廓无畸形,心肺腹未见异常,双侧腕关节和膝关节过伸,手指末端指节粗短,假性杵状指,双下肢及双足无畸形,神经系统检查未见异常。
实验室检查:血常规、尿常规、肝肾功能、电解质、血尿串联质谱、甲胎蛋白、癌胚抗原、β-HCG、外周血涂片、结核抗体检查等均无异常。甲状旁腺素(PTH)2.52 pmol/L,降钙素(CT) 13.8 pg/mL,25(OH)D318 ng/mL,血钙 2.25 mmol/L,血磷 1.65 mmol/ L。
影像学检查:左手正位片示骨龄与年龄相当,指骨末梢骨质溶解,末梢指变短;左足正侧位片示趾骨末梢骨质稍溶解,末梢趾无明显变短(图1A、1B)。左肘正侧位片示左侧肱骨远端骨质结构异常,左侧近端尺桡关节脱位(图1 C)。脊柱及骨盆正位示脊柱生理曲度存在,脊柱胸段侧弯,部分胸腰椎椎体中央略凹陷,骨质密度尚可,椎间隙未见明显狭窄,骨盆诸骨未见明显骨质异常(图1D)。头颅磁共振成像(MRI)示颅底凹陷,齿状突位置上移,小脑扁桃体位置下移(图2)。副鼻窦CT示未见鼻窦腔影,上颌骨骨折。彩色多普勒超声心动图、肝胆胰脾肾脏B超均未见异常。
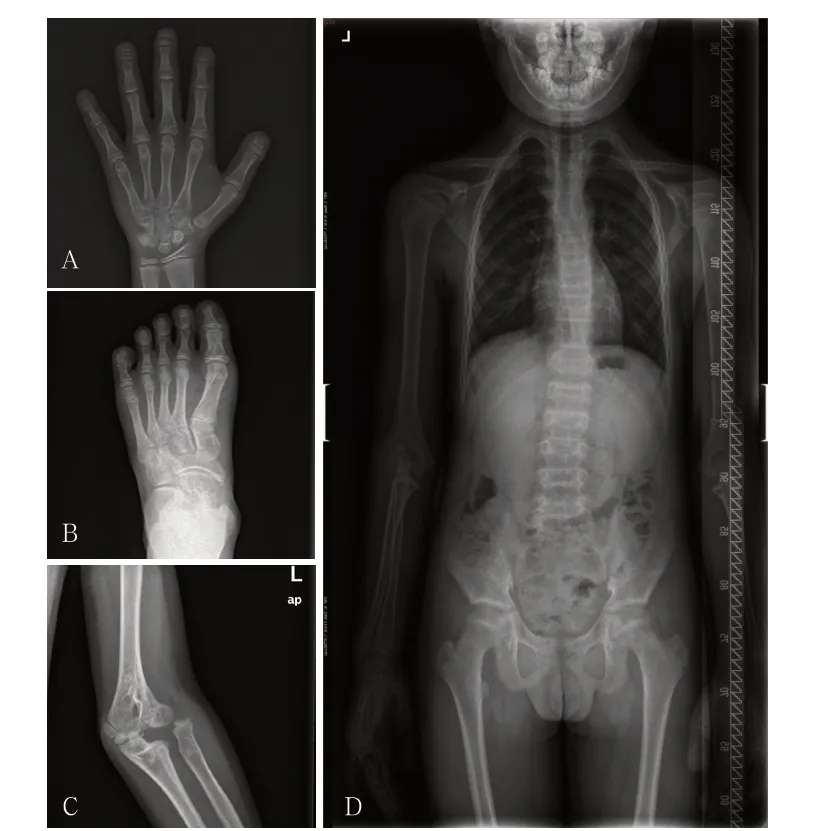
图1 患儿X 线表现

图2 患儿头颅MRI 表现
经医院医学伦理委员会批准,获得患儿家长知情同意后,抽取患儿及其父母静脉血各2 mL。用德国Qiagen公司的QIAamp Blood DNA Mini kit提取基因组DNA。经美国Covaris 公司M 220 超声打断仪处理后得到150~200 bp的基因组DNA片段,采用美国Aligent公司SureSelect Inherited Diseases Test(2742 genes)试剂盒建库、美国Illumina公司HiSeq 2500系统进行高通量测序。测序数据经Illumina Sequence Control Software(SCS)评估合格后,使用美国SoftGenetics公司的NextGENe®软件读取数据,数据上传至美国Ingenuity Systems公司的Ingenuity®Variant AnalysisTM软件进行生物信息分析。结果显示,患儿NOTCH2基因(NM_024408.3)存在c.6449_6450delCT,p.Pro 2150 Argfs*2 杂合变异(图3),其父母该位点均为正常基因型,提示该变异可能为“新生突变(de novo)”。明确诊断为HCS。

图3 患儿及家系NOTCH2 基因测序图
诊断明确后,予以口服维生素D 800 IU,qd;钙片600~1200 mg,qd;骨化三醇0.25 μg,bid;双磷酸盐(阿仑膦酸钠)10 mg,qd。半年随访一次,一年后患儿身高151.7 cm,体质量41 kg,一年身高增长9.3 cm,未再发生骨折;复查PTH 12.71 pmol/L,CT 33.8 pg/mL,25(OH)D316.38 ng/mL,血钙 2.42 mmol/L,血磷 1.87 mmol/L。治疗前后血钙水平处于正常范围内,25(OH)D3上升不明显。复查头颅MRI示颅底凹陷,齿状突位置上移,小脑扁桃体位置下移,与前片比较无明显变化。治疗前后骨骼无明显改变,肢端骨溶解未加重。
2 讨论
HCS是一种罕见的多系统疾病,特征为严重骨质疏松、肢端骨溶解、身材矮小、颅面部畸形、口腔畸形,听力丧失、先天性心脏病和肾囊肿等[3-6]。面部特征包括浓眉、内眦赘皮、轻微眼距增宽、眼角下斜、耳位低、人中长和脖子粗短[7]。颅骨发育畸形包括缝间骨、颅缝未闭和颅底凹陷。颅骨发育畸形可导致严重的神经并发症,引起呼吸骤停和猝死,是HCS患者过早死亡的重要原因[5,8]。口腔畸形包括腭裂、牙齿萌出延迟、下牙槽骨发育不良等[9]。HCS还可以出现脾肿大[10]。大约10%的患者存在肾脏异常,尤其是多囊肾[11]。在儿童时期很少能看到完整的临床表型,临床表现和影像学异常往往随着年龄增长而有所进展。HCS是一种进展缓慢的疾病,发病于儿童或青少年,在老年患者中预后不佳。椎体和长骨骨折是HCS患者发病的主要原因。本例患儿存在身材偏矮、面部畸形、颅底凹陷、手指肢端骨溶解、脊柱侧弯、骨折等表现,但未发现牙齿异常、心脏和肾脏异常,符合HCS临床特征。
基因技术的发展尤其是二代测序,揭示了HCS的遗传病因。HCS 是由位于染色体1 p 12 上的NOTCH 2基因变异引起。NOTCH 信号通路在细胞的分化过程中起着关键作用,特别是在骨形成和骨吸收的精确耦合过程中。NOTCH 信号家族有4 个受体(NOTCH 1、NOTCH2、NOTCH3和NOTCH4),5个经典配体称为Jagged (Jag)1和Jag2,以及Delta-like (Dll)1、Dll3和Dll4[12]。NOTCH受体、配体和细胞内改变NOTCH信号的因子的发生突变可引起某些遗传性疾病,其中多数影响到骨骼系统。体外研究表明NOTCH通路参与间充质干细胞向成骨细胞谱系的转化,从而刺激破骨细胞发生[11]。
NOTCH2基因突变导致HCS,编码跨膜蛋白,共包含34个外显子,在骨骼发育和骨重塑中具有重要作用。目前为止报道的导致HCS的NOTCH2基因变异都在末端34外显子中,并导致蛋白产物提前终止[4,13-14]。这些微小突变导致PEST结构域上游终止密码子的形成。PEST结构域由脯氨酸(P)、谷氨酸(E)、丝氨酸(S)、苏氨酸(T)组成,在正常功能下NOTCH2基因通过磷酸化介导其失活,失活失败会导致细胞内信号的活性增强。一项动物实验建立了一个敲除NOTCH2等位基因的小鼠模型,该等位基因缺乏PEST降解信号,引起成骨细胞中信号激活,导致Rankl表达增加、骨质减少,从而促进了破骨细胞的形成[15]。NOTCH2基因的其他区域的变异可能和2型Alagille综合征有关[16]。NOTCH1基因单倍剂量不足导致成骨细胞在主动脉瓣上异常分化和钙化[17-18]。NOTCH1外显子34的体细胞突变与T细胞急性淋巴细胞白血病有关[19]。侧脑膜膨出综合征,以颅面异常、脑膜膨出、矮小、肌张力低下、脊柱侧弯和骨质减少为特征,与HCS有表型重叠,临床上易误诊[20]。但其外显子测序显示NOTCH3基因的33外显子存在点突变或缺失。目前为止没有报道过与NOTCH4的相关的基因异常。
本研究中,患儿通过全外显子测序发现NOTCH2基因存在c.6449_6450 delCT,p.Pro 2150 Argfs*2 杂合变异,与2011 年Simpson 等[18]报道的位点一致。Crifasi等[21]描述1例患有HCS的8.5岁的男孩,临床表现为多囊肾、先天性心脏病、脑积水、脊髓积水空洞症、畸形足、脾肿大、脊柱异常和上气道梗阻。Sidor等[4]描述1 例9.5 岁的HCS 女孩,表现为颅面畸形、身材矮小、大头颅伴枕叶凹陷和小脑膨出、多囊肾和骨密度降低。不同HCS患者的症状和体征可能存在差异。HCS 的诊断可基于临床表现,结合X 线检查和基因检测而得以明确。肢端骨溶解和缝间骨并不是诊断HCS所特有的临床表现,其他的遗传性疾病或后天获得性疾病也可能存在这些表现。例如,成骨不全患儿可见缝间骨;成骨不全、重度银屑病、系统性硬化症患者均可出现肢端骨溶解的表现[22],临床上需注意鉴别诊断。
HCS通常在老年患者中预后较差,主要是骨质疏松导致的严重骨骼并发症需要进行骨科手术。既往研究表明,双膦酸盐在预防和治疗骨质疏松症方面,随着年龄的增长治疗效果越差[23-24]。HCS患儿的骨组织特征是骨吸收增加,骨皮质缺损,伴或不伴有骨小梁形成增加[25]。双磷酸盐治疗增加了骨皮质的厚度和密度,表明抗再吸收治疗是有效果的[26]。双膦酸盐治疗能使脊柱骨密度得到改善,但不能阻止肢端骨溶解,具体的机制并不十分明确[5]。双磷酸盐对于生长中的骨骼治疗是有效的,可以减少松质骨的吸收从而增加骨小梁密度,并抑制长骨中骨内膜的吸收,增加骨皮质厚度[4]。在HCS患者中,双磷酸盐治疗对骨密度的改善在15岁以后变得效果很差[5]。目前还没有足够的数据来评价双磷酸盐是否可以降低骨折率或预防颅底凹陷的进展和牙骨质丢失。国外文献报道的HCS,双磷酸盐的治疗剂量通常是35~70 mg/周[5,26]。以上研究结果为双磷酸盐治疗HCS 儿童的有效性提供了很好的证据,但需要进一步的研究来指导治疗剂量和疗程。

