干细胞技术在哺乳动物同性生殖中的应用
李雯敏,安建平,程 枣,袁毅君*
(1.天水师范学院 生物工程与技术学院,甘肃 天水 741001;2.无锡儒德科技发展有限公司,江苏 无锡 214100)
亿万生灵,其形各异,其貌必殊,生殖方式不尽相同,最常见的两种方式是无性生殖和有性生殖。当然,自然界存在的生殖方式并不仅限于这两种。人类对生殖奥秘的深入研究、发现与创造也不止于此。同性生殖概念由于与无性生殖及有性生殖概念皆有交叉,归属问题较为复杂。所以,它在生物繁殖方式的多样性中属于一种陌生且极具争议性的方式。
在脊椎动物中,自然发生的单性生殖方式仅限于低等动物而不存在于哺乳动物中。哺乳动物的单性生殖受印记基因的影响。[1-2]生命科学发展至今,还没有发现在自然条件下能够进行孤雌/孤雄生殖的哺乳类动物的存在。随着科研人员的不断尝试探究,通过人工手段,已经实现了哺乳类动物的人工孤雌/孤雄生殖,[3]人工孤雌/孤雄生殖不仅限于实现哺乳动物的单性生殖,甚至跨向哺乳动物同性向双亲生殖的实现。
1 同性生殖及其研究意义
1.1 同性生殖的概念
同性生殖是同性别亲本提供同性生殖细胞,通过人工手段进行细胞融合并进一步培养发育成新个体,且新个体的基因来源是双父源或双母源的一种生殖方式。同性生殖的方式有孤雌生殖和孤雄生殖。
单性生殖是不进行完整受精作用的生殖细胞(配子),直接发育生成新个体的生殖方式。[4]比如植物的无融合生殖、蜜蜂的单倍单性生殖、蚜虫的二倍单性生殖等。其中更为典型的还有雌性鲨鱼、雌性科莫多巨蜥、哀鳞趾虎、新墨西哥鞭尾蜥、火鸡、小龙虾等动物,[5]雌性个体直接通过生殖细胞的遗传物质的复制加倍,再发育产生自体克隆的新个体,以快速完成种族延续任务,应对物种面临艰难处境或者种群密度过低,进而维持一定的种群数量。而有性生殖是指有性生殖细胞(配子),经过两性生殖细胞的结合(如卵细胞和精子结合成合子)并发育成新个体的过程。
在单性生殖中强调的是只产生生殖细胞一方的性状而不具有亲本双方的性状,在有性生殖中强调的是经过两性生殖细胞的结合。同性生殖区别于单性生殖以及有性生殖的是,它是由非两性生殖细胞结合(双雌或双雄),产生的后代具有亲本双方性状。
1.2 同性生殖的研究意义
两性动物可以通过单性生殖产生无性克隆动物,以此更加便捷地增加子代数目,延续种族遗传,但这种生殖方式由于遗传基因的单一性并不利于种族基因多样性的发展。而同性生殖由于其后代具备亲本双方的遗传物质,符合基因杂交的条件,能够保持基因多样性的优势。
同性生殖的生殖方式颠覆了“生命起始于受精卵”的传统观念,挣脱了高等动物只能两性繁衍的束缚。哺乳动物小鼠同性生殖的创造意味着未来人类实现无性别生育的可能,加上人们对人造子宫呼之欲出的向往,未来人类生育方式的改变将不可避免,这也是人类社会急于解脱女性母亲角色的一种象征。同性生殖研究涉及的印记基因研究对理解基因组印记的进化、调控和功能具有重要意义,[6]为遗传疾病的研究指引了一个较为清晰的拓展方向,未来必将在遗传学研究史上增添浓墨重彩的一笔。
2 干细胞技术与同性生殖之间的发展关系
2.1 干细胞技术是人工孤雌与孤雄生殖技术发展的基石
同性生殖概念出现以前,干细胞技术在人工孤雌与孤雄生殖中的探索与应用是其得以发展的基石。而干细胞技术在孤雌生殖与孤雄生殖的应用主要体现在干细胞获取源的探索上。两性生殖产生的胚胎是人类干细胞的主要获取源,但通过正常胚胎获取胚胎干细胞在很多国家和地区为社会道德和人类伦理所不容。通过孤雌生殖得到的胚胎干细胞,遗传物质仅有母系一方,[7]属于克隆胚胎干细胞产物,可以一定程度避免道德制约。孤雌生殖创造出的胚胎干细胞同样具有多能性,[8]可以作为临床需求的胚胎干细胞供给来源。
孤雌/孤雄生殖还通过干细胞技术产生无性克隆动物。将孤雌激活出现双原核的小鼠卵细胞进行体外培养并移植到假孕的雌鼠体内,可以生育出孤雌克隆小鼠。[9]将牛的两个精子同注入去核的卵细胞中,进一步促进它融合和胚胎发育,可以获得牛精子的克隆胚胎。[10]
2.2 小鼠、非人灵长类和人的单倍体胚胎干细胞系的建立
同性生殖研究最早应从孤雌生殖研究开始。二十世纪三十年代,科学家们通过动物卵的激活和孤雌早期胚胎相互嵌合的方法实现了可存活的孤雌牛胚胎的创造。[11]1981年Evans和Kaufman[12]从小鼠囊胚内细胞团中分离建立了人类历史上第一株胚胎干细胞,并在第一时间尝试从孤雌单倍体胚胎中建立单倍体胚胎干细胞系。[13]但直到2011年才由英国科学家Leeb和Wutz[8]和奥地利科学家El-ling等人[14]通过引入流式细胞分选技术才真正解决维持细胞单倍体性的问题。逐步建立了小鼠、[15]大鼠、[16]非人灵长类[17]和人[18]的单倍体胚胎干细胞系。
2012年诺贝尔生理学与医学奖由英国生物学家格登和日本科学家山中伸弥共同获得,他们通过细胞重编程获得诱导多能干细胞。[19]诱导多能干细胞的研究意义重大,它意味着利用体细胞可以制造可受精的卵细胞,这是生殖细胞缺陷造成不孕人群的福音。除此之外,他还大胆地提出,雄性个体体细胞可以用来创造卵子,雌性个体的体细胞也可以生成精子。2014年12月英国剑桥大学AzimSurani团队和以色列魏茨曼科学研究所Jacob Hanna团队合作,率先成功诱导了多能干细胞转化原始生殖细胞的相关实验。[20]
实现诱导多能干细胞转化原始生殖细胞在一方面也启发人们:孤雌生殖和孤雄生殖将不再局限于单性细胞融合,而向双母源或双父源同性细胞融合方向发展,其中单倍体胚胎干细胞系的建立发挥了重要作用。
2.3 基因组印记的存在
二十世纪六十年代,生物学家海伦·克鲁斯(Helen Crouse)首先提出“基因组印记”。基因组印记又称印记基因,是指来自父系和母系染色体上的等位基因通过生殖细胞结合传递给子代时发生DNA甲基化修饰,这种修饰使两方等位基因出现一边表达而另一边不表达的情况。[1]哺乳动物同性生殖细胞融合时,印记基因甲基化必会出现紊乱。哺乳动物胚胎的生长发育受多种印记基因调控,如果出现功能异常会导致胚胎的发育受限,最后能够存活的个体也会在之后的生长发育中逐渐出现各种遗传疾病,以及表现一些与正常个体有异的性状。因此,印记基因保证只有来自精子和卵子的二倍体合子胚才能正常发育,而仅来自雌核或雄核的二倍体胚胎则在发育中夭亡。
1991年后,科学家们几乎在同一时期发现了三个对胚胎发育有重要影响印记基因:Igf2、Igf2r和H19。[2]Igf2是仅表达父本的内源性印记基因,H19为母源性表达。印记基因的存在将是实现同性生殖的最大障碍。
3 干细胞技术在哺乳动物同性生殖研究中的应用
3.1 干细胞技术在孤雌生殖中的应用
日本的Kono Tomohiro在制造“辉夜姬”前就曾对克隆技术深有研究,并通过摸索出一套“雄性化”小鼠卵子的方法试图破除印记基因对同性生殖细胞融合的阻碍。他发现,两性基因印记的成熟是一个伴随整个个体性成熟的过程,动物在刚生育出来时卵子不能随意结合,但生殖细胞正处于一个接近“性别中性”的状态。于是他敲掉了未成熟卵子基因组中的H19差异甲基化结构域以及调剂蛋白结合位点,[21]培育出了一只雄性基因显著表达的幼鼠。他从这只幼鼠的卵巢中取出还没有发育成熟的卵子A,用去核的正常小鼠卵子B将卵子A“催熟”,小鼠卵子A将会表现出类似雄性印记基因的性状。最后将卵子A和正常的卵子C融合,植入母鼠体内培育。2004年,一只名叫“辉夜姬”的孤雌小鼠在东京农业大学的一个研究团队中诞生,第一次得到了可以存活的双母源小鼠。[16]这是科学家第一次实现破除印记基因对同性生殖创造生命的限制。不过“辉夜姬”生长迟缓且体型要比普通小鼠小很多,并且这项技术缺乏实用性,难以推广应用。
中国科学院动物研究所的周琪院士、胡宝洋研究员及李伟研究员等人在建立单倍体胚胎干细胞时,尝试将孤雌单倍体胚胎干细胞删除与Kono实验室相同的H19和Igf2两个印记区段,并注射进MII期的卵母细胞,获得了同样存活但呈“智障”状态的双母源小鼠,他们研究得出单倍体胚胎干细胞同样具有和原始生殖细胞类似的印记区“无印记”模式。在进行孤雌单倍体干细胞融合发育时,印记基因的甲基化过程同样会被重新修正。他们继续进行印记基因对孤雌生殖小鼠的影响研究,并通过筛选比对发现一个在孤雌小鼠体内表达明显和正常小鼠存在异常的印记区基因——Rasgrf1。[22]于是尝试在孤雌单倍体干细胞中同时删除包括Rasgrf1、Igf2、H19在内的三个印记区段,再进行细胞融合及培育,获得了世上首批在生长发育和繁殖上和正常小鼠无异的双母源小鼠。
3.2 干细胞技术在孤雄生殖中的应用
2012年,中国科学院的周琪院士、胡宝洋研究员及李伟研究员等人通过单精子注射入去核卵子的方法,构建出只有正常染色体数量一半的小鼠胚胎干细胞。并在随后一年,利用未受精的卵子构建出孤雌单倍体胚胎干细胞。2015年,他们试着将单倍体胚胎干细胞注射到小鼠卵母细胞中,培育出双母源小鼠。[17]接着又进行了双父源同性生殖的研究,继续利用单倍体胚胎干细胞的特殊性质进行了孤雄小鼠的创造,实验同样获得了成功。
他们发现,孤雄单倍体胚胎干细胞具有同孤雌单倍体干细胞一样的“无印记”模式,这就意味着双父源小鼠也能通过单倍体胚胎干细胞而被创造。在创造孤雄生殖小鼠的过程中,基因印记的筛选敲除依然是实现最终结果最大的障碍。在没有技术指引的情况下,他们首先尝试着敲除掉印记基因中那些和疾病关系最密切的基因。最后他们将一个孤雄单倍体干细胞敲除了包括Gnas、Nespas、Grb10、Igf2r、Snrpn、Kcnq1、Peg3在内的7个印记区段,并与另一个精子共同注射到去核的卵母细胞中继续培育,[22]终于获得了人类历史上首只外观正常且可自主呼吸的双父源小鼠,代表哺乳动物实现同性生殖孤雄方向的首个成功案例,实验流程见图1。但是这只珍稀的小鼠在出生后48h即死亡,故基因印记对实现哺乳动物双父源孤雄生殖还存在很大的挑战。
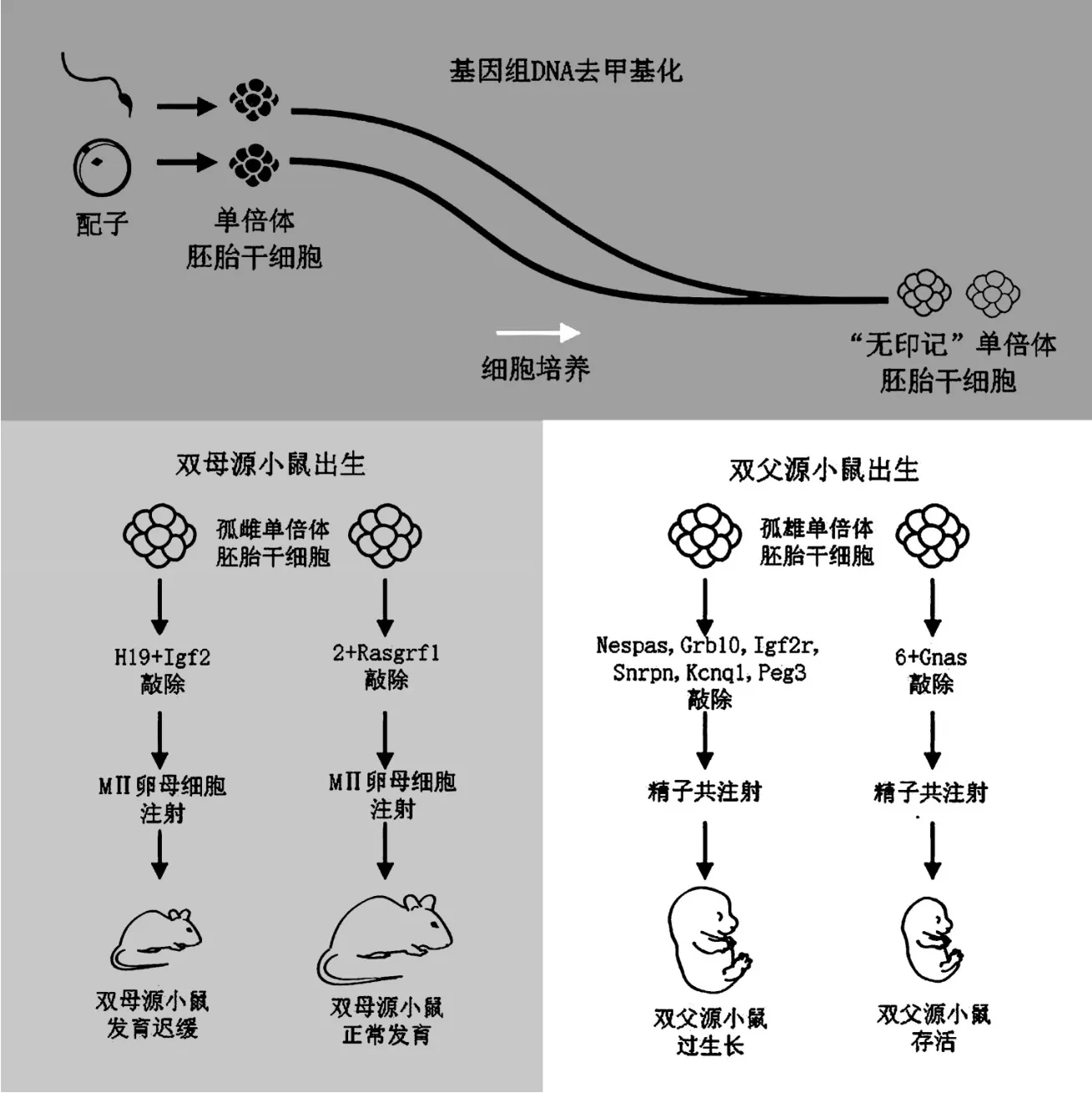
图1 双母源小鼠及双父源小鼠实验流程图[22]
4 展望
印记基因阻碍同性生殖的发生,维系哺乳类种族遗传的杂交多样性。截至2018年12月科学家研究发现的人类印记基因共228个,其中63个与小鼠的相同,[3]有很多与人类疾病相关,包括精神类疾病(某些自闭症)、代谢类疾病(BWS综合征等),生长发育异常(小胖威利综合征等)等。[23]目前,产生健康的双母源小鼠成功率为10%-20%,而实现双父源小鼠只有2%的成功率,且双父源小鼠为患病小鼠。因此实现同性生殖依然在破除印记基因的阻碍上存在巨大挑战。
破解印记基因中更多与遗传疾病相关的信息,并实现更完善的印记修饰技术,进而开发新的动物生殖手段,干细胞技术发挥了巨大的作用,同性生殖研究在未来会有更值得期待的成就。

