浓香型白酒低产杂醇油酵母菌的筛选及特性研究
袁华伟 ,王 鑫,王 连,邓婺远,刘光钱,喻学淳,沈才洪,王松涛
(1.宜宾学院生命科学与食品工程学院,四川宜宾 644000;2.固态发酵资源利用四川省重点实验室,四川宜宾 644000;3.泸州老窖股份有限公司,四川泸州 646000;4.国家固态酿造工程技术研究中心,四川泸州 646000)
杂醇油是含有3 个以上碳原子的一元醇类物质的总称,在白酒中含量较大,也是最重要的三大芳香组分(脂肪族酸类、脂肪族酯类、高级醇类)之一[1]。浓香型白酒中杂醇油的主要成分为异戊醇、异丁醇、正丙醇和正丁醇等,尤其以异戊醇、异丁醇较为突出[2]。适宜的杂醇油含量及适当比例可使酒体丰满圆润,口感柔和协调;但杂醇油在人体内氧化速度较乙醇慢,停留时间长,含量过高时,不仅会带来异杂味,还会使消费者饮后引起头痛、头晕、神经系统充血等症状,对人体有一定的毒害作用[3-4]。因此,国家标准规定白酒中杂醇油(以异戊醇、异丁醇计)的含量≤0.20 mg/100 mL。
杂醇油是白酒酿造过程中酵母发酵正常代谢的副产物,主要有两种生成途径。一种是酵母以氨基酸为基质的降解代谢途径,一种是酵母以糖为基质的合成代谢途径[5-7]。传统酿酒生产过程中存在杂醇油含量普遍偏高的问题已经引起了业界的广泛关注。因此,为降低杂醇油含量,使其控制在合适的范围内,生产工艺上已采取了种种措施,如采用低温发酵技术等,但其工艺复杂,生产成本高[8]。通过诱变选育及离子注入技术来选育氨基酸缺陷型的酿酒酵母,阻止其Ehrlieh 代谢途径,从而获得低产杂醇油的酒精酵母菌株[9-13]。但在酿造工业中存在回复突变等问题,生产上存在风险,只有选育低产杂醇油且高产乙醇的酵母菌进行发酵才能从根本上解决问题[14]。
浓香型白酒独特的生产工艺造就了大曲和糟醅中特殊的微生物区系,富含具有工业价值的微生物资源。筛选大曲和糟醅中的功能微生物以及进行相关应用的研究正成为热点[15-16]。本文首先通过TTC 培养基、乳酸培养基筛选低产杂醇油、高产乙醇的酵母菌株,对所选菌株进行鉴定,然后评价所选菌株的性能。使该菌株能够应用于传统白酒酿造生产,降低杂醇油含量,从而提高白酒品质。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 材料、试剂
大曲和糟醅样品采集自泸州浓香型白酒生产企业的酿酒车间,多点采样后混合均匀。酿酒酵母购自市场上常用于白酒生产的酵母菌。
试剂及耗材:蛋白胨,酵母膏,琼脂粉均为生化试剂,北京奥博星生物有限公司;异戊醇、异丁醇、正丙醇、乙酸乙酯等色谱分析用标准品均为色谱纯,天津光复精细化工研究所;PCR 所用试剂购自上海生工生物工程公司;其他试剂均为分析纯,成都科龙化工试剂厂。
1.1.2 培养基
富集培养基:YPD 液体培养基。121 ℃灭菌15 min,冷却到50 ℃按1 U/mL加入青霉素。
平板分离培养基:蛋白胨20 g/L,酵母粉10 g/L,葡萄糖20 g/L,琼脂15~20 g/L,121 ℃灭菌15 min。
初筛培养基:TTC 培养基,TTC 0.1 g/L,乳酸5 g/L,琼脂15 g/L,pH 6.0。乳酸培养基,乳酸40 g/L,硫酸铵5 g/L,磷酸二氢钾1 g/L,氯化钠0.1 g/L,硫酸镁0.5 g/L,氯化钙0.1 g/L,酵母膏0.2 g/L,琼脂15 g/L,pH6.0。
复筛培养基:高粱汁培养基,高粱粉碎后按高粱∶水=1∶4的比例混匀后,90 ℃水浴下糊化90 min,冷却到60 ℃,加入糖化酶,糖化2~3 h,煮沸5 min,双层纱布过滤,加水调糖度为15 °Bx,121 ℃灭菌15 min。
1.1.3 仪器设备
SW-CJ-2FD 型超净工作台,苏州合飞净化设备有限公司;SPX-250-Ⅱ型生化培养箱,上海跃进医疗器械有限公司;T6 型紫外可见分光光度计,北京普析通用仪器有限责任公司;RX40 型密度折光仪,梅特勒-托利多上海有限公司;Power Pac Basic型电泳仪,美国Bio-Rad 公司;Gel Doc XR 型凝胶成像仪,美国Bio-Rad 公司;7890A 型气相色谱仪(配LZP-930 白酒分析专用柱,30 m×320µm×1 µm,Analytical Technology,兰州化学物理研究所),美国安捷伦科技有限公司。
1.2 试验方法
1.2.1 酵母菌的分离与纯化
将大曲、糟醅样品置于富集培养基中,于28 ℃的恒温培养箱中增殖培养48 h。用玻璃珠振荡打散后,取合适梯度涂布于平板分离培养基上,28 ℃培养。
待菌落长大后在平板上层注入TTC培养基,暗培养2~3 h,挑选深红色的菌株,转接到乳酸培养基中,28 ℃培养3~5 d。挑选菌落较大的作为初筛菌株。
1.2.2 低产杂醇油酵母菌的筛选
初筛菌株活化后接入YPD 培养基中增殖,使活菌浓度达到108个/mL,然后取5 mL 接入装有500 mL 高粱汁的锥形瓶中,28 ℃培养72 h 后测定发酵液的乙醇、异戊醇、异丁醇含量。选择产杂醇油低、产酒能力强的酵母菌株为目标菌株。
1.2.3 酵母菌株鉴定
菌落及菌体形态观察:筛选出的酵母菌株,划线于分离培养基琼脂平板上,于28 ℃下厌氧培养48~72 h,观察菌落形态;用光学显微镜观察个体形态。
菌种16Sr DNA 鉴定:离心收集液体培养至对数生长期的酵母菌体,采用Bacterial DNA Kit 试剂盒提取总DNA。提取得到的总DNA 采用0.6 %琼脂糖凝胶电泳检测其纯度。采用酵母通用引物NLl(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTT CAAGACGG-3')对总DNA 进行PCR 扩增,送至上海生工公司进行测序。将测序得到的26S rDNA D1/D2序列在eztaxon上进行BLAST 比对,比较分离菌株与已知酵母菌相应序列的相似程度,与Gen Bank 数据库做相似性分析。
1.2.4 酵母菌的性能检测
以波长600 nm 处测定酵母菌发酵液的OD 值来研究酵母菌的生长性能[17]。
耐温性实验:将酵母菌接种到YPD 液体培养基中,分别置于15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃的恒温培养箱中培养24 h,测定发酵液的OD值,研究酵母菌的最适生长温度。
耐酸性实验:将酵母菌接种在起始pH 值分别为3.0、3.5、4、4.5、5、5.5、6、6.5、7、7.5的YPD液体培养基中,于最适温度下培养24 h,测定发酵液的OD值,研究酵母菌的最适生长pH值。
耐糖性实验:将酵母菌接种在蔗糖、葡萄糖浓度分别为10 %、15 %、20 %、25 %、30 %、35 %的YPD 液体培养基中,于最适温度下培养24 h,测定发酵液的OD值,研究酵母菌的耐糖性。
耐酒精实验:将酵母菌接种到乙醇含量分别为8 %vol、10 %vol、12 %vol、14 %vol、16 %vol、18 %vol、20 %vol 的YPD 液体培养基中,于最适温度下培养24 h,测定发酵液的OD值,研究酵母菌的耐酒精程度。
生长曲线:把酵母菌接种于YPD 液体培养基中,于最适温度和pH 值下培养,每隔2 h 在波长600 nm处测一次发酵液的OD值。
1.2.5 高粱汁发酵
将所筛选的酵母菌用于高粱汁发酵,以酿酒酵母菌为对照组,发酵7 d,检测杂醇油、乙醇及其他香气成分的含量。
1.2.6 乙醇、杂醇油及其他香气成分分析
取发酵液样品,经减压蒸馏后取馏出液,过0.2 μm 微孔滤膜,分析乙醇、杂醇油及其他香气成分的含量。
乙醇含量的测定:采用密度折光仪分析。
杂醇油及其他香气成分的测定:用气相色谱分析,汽化温度:220 ℃;检测器温度:230 ℃;柱温:35 ℃;升温程序:初始温度为50 ℃,保持6 min 后,以4 ℃/min 升温至170 ℃,保持3 min,以40 ℃/min升至220 ℃,保持2 min;进样量:0.4µL。
2 结果与分析
2.1 酵母菌的分离纯化和筛选
通过平板分离培养基分离纯化,从大曲中筛选了57 株酵母菌;第二步用TTC 培养基和乳酸培养基进行初筛,筛选了18 株酵母菌。利用TTC 培养基是为了筛选高产乙醇的酵母菌,因为只有选育高产乙醇及低产杂醇油的酵母菌才有实际意义。由于杂醇油的生成与乳酸的代谢途径正好相反,因此通过乳酸培养基从大曲中筛选低产杂醇油的酵母菌[10]。
对初筛的18 株酵母菌进行高粱汁发酵,发酵液的乙醇含量、异戊醇、异丁醇等杂醇油含量如表1所示。从表1可知,所筛选的酵母菌中LJ-07、LJ-15、LJ-18 产酒能力较好,但产杂醇油含量较高;LJ-07、LJ-10、LJ-16、LJ-17 酵母菌产杂醇油含量低,但是产酒能力较差;相对而言,LJ-07 酵母菌产杂醇油较低且产酒能力较好。后续使用LJ-07 酵母菌进行试验。
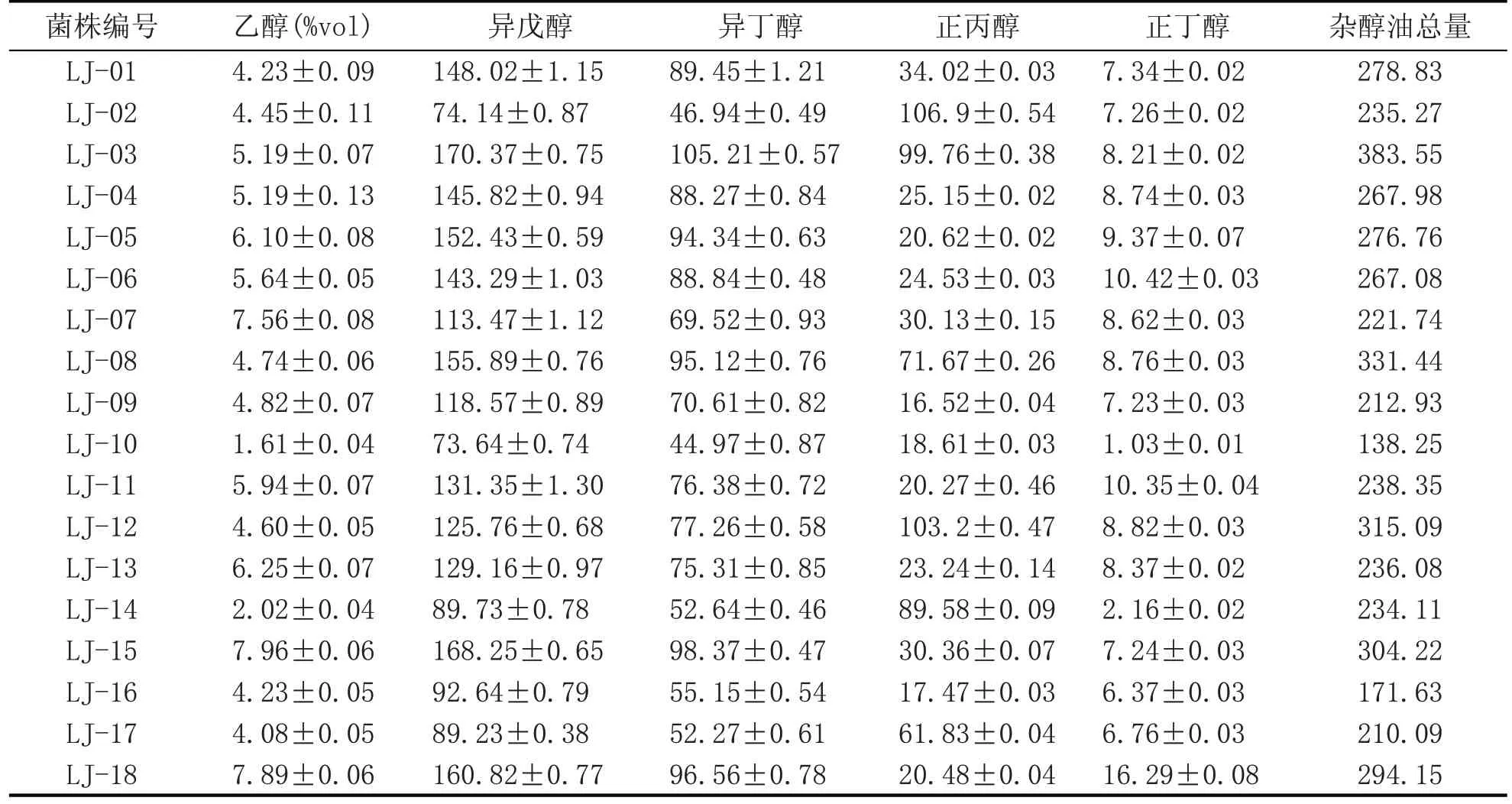
表1 发酵液杂醇油、乙醇含量 (mg/L)
2.2 酵母菌株鉴定
2.2.1 菌落及细胞形态观察
酵母菌株LJ-07 经进一步纯化后,进行菌落特征和个体形态观察。在YPD 琼脂培养基上的菌落特征和显微镜下观察的个体形态如图1 所示。图1中(A)是在平板上生长的LJ-07 酵母菌,菌落易用针挑起,大而厚,质地均匀,表面湿润光滑、不透明、黏稠,颜色单调,呈乳白色,正反面及中央与边缘颜色一致,有不规则的毛状物。图1 中(B)是在400倍显微镜下观察到的LJ-07 酵母菌,球形、卵圆形、椭圆形,无鞭毛。
2.2.2 酵母菌株26Sr DNA基因序列测定结果
酵母菌株LJ-07 的26Sr DNA 核苷酸测序结果在NCBI 使用BLASTN 比对初步确定为酿酒酵母,从GenBank 数据库中获得有关种的公认标准序列数据,使用ClustalX 1.8 对齐后使用MEGA 2.1 计算序列相似性并作系统发育分析,结果见图2。系统发育树中筛选出的酵母菌株与Saccharomyces cerevisiae属同一分枝,确定筛选出的酵母菌株为Saccharomyces cerevisiae,暂命名为酵母菌LJ-07。
2.3 酵母菌的性能测定(图3)
酵母菌株LJ-07 在不同条件下的生长情况如图3 所示,乙醇浓度、pH 值对酵母菌生长的影响较大,温度、糖浓度对酵母菌生长的影响相对较小。以下对图3中4种影响因素结果进行分析。
2.3.1 温度对酵母菌生长的影响
温度对酵母菌的生长非常重要,温度过高过低都会抑制酵母菌的生长,甚至会使其失活,同时,酵母菌的最适生长温度范围对酒类发酵至关重要。温度对酵母菌生长的影响如图3(A)所示,温度在30 ℃以下时随着温度的升高,酵母菌的生长随温度的上升呈上升趋势;温度在30 ℃之上时,酵母菌的生长随温度的上升呈下降趋势;温度在25~35 ℃时,酵母菌生长较好,因此,其最适生长温度为25~35 ℃。
2.3.2 pH值对酵母菌生长的影响
pH 值过高或过低都会影响酵母菌的生长和代谢产物的生成,甚至会使酵母菌失活。如图3(B)所示,pH6~7 时,酵母菌生长良好,pH6.5 时,酵母菌的OD值最大,为酵母菌的最适pH值。
2.3.3 糖浓度对酵母菌生长的影响
葡萄糖和蔗糖浓度对酵母菌生长的影响如图3(C)所示,酵母菌在葡萄糖浓度10%时,菌体浓度最大,生长繁殖最为迅速;酵母菌在蔗糖含量为10%和25%时菌体浓度都较大。葡萄糖和蔗糖的浓度达到35%时,酵母菌都能够生长,表明酵母菌具有一定的耐糖能力。
2.3.4 乙醇浓度对酵母菌生长的影响
乙醇浓度对酵母菌生长的影响如图3(D)所示,乙醇浓度越高,酵母菌的生长越弱,当乙醇含量为8%vol~14%vol 时,酵母菌生长情况较稳定;乙醇含量为16 %vol~18 %vol 时,酵母菌生长缓慢;乙醇含量为20%vol 时,酵母菌基本不生长。过高的乙醇含量对酵母菌种具有毒害作用,乙醇发酵时要求所用的酵母菌具有一定的耐乙醇的能力,酒类发酵生产中乙醇含量大多数在14%vol 以下,所筛选的酵母菌能满足生长的需要。
2.3.5 酵母菌的生长曲线(图4)
所筛选的酵母菌在最适生长温度和最适生长pH 值下进行生长曲线测定,其结果如图4 所示,在0~4 h 为生长延滞期,6~18 h 为对数生长期,18 h以后处于生长相对稳定期,20 h 后菌体浓度略有降低。
2.4 高粱汁发酵
用筛选的LJ-07 酵母菌进行高粱汁发酵,以酿酒酵母为对照组,发酵液杂醇油、乙醇及其他香气成分的含量如表2 所示。LJ-07 号酵母菌产杂醇油的量为233.61 mg/L,比酿酒酵母降低了23.53 %;而对乙醇生成能力影响不大,对其他香气成分的生成量也几乎没有影响。
3 结论
从泸州老窖浓香型白酒酿造大曲和糟醅中筛选出1 株低产杂醇油、高产乙醇的酵母菌LJ-07。对该株酵母菌进行26S rDNA 基因序列分析,确定其为Saccharomyces cerevisiae,该菌株对温度、酸度、糖度及乙醇的耐受性能好,最适温度的范围为25~30 ℃,最适pH值为6.5,且耐糖、耐乙醇性能较好。与常用的酿酒酵母相比,酵母菌LJ-07 的杂醇油产量降低了23.53%,而产乙醇的能力持平,该菌可应用于浓香型白酒等传统酿酒工业,以降低白酒的杂醇油含量。
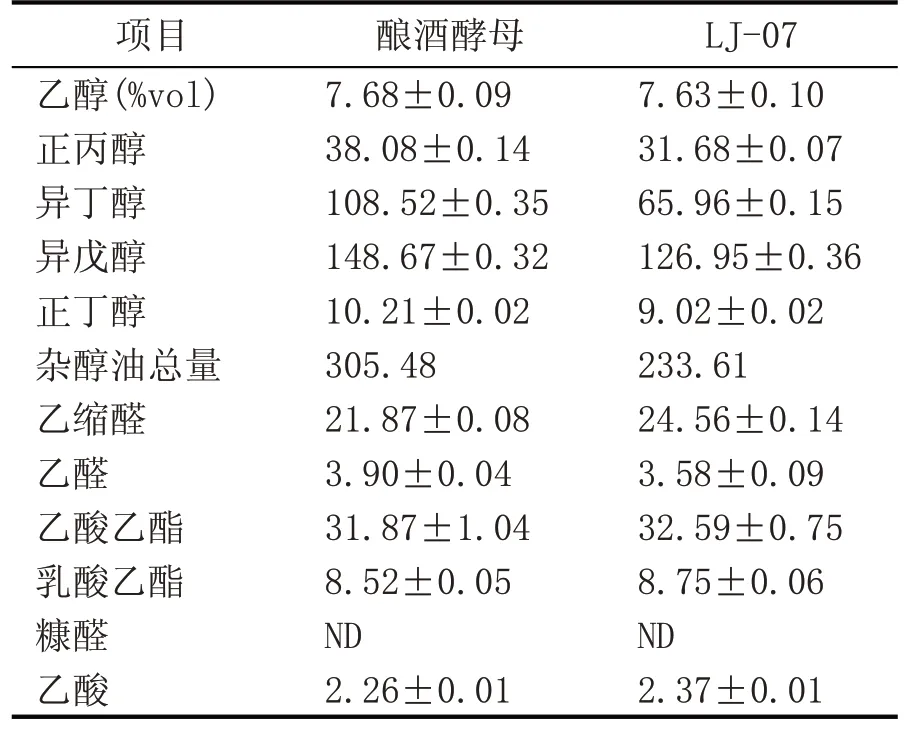
表2 发酵高粱汁乙醇、杂醇油等香气成分含量(mg/L)

