荧光PCR熔解曲线法检测结核分枝杆菌耐药性的临床价值评估
包晶晶,宋怡蒙,贺文从,刘春法,刘东鑫,赵雁林,高 飞
(1.内蒙古医科大学 研究生学院,内蒙古 呼和浩特 010000;2.北京医院,北京 100000;3.中国疾病预防控制中心,北京 100000;4.内蒙古自治区第四医院,内蒙古 呼和浩特 010000)
结核病(Tuberculosis,简称TB)是一种古老且可以广泛传播的慢性传染性疾病.根据世界卫生组织(World Health Organization,WHO)发布的数据显示2017年在全球范围内有1 000万(范围:900~1 110万)新发结核病患者,每天约有4 500人死于结核病[1].结核病已成为全球重点关注的公共健康问题之一.近年来随着人类免疫缺陷病毒(human immunodeficiency virus,HIV)的感染、吸烟、糖尿病、不良生活习惯、依从性差等原因的出现,导致耐多药结核病(multidrug resistant tuberculosis,MDR-TB)的流行与传播日益加重,严重影响了结核病防控规划的实施[2].耐多药结核病(MDR-TB)是指至少对异烟肼(INH)和利福平(RIF)这两个最强有力的抗结核药物产生耐药.这些耐药分离株的传播在很大程度上造成难以控制的结核病流行.2018年全球新增50万利福平耐药结核病病例,其中78%为耐多药结核病,中国已成为全球耐药结核病负担最大的三个国家之一[3].耐多药结核病通常需要用二线药物进行治疗,这些药物主要包括氟喹诺酮类、氨基糖苷类注射剂.昂贵且有毒的二线药物是对一线药物具有耐药性的结核分枝杆菌分离株的必然治疗方法.耐多药结核病检出率低、难以控制,其部分原因是缺乏快速和准确的诊断测试.因此,MDR-TB和一、二线药物耐药性的快速诊断是目前急需解决的问题之一.熔解曲线分析是一种通过实时PCR检测突变的简单方法,熔解曲线技术将扩增与检测融为一体,具有耗时短、操作简易等优势,在很大程度上弥补了传统药敏检测手段的不足,已经成为诊断耐药结核病的新兴分子辅助技术.该方法可同时检测一、二线抗结核药物的耐药性,在临床实践中可能是常规DST的良好替代方法[4].异烟肼、利福平作为重要的一线药物,其耐药性的检测不仅作为诊断的主要根据,也为患者的合理治疗方案提供了重要保障.同时,耐多药的出现使我们对二线抗结核药物的检测需求大大提升.本研究的目的是利用异烟肼、利福平、氟喹诺酮类、二线注射类耐药试剂盒对215株结核分枝杆菌临床分离株进行检测来评估熔解曲线在临床上的应用价值.并探索将其用作DST的测试的可能性.因此,我们评估了溶解曲线检测一、二线抗结核药物耐药性的效用,并将结果与微孔板药敏试验结果进行比较.
1 材料与方法
1.1 研究材料
1.1.1 菌株来源 2013 年黑龙江省耐药监测结核分枝杆菌分离株215 例及标准菌株(H37Rv)均保存于中国疾病预防控制中心结核病参比实验室菌株库.
1.1.2 试剂与仪器 结核分枝杆菌异烟肼、利福平、氟喹诺酮、注射类二线药试剂盒、荧光定量PCR仪均购自厦门至善生物科技有限公司;分枝杆菌罗氏培养基(中性)购自珠海市银科医学工程有限公司;Middlebrook 7H9肉汤培养基、结核分枝杆菌药敏板均购自美国THERMO公司;AIM全自动96孔加样器购于thermo公司.
1.2 研究方法
1.2.1 分离培养 用无菌吸管取菌保存液0.1 mL接种至中性改良罗氏培养基斜面上,保持培养基斜面水平向上,并放置于37℃恒温培养箱内进行孵育.接种后每周观察一次菌落生长情况,观察后记录观察结果,4~6周后报告结果.
1.2.2 菌种鉴定 在1.5 mL Eppendorf 离心管中加入300 μL去离子水(HPLC 级或质谱级),转移分枝杆菌样本到上述离心管中.95 ℃的金属浴30 min 热灭活.样本冷却后,加入900 μL 乙醇,用混悬器充分混匀,离心2 min(≥13 000 rpm),用移液枪小心吸弃残余的上清液,室温下晾干沉淀(几分钟即可),加入少量化锆/二氧化硅微珠,根据沉淀的体积,加入10~50 μL乙腈,全速涡旋振荡1 min,加入少量氧加入70%甲酸水溶液(体积与加入的乙腈体积相同),涡旋振荡5 秒,离心2 min(≥13 000 rpm),取1 μL 上清液至MALDI靶板上,室温晾干立即覆盖1 μL基质溶液,室温晾干.将晾干的靶板放入质谱分析仪内进行菌种鉴定分析.
1.2.3 药敏方法 从培养基上刮下菌落于含有2.5 mL生理盐水中进行磨菌20秒.转移120 μL混悬液至含有OADC 的7H9 药敏接种培养液中.利用AIM 全自动96 孔加样器将培养液分装于结核分枝杆菌药敏板后放入恒温箱培养2周后读取药敏结果.菌株对药物的MIC值大于临界浓度,则该菌株对该药临界浓度表现为耐药;MIC值小于或等于临界浓度,则表明该菌株对该药物浓度敏感.
1.2.4 荧光PCR 熔解曲线法 固体培养基上生长的的结核分枝杆菌用22SWG 标准接种环收集细菌1环,并悬在250 μL TB DNA提取液中,99℃加热20 min.14 000 g离心10 min后,将5 μL上清液模板加入已配置好的PCR反应管中后进行PCR扩增和熔解曲线分析.PCR扩增区程序设定;UNG 处理:50℃2 min,1个循环;预变性:95℃5 min;Touchdown 循环:95℃10 s,71℃25 s,75℃30 s,10 个循环;PCR 循环程序:95℃10 s,61℃25 s,75℃25s,45 个循环;熔解分析程序:95℃2 min,40℃2 min,40℃~80 ℃,1 个循环.检验结果;Tm值以仪器自动判读所得为准,敏感型:样品熔解曲线的熔点与阳性对照溶解曲线的熔点一致;耐药型:样品溶解曲线的熔点低于阳性对照2℃及以上.
1.3 统计学方法
采用SPSS18.0统计学软件进行数据分析,采用四格表的形式计算敏感度、特异度和符合率.通过配对χ2检验(McNemar test)比较荧光PCR溶解曲线法与微孔板药敏试验(金标准)耐药突变检出率的差异.采用Excel表格绘制Venn Diagram.敏感度=真阳性数/(真阳性数+假阴性数)×100%;特异度=真阴性数/(真阴性数+假阳性数)×100%;阳性预测值=真阳性数/(真阳性数+假阳性数)×100%;阴性预测值=真阴性数/(真阴性数+假阴性数)×100%;阳性似然比=敏感度/(1-特异度);阴性似然比=(1-敏感度)/特异度;符合率=(真阳性数+真阴性数)/全部检测患者例数.
2 结果
2.1 分离培养及菌种鉴定
215例菌株经改良罗氏培养基培养后无不合格或已经死亡菌株,通过MALDI-TOF 质谱仪匹配测得215例菌株均为结核分枝杆菌(MTB).
2.2 药敏试验结果
将收集到的黑龙江省耐药监测结核分枝杆菌临床分离株215例进行分离培养,共获得菌株215例,经微孔板药敏试验鉴定,22株为利福平耐药菌株,42株为异烟肼耐药菌株,10株为氧氟沙星耐药菌株,9株为莫西沙星耐药菌株,3株为阿米卡星耐药菌株,5株为卡那霉素耐药菌株.
2.3 方法学比较
以微孔板药敏试验为金标准,荧光PCR 熔解曲线方法检测利福平灵敏度90.9%(20/22),特异度95.85%(185/193),符合率95.34%(205/215);荧光PCR 溶解曲线方法检测异烟肼的灵敏度为83.33%(35/42),特异度91.9%(159/173),符合率90.23%(194/215),其中有7例可能出现不均一突变,判为敏感;检测氧氟沙星的灵敏度为90%,特异度100%,符合率99.53%;检测莫西沙星的灵敏度为88.88%(8/9)、特异度100%(206/206)、符合率99.51%(214/215);检测二线注射类药物阿米卡星的灵敏度与特异度以及符合率均为100%,而卡那霉素的敏感度为80%(4/5),特异度为100%(210/210),符合率99.53%(214/215).表明四种试剂盒的特异性均较高,其中利福平突变检测试剂盒的灵敏度最高.该结果表明四种试剂盒在灵敏度和特异性方面具有较好的性能.结果见表1~表6.
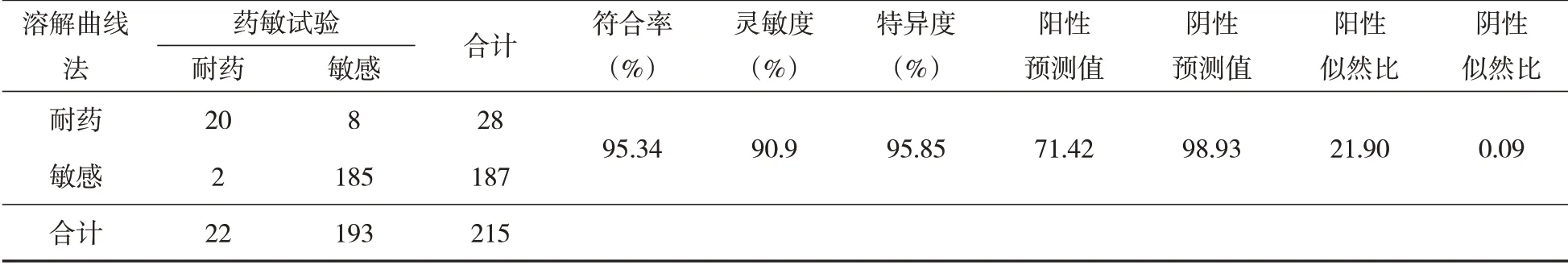
表1 2种方法检测利福平耐药结果比较Tab.1 Comparison of two methods in detecting rifampicin resistance

表2 2种方法检测异烟肼耐药结果比较Tab.2 Comparison of two methods in detecting isoniazid resistance

表3 2种方法检测氧氟沙星耐药结果比较Tab.3 Comparison of two methods in detecting ofloxacin resistance

表4 2种方法检测莫西沙星耐药结果比较Tab.4 Comparison of two methods in detecting moxifloxacin resistance

表5 2种方法检测阿米卡星耐药结果比较Tab.5 Comparison of two methods in detecting amikacin resistance
3 讨论
结核病是全球单一传染病中的头号杀手.2018年全球3.4%新发病例为MDR/RR-TB,我国7.1%新发病例MDR/RR-TB.中国已成为全球耐多药和广泛耐多药结核病高负担国家之一[3].近年结核病的耐药呈不断上升的趋势,耐多药患者的出现降低了结核病的治愈率,这对结核病的控制无疑是一场新的挑战.
目前,结核病的耐药性是通过琼脂比例法或BACTEC MGIT 960等液体培养基法等基于传统罗氏培养的方法确定的.尽管这些方法较快速,但由于结核分枝杆菌存在生长缓慢这一特性,受其影响至少需要一周以上的时间才能确定其药敏情况.很大程度上延误了结核病的正确治疗,造成结核病的不断传播与发展.我国结核病患者管理主要采用DOTS策略社区(家庭)短程督导模式,但由于治疗的延误、患者依从性差或进行非连续治疗、耐药的不断发生等原因,使得这种模式下密切接触后感染复发的机率进一步增加.目前为止,用于治疗结核病主要有效药物是异烟肼和利福平,但是临床上耐多药结核病的出现需要使用二线抗结核药物进行长期治疗,这将会导致药物成本高和广泛毒性副作用的结果出现.因此,获得早期药物敏感性结果对于启动合适的结核病治疗方案至关重要,结核病患者耐药性的快速检测有助于监测并控制耐药性疾病的传播.
随着近年结核病分子诊断技术的新兴与发展,在早期快速诊断耐药突变方面涌现出很多技术,目前已采用快速分子技术从临床标本中检测抗生素耐药性.这些基于分子的分析可有效地用于快速鉴定抗生素耐药性相关的基因突变和单核苷酸多态性(SNP).分子测序具有高可靠性,但价格昂贵不能广泛用于微生物实验室.GeneXpert作为一种价值较高的诊断结核病的试验方法,其自动化的设备能在短时间内给出结果.具有潜在高通量、标准化测试、快速诊断的优势[5].但该方法只能用于利福平耐药突变的独立诊断检测,利福平也可作为耐药结核病的替代参考指标,但在结核病防治领域中,检测利福平与异烟肼的耐药性是最低标准.因此该技术在临床仍有较大的局限性.荧光PCR熔解曲线法是PCR技术很好的延伸,其可检测对耐药性标准治疗方案中使用的二线抗结核药物情况.不仅如此,其高灵敏度、低污染的特点已受到广泛应用,荧光PCR熔解曲线技术是通过曲线形状变化来获得耐药突变结果[6].其主要检测原理为耐药基因突变使DNA双链的结合力下降,引起相应的熔点(Tm)值下降,从而推得序列突变信息.即野生型基因有特定的熔点(Tm)值而突变型基因为结合能力下降导致Tm值发生变化,据此可以检测出突变型和野生型结核[7].因此,本研究的目的是分析评价荧光PCR溶解曲线技术检测利福平、异烟肼、氟喹诺酮类及二线注射类药物的临床应用价值.
在过去的60 年里,世界卫生组织(WHO)建议使用Lowenstein-Jensen(LJ)比例法已经被广泛使用,然而,它的主要缺点是需要4~6周获得结果.微孔板药敏是经FDA认证,由美国Thermo公司生产的商品化药敏板,多项研究已证实其可靠性与重复性高[8],其是一种干燥的微型平板,含有冻干抗生素,用于检测结核分枝杆菌菌株的最小抑制浓度(MIC)[9].据报道,利福平、氧氟沙星、阿米卡星、卡那霉素和环丝氨酸与LJ比例法的临床一致性为99.2%,异烟肼和对氨基水杨酸为98.4%[10].微孔板药敏法与比例法一致性很高[10].该方法比LJ比例法更快速、方便、定量、准确地检测一线和二线药物[11].并且,菌液的稀释和接种均采用自动化仪器,很大程度减少了人为操作不稳定性因素带来的误差[12].它还提供了关于易感程度的信息,促进治疗决策.在这项研究中,以微孔板药敏试验作为金标准,荧光PCR熔解曲线法测定的灵敏度和特异性对于利福平分别为90.9%和95.85%,对于异烟肼分别为83.33%和91.9%.荧光PCR熔解曲线先前已被其他研究人员用于检测结核分枝杆菌分离株之间的耐药性.我们的结果与这些研究一致.此外,我们以90%的敏感性、100%的特异性和88.88%的敏感性、100%的特异性确定了氟喹诺酮类药物氧氟沙星与莫西沙星耐药性.我们通过检测gyrA 基因的88-94 突变成功检测了10 株耐氧氟沙星的菌株中的9 株(占90%)与9株耐莫西沙星中的8株(占88.88%).研究显示gyrA和gyrB中的突变均引起了对氟喹诺酮类药物的耐药性[13].但是,gyrB突变频率是较低的.氟喹诺酮类药物耐药性主要是由于gyrA基因突变引起.因此,在无突变2 株氟喹诺酮类耐药株可能是通过gyrB 基因突变引起的或其他机制,如主动外排泵[14].gyrA测试的突变主要位点是gyrA88、gyrA90、gyrA91、gyrA94.临床环境中当耐药菌株含量较低时会出现同时含有突变型和野生型分离株,造成假阴性结果.此外,为检测耐多药和广泛耐药分离株,试验还研究二线注射类药物,即氨基糖苷类.试验通过检测rrs基因突变和eis基因启动子,以分别检测对阿米卡星和卡那霉素的耐药性[15].我们检测出阿米卡星的灵敏度100%、特异度100%、检测卡那霉素的灵敏度80%、特异度100%.由于二线注射类药物耐药性较低,我们在215株结核分枝杆菌临床分离株中共检测出7株耐氨基糖苷类分离株.试验成功检测了5株耐卡那霉素的菌株中的4株(占80%).很少有方法可以检测出eis基因启动子中的突变来检测对卡那霉素的低水平耐药性.应评估更多分离株以验证荧光PCR对二线注射类药物测定的有效性.
研究提示,荧光PCR熔解曲线为耐药结核分枝杆菌菌株的突变提供了帮助,其低成本与使用灵活的特点可广泛用于流行病学研究.荧光PCR熔解曲线可以快速同时检测出对一线和二线抗结核药物的耐药性,并消除了通过表型药物敏感实验获得结果所需的延长周期[6].但是,溶解曲线也存在局限性,该方法筛选中不包含氨基酸序列,这会导致不引起氨基酸改变的沉默突变也会归为突变一类,如本试验显示的微孔板药敏结果为敏感但熔解曲线检测为耐药突变,此外若不均一耐药菌株中耐药菌的比例偏低时,可能会导致溶解峰与阳性对照一致判定为敏感,造成假阴性结果[16].
综上所述,荧光PCR熔解曲线分析技术是一种简单快速、准确且具有成本效益的方法.在检测异烟肼、利福平、氟喹诺酮类、二线注射类药物耐药上具有较高的灵敏度和特异度.此方法与表型DST方法相比在短时间内产生结果,可以及时进行治疗并预防可能的耐多药菌株的出现,有效的辅助耐药结核分枝杆菌快速诊断筛查.

