模拟消化中藜麦的酚类化合物释放和抗氧化活性
李进才,刘梦杰,陈银焕,郭慧敏,杨修仕,任贵兴
模拟消化中藜麦的酚类化合物释放和抗氧化活性
李进才1,刘梦杰1,陈银焕1,郭慧敏2,杨修仕2,任贵兴2
(1. 天津大学化工学院,天津 300350;2. 中国农业科学院作物科学研究所,北京 100081)
为了解藜麦(Willd.)功能性营养成分在人体消化系统的利用效率,以籽粒颜色白、红和黑的3种颜色藜麦为实验材料,采用模拟消化模型分析了藜麦经模拟口腔、胃和肠消化时酚酸、多酚和黄酮释放量、生物可及性及抗氧化活性.结果表明:模拟消化过程中,3种颜色藜麦的酚酸、多酚和黄酮的释放量随消化进程的进行而增加,其中酚酸和黄酮在肠消化阶段释放较多,多酚在胃消化阶段释放较多,红藜麦和黑藜麦的酚类化合物释放量多于白藜麦(<0.05);模拟消化结束时的酚酸、多酚和黄酮释放量在白藜麦、红藜麦和黑藜麦之间也差异显著(<0.05),依次分别为34.39、41.73、51.88mg/(100g),362.19、400.40、436.62mg(GAE)/(100g),28.73、48.90、41.24mg(RE)/(100g);模拟消化结束时的生物可及性,酚酸为白藜麦90.33%、红藜麦85.41%和黑藜麦91.61%,多酚为白藜麦81.44%、红藜麦84.09%和黑藜麦78.75%,黄酮为3种颜色藜麦无显著差异约20%(>0.05);模拟消化过程中,3种颜色藜麦的抗氧化活性(ABTS和DPPH自由基清除能力)也随消化进程的进行而增大,多酚释放量与抗氧化活性呈正相关(<0.01),红藜麦和黑藜麦的抗氧化活性大于白藜麦(<0.05).从这些结果可以推论,食用藜麦可以获取酚类化合物功能性营养成分和抗氧化生物活性,食用红藜麦和黑藜麦会获取较白藜麦更多的酚类化合物功能性营养成分和更大的抗氧化生物活性.
藜麦;模拟消化;酚酸;多酚;黄酮;生物可及性;抗氧化活性
藜麦(Willd.)为苋科藜属一年生植物,是原产于南美洲安第斯山脉的假谷物,含有丰富的蛋白质、膳食纤维和矿物质,且氨基酸组成均衡,并富含酚酸、多酚和黄酮等酚类化合物功能性营养成分[1-2].其中,摄入人体内的酚类化合物具有抗氧化、抗炎、抗病毒和抗癌等生理功效[3-4].
藜麦籽粒颜色丰富,有白色、红色和黑色等,酚类化合物含量及抗氧化活性与其籽粒颜色密切相关.Brend等[5]采用盐酸和甲醇提取方法的研究结果表明,红藜麦的多酚和黄酮含量及抗氧化活性显著大于黄藜麦.申瑞玲等[6]采用乙醇提取方法的研究结果表明,黄酮含量由高到低依次为黑藜麦、红藜麦、黄藜麦和白藜麦.Tang等[4,7]采用甲醇和乙醚-乙酸乙酯提取方法的研究结果表明,黑藜麦的多酚含量及抗氧化活性大于白藜麦和红藜麦,红藜麦的黄酮含量大于白藜麦和黑藜麦.然而,藜麦在被食用后是经口腔、胃和肠道中的消化液和酶进行消化的,其对酚类化合物的溶出效果与有机溶剂不同,Brend等[5]、申瑞玲等[6]和Tang等[4,7]的研究结果难以反映藜麦酚类化合物和抗氧化活性在人体消化系统环境下的利用效率.
动物或人体实验是研究食物营养价值及生理活性的优选方法,但难度大、耗时长和费用高[8].体外模拟消化模型能较好地模拟食物在体内的消化过程,快速准确地对食物的功能性营养成分等进行评价[9],在大米[10]和小麦[11]的酚类化合物等营养成分研究中已有较多应用.为了解藜麦功能性营养成分在人体消化系统的利用效率,以国内外市场销售普遍、籽粒颜色白、红和黑的3种颜色藜麦为实验材料,采用模拟消化模型分析和讨论了藜麦经模拟口腔、胃和肠消化过程中酚类化合物释放量、生物可及性及抗氧化活性,以期为藜麦功能食品研发提供理论科学依据.
1 材料与方法
1.1 材料与试剂
白藜麦“QQ74”、红藜麦“BGQ-41”和黑藜麦“POQ-67”产地为青海,购自山西中藜食品,白藜麦籽粒的色差L为75.87、a为2.39、b为19.79,红藜麦籽粒的色差L为36.86、a为16.68,b为17.16,黑藜麦籽粒的色差L为29.57、a为6.18,b为4.52.含水率为白藜麦9.01%、红藜麦8.99%、黑藜麦8.80%,3种颜色藜麦之间无显著差异.将3种颜色藜麦籽粒分别粉碎,过60目筛,制成藜麦面粉,于-20℃储藏,用于基本营养成分测定和模拟消化.
淀粉检测试剂盒,爱尔兰Mezayme;酚酸标准品的对香豆酸、阿魏酸、异阿魏酸、丁香酸、原儿茶酸、对羟基苯甲酸、2,5-二羟基苯甲酸、香草酸和咖啡酸,美国Sigma;福林酚试剂、没食子酸、芦丁、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2-azino-bis-(3-ethylbenzonthiazoline-6-sulfonic acid) diammo-nium salt,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和水溶性维生素E,北京Solarbio生物科技;α-淀粉酶、胃蛋白酶、猪胆盐和胰酶,美国Sigma;其他化学试剂均为分析纯,国药集团化学试剂.
1.2 仪器与设备
恒温水浴振荡器,KW-1000DC型,常州亿通分析仪器制造;全自动凯氏定氮仪,2300型,瑞典FOSS;液相色谱仪(紫外可见检测器),LC-20AT型,日本岛津;酶标仪,SpectraMax Plus 384型,美国Molecular;台式高速冷冻离心机,H1850R型,湖南湘仪仪器.
1.3 测定方法
1.3.1 藜麦基本营养成分测定
取3种颜色藜麦的面粉进行基本营养成分测定,采用GB 5009.5—2016《食品中蛋白质的测定》法测定蛋白质含量,采用试剂盒AOAC 996.11法测定淀粉含量,采用GB 5009.88—2014《食品中膳食纤维的测定》法测定膳食纤维含量.
另取3种颜色藜麦面粉各5g,分别与50%(体积分数)乙醇溶液50mL混合,80℃水浴振荡提取2.5h,4500离心5min,上清液用于酚酸、多酚和黄酮含量测定.
酚酸含量测定采用高效液相色谱(HPLC)法,色谱柱Thermo Scientific Acclaim C18(4.6mm×250mm,5μm),柱温60℃,检测波长280nm.流动相A为0.05%三氟乙酸溶液,流动相B为三氟乙酸0.05%-水59.95%-甲醇10.00%-乙腈30.00%的混合液,流动相洗脱程序设定如表1所示.测定包括对香豆酸、阿魏酸、异阿魏酸、丁香酸、原儿茶酸、对羟基苯甲酸、2,5-二羟基苯甲酸、香草酸和咖啡酸等9种酚酸的含量.
多酚含量测定采用福林酚分光光度法[12],单位表示为每100g藜麦含有没食子酸当量(gallic acid equivalent,GAE)的mg数(mg(GAE)/(100g)).黄酮含量的测定采用氯化铝比色法[13],单位表示为每100g藜麦含有芦丁当量(rutin equivalent,RE)的mg数(mg(RE)/(100g)).
表1 HPLC法流动相洗脱程序
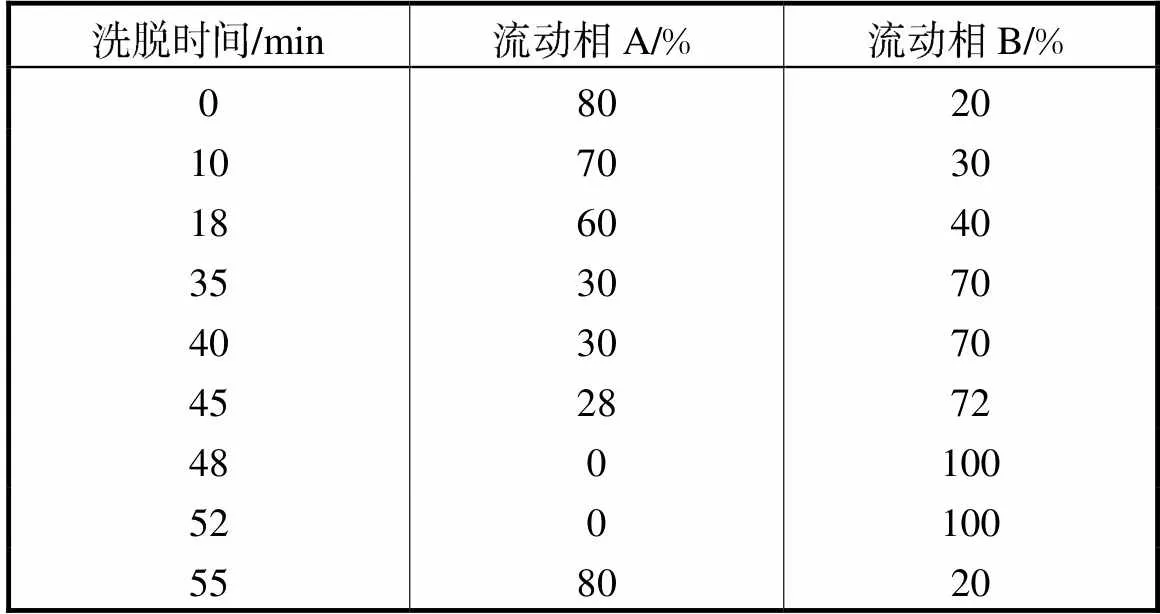
Tab.1 HPLC mobile phase elution parameters
1.3.2 模拟消化
模拟消化模型实验参照倪香艳等[9]报道的方法,做适当修改,实验重复3次.
(1) 样品熟化:称取12g藜麦面粉于锥形瓶,加入200mL生理盐水(0.9%的NaCl溶液),沸水浴15min,冷却后用蒸馏水调节样品悬浊液体积至200mL,取出5mL熟化液样品.
(2) 模拟口腔消化:在锥形瓶中的熟化液中加入a-淀粉酶10mg(提前在1mmol/L的CaCl2溶液1.25mL中溶解),置于37℃恒温水浴振荡器反应30min,在15、30min时分别取出5mL模拟口腔消化液样品.
(3) 模拟胃消化:模拟口腔消化结束后,将锥形瓶中的消化液用6mol/L的HCl溶液约2mL调节pH值至2,加入胃蛋白酶0.25g(提前在0.1mmol/L的HCl溶液5mL中溶解),用铝箔纸包裹锥形瓶,充入氮气后置于37℃恒温水浴振荡器反应120min,在15、30、60、120min时分别取出5mL模拟胃消化液样品.
(4) 模拟肠消化:模拟胃消化结束后,将锥形瓶中的消化液用6mol/L的NaOH溶液约3mL调节pH值至6.8,加入胰酶0.11g和猪胆盐0.70g(二者提前在0.5mol/L的NaHCO3溶液10mL中溶解),充入氮气后置于37℃恒温水浴振荡器反应240min,在反应15、30、60、120、180、240min时分别取出5mL模拟肠消化液样品.
以上模拟消化前的熟化液样品,以及模拟口腔、胃和肠各消化阶段的消化液样品,于4℃、10000离心20min,取上清液3mL,加入丙酮12mL,再次离心除去蛋白质和多糖,上清液于-80℃储藏,用于酚类化合物释放量和抗氧化活性测定.
1.3.3 模拟消化过程中酚类化合物的释放量测定和生物可及性计算
取上述模拟消化前以及模拟口腔、胃和肠消化阶段结束时的冷冻上清液样品进行酚酸含量测定,方法采用HPLC法,检测条件及洗脱程序同前.
取上述模拟消化前以及模拟口腔、胃和肠消化阶段消化过程中的冷冻上清液样品进行多酚和黄酮含量测定,测定方法与前述福林酚分光光度法[12]和氯化铝比色法[13]相同.
根据上述测定的藜麦基本营养成分酚酸、多酚和黄酮含量,以及模拟消化结束时(模拟肠消化240min)的酚酸、多酚和黄酮释放量,按照Hierro 等[14]的方法计算酚类化合物的生物可及性:
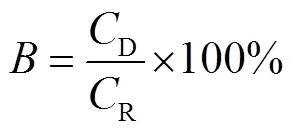
式中:是藜麦酚酸(或多酚或黄酮)的生物可及性,%;D是模拟消化结束时的藜麦酚酸(或多酚或黄酮)释放量;R是未熟化藜麦的酚酸(或多酚或黄酮)含量.
1.3.4 抗氧化活性测定
本研究采用ABTS自由基清除能力和DPPH自由基清除能力评价模拟消化过程中3种颜色藜麦的抗氧化活性.取上述模拟消化前和模拟消化过程中的冷冻上清液样品进行ABTS和DPPH自由基清除能力测定,ABTS自由基清除能力测定采用分光光度法[15],单位表示为每g藜麦样品含有水溶性维生素E当量(trolox equivalent,TE)的μmol数(μmol(TE)/g);DPPH自由基清除能力测定采用Guo等[13]的方法,单位表示为每g藜麦样品含有TE当量的μmol数(μmol(TE)/g).
1.3.5 数据分析
以上测定数据均以3次重复的平均值±标准偏差表示.用SPSS软件(版本18.0)进行单因素方差分析,采用Duncan法对藜麦基本营养成分含量、酚类化合物释放量、生物可及性和抗氧化活性的测定结果进行差异显著性分析(<0.05),采用-检验法对相关系数进行差异显著性分析(<0.01).
2 结果与分析
2.1 3种颜色藜麦的基本营养成分
3种颜色藜麦的基本营养成分含量如表2所示,蛋白质含量是白藜麦和黑藜麦高于红藜麦(<0.05),淀粉含量由高到低依次为白藜麦、红藜麦和黑藜麦(<0.05),膳食纤维含量由高到低依次为黑藜麦、红藜麦和白藜麦(<0.05).这些测定结果与Repo-Carrasco-Valencia等[1]和Nowak等[16]报道的一致.
酚酸含量由高到低依次为黑藜麦、红藜麦和白藜麦(<0.05),多酚含量由高到低也依次为黑藜麦、红藜麦和白藜麦(<0.05),黄酮含量由高到低依次为红藜麦、黑藜麦和白藜麦(<0.05).Tang等[7]也曾报道黑藜麦酚酸及多酚含量高于白藜麦和红藜麦,红藜麦黄酮含量较高.
表2 3种颜色藜麦的基本营养成分含量
注:同一列数据后的不同小写英文字母间有显著性差异(<0.05).
2.2 模拟消化过程中酚酸释放量的变化
酚酸是含有1个芳香环和1个以上酚羟基的酚类化合物.模拟消化过程中3种颜色藜麦的酚酸释放量变化如图1所示.模拟消化前,白藜麦、红藜麦和黑藜麦的酚酸释放量分别为(3.23±0.121)、 (4.86±0.227)、(6.39±0.128)mg/(100g),3者差异显著(<0.05);模拟口腔消化结束时,3种颜色藜麦的酚酸释放量较消化前增加(<0.05),白藜麦、红藜麦和黑藜麦的酚酸释放总量分别为(6.91±0.361)、(14.94±0.880)、(11.47±0.405)mg/(100g),3者差异显著(<0.05);模拟胃消化结束时,与模拟口腔消化结束时相比,白藜麦的酚酸释放量减少(<0.05),红藜麦和黑藜麦的酚酸释放量无显著变化(>0.05);模拟肠消化结束时,3种颜色藜麦的酚酸释放量较胃消化结束时增加(<0.05),白藜麦、红藜麦和黑藜麦的酚酸释放量分别为(34.39±0.864)、(41.73±1.055)、(51.88±1.111)mg/(100g),3者差异显著 (<0.05).
模拟消化过程中3种颜色藜麦的各种酚酸释放量变化如表3所示.其中释放量大于5mg/(100g)的酚酸,模拟口腔消化结束时有红藜麦和黑藜麦的对香豆酸,模拟肠消化结束时有白藜麦的对香豆酸和阿魏酸,红藜麦的阿魏酸和2,5-二羟基苯甲酸,以及黑藜麦的对香豆酸.另外,在模拟胃消化和模拟肠消化结束时,阿魏酸、异阿魏酸、丁香酸和香草酸等释放量的测定值也有减小的现象.
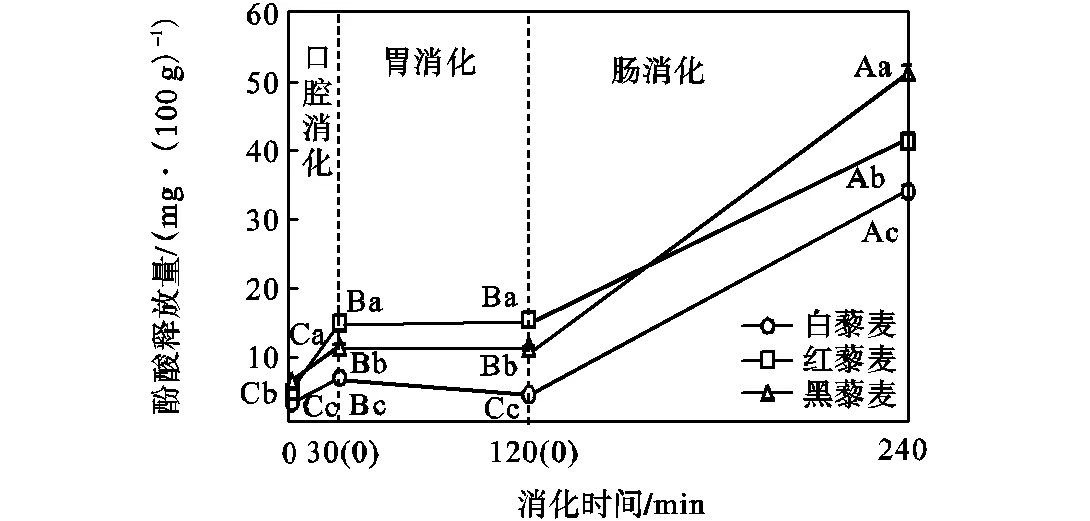
不同大写英文字母表示同种颜色藜麦在不同消化时间的酚酸释放量有显著性差异(P<0.05);不同小写英文字母表示不同颜色藜麦在同一消化时间的酚酸释放量有显著性差异(P<0.05)
表3 模拟消化过程中3种颜色藜麦酚酸释放量的变化

Tab.3 Change of phenolic acid release from each of the three varieties of quinoa during simulated digestion mg/(100g)
注:“—”为未检出;tr为痕量.
2.3 模拟消化过程中多酚释放量的变化
多酚是有3个以上苯酚环的酚类化合物.模拟消化过程中3种颜色藜麦的多酚释放量变化如图2所示.模拟消化前,白藜麦、红藜麦和黑藜麦的多酚释放量分别为(73.69±1.13)、(91.65±0.60)、(118.28± 1.88)mg(GAE)/(100g),3者差异显著(<0.05);模拟口腔消化阶段,白藜麦、红藜麦和黑藜麦的多酚释放量较模拟消化前增加(<0.05),30min结束时分别为(109.87±3.05)、(132.64±0.80)、(141.63±1.19)mg(GAE)/(100g),3者也差异显著(<0.05);模拟胃消化阶段,白藜麦、红藜麦和黑藜麦的多酚释放量急速增加,大于模拟口腔消化阶段(<0.05),120min结束时分别为(271.97±4.19)、(301.65±1.50)、(333.50±0.52)mg(GAE)/(100g),3者还差异显著(<0.05);模拟肠消化阶段,白藜麦、红藜麦和黑藜麦的多酚释放量逐渐增加,大于模拟胃消化阶段(<0.05),240min时分别为 (362.19±3.91)、(400.40±1.20)、(436.62±0.69)mg (GAE)/(100g),3者仍差异显著(<0.05).
2.4 模拟消化过程中黄酮释放量的变化
黄酮是多酚中具有2-苯基色原酮结构的酚类化合物.模拟消化过程中3种颜色藜麦的黄酮释放量变化如图3所示.模拟消化前,白藜麦、红藜麦和黑藜麦的黄酮释放量差异显著(<0.05),分别为(7.50±0.05)、(12.02±0.05)、(10.73±0.07)mg(RE)/ (100g);模拟口腔消化阶段,3种颜色藜麦的黄酮释放量无显著变化(>0.05);模拟胃消化阶段,白藜麦、红藜麦和黑藜麦的黄酮释放量大于模拟口腔消化阶段(<0.05),120min结束时分别为(13.82±1.00)、(21.84±0.75)、(19.40±0.85)mg(RE)/ (100g),3者也差异显著(<0.05);模拟肠消化阶段,白藜麦、红藜麦和黑藜麦的黄酮释放量急速增加,大于模拟胃消化阶段(<0.05),240min结束时分别为(28.73±0.12)、(48.90±1.84)、(41.24±1.58)mg(RE)/(100g),3者还差异显著(<0.05).

不同大写英文字母表示同种颜色藜麦在不同消化时间的多酚释放量有显著性差异(P<0.05);不同小写英文字母表示不同颜色藜麦在同一消化时间的多酚释放量有显著性差异(P<0.05);
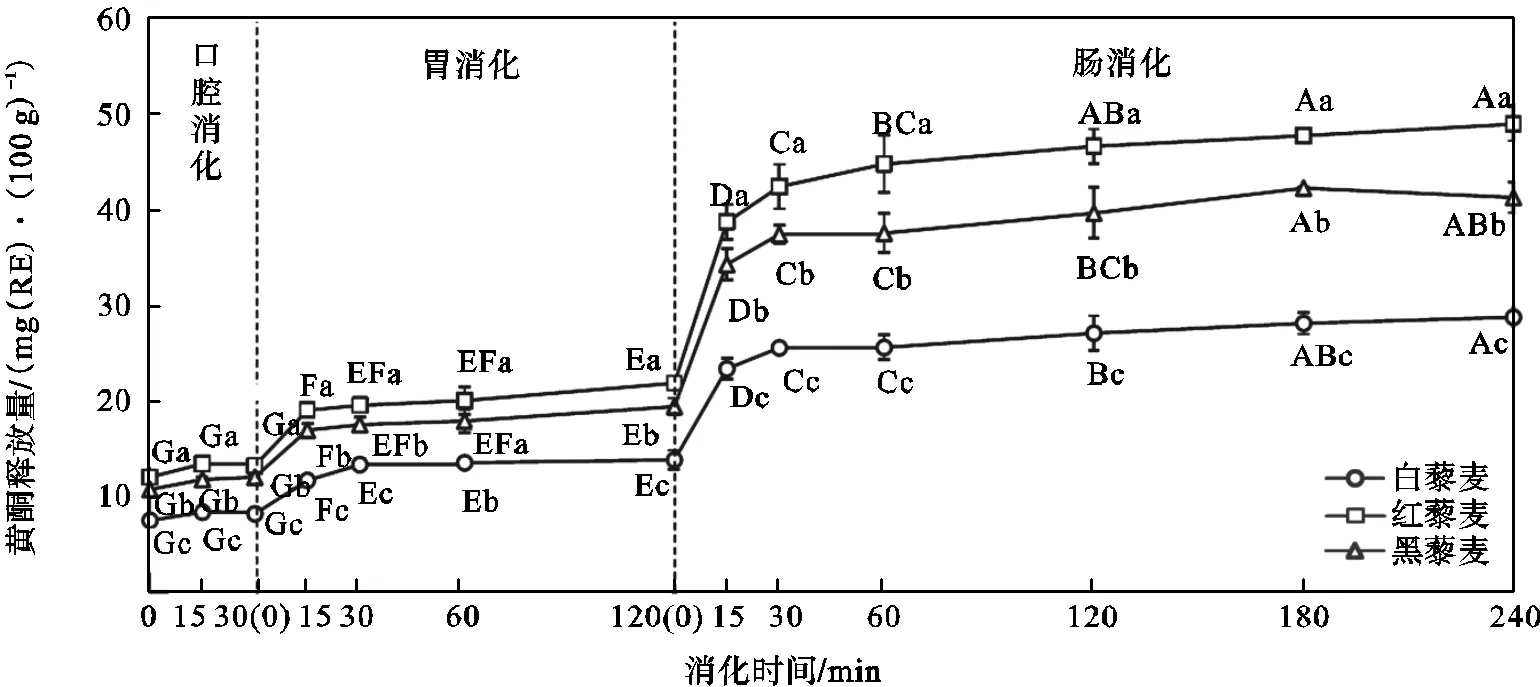
不同大写英文字母表示同种颜色藜麦在不同消化时间的黄酮释放量有显著性差异(P<0.05);不同小写英文字母表示不同颜色藜麦在同一消化时间的黄酮释放量有显著性差异(P<0.05);
2.5 模拟消化结束时酚类化合物的生物可及性
生物可及性是指食物含有的营养成分可能被吸收进入血液循环系统的比率.模拟消化结束时3种颜色藜麦的酚类化合物的生物可及性如图4所示.酚酸的生物可及性是白藜麦和黑藜麦大于红藜麦(<0.05),白藜麦、红藜麦和黑藜麦分别为90.33%、85.41%、91.61%;多酚的生物可及性是3种颜色藜麦之间差异显著(<0.05),白藜麦、红藜麦和黑藜麦分别为81.44%、84.09%、78.75%;黄酮的生物可及性较低约20%,且3种颜色藜麦之间无显著差异(>0.05).

不同小写英文字母表示不同颜色藜麦间有显著性差异(P<0.05)
2.6 模拟消化过程中抗氧化活性的变化
ABTS和DPPH自由基清除能力是评价食品抗氧化活性的常用指标,ABTS自由基清除能力反映食品抑制ABTS自由基产生的能力,DPPH自由基清除能力反映食品与DPPH自由基相结合的能力.模拟消化条件下3种颜色藜麦的ABTS和DPPH自由基清除能力即抗氧化活性变化如图5所示.模拟消化前,3种颜色藜麦的ABTS自由基清除能力差异显著,由大到小依次为黑藜麦、红藜麦和白藜麦(<0.05);模拟口腔消化阶段,3种颜色藜麦的ABTS自由基清除能力较模拟消化前增大(<0.05),30min结束时红藜麦和黑藜麦也大于白藜麦(<0.05);模拟胃消化阶段,3种颜色藜麦的ABTS自由基清除能力急速增大,大于口腔消化阶段(<0.05),红藜麦和黑藜麦还大于白藜麦(<0.05);模拟肠消化阶段,3种颜色藜麦的ABTS自由基清除能力逐渐缓慢增大,红藜麦和黑藜麦仍大于白藜麦(<0.05).
模拟消化过程中3种颜色藜麦的DPPH自由基清除能力变化与ABTS自由基清除能力变化一致,也是模拟口腔消化阶段大于模拟消化前(<0.05),模拟胃消化阶段和模拟肠消化阶段大于模拟口腔消化阶段(<0.05);模拟消化前和模拟消化过程中,红藜麦和黑藜麦的DPPH自由基清除能力都大于白藜麦(<0.05).
2.7 模拟消化过程中多酚释放量与抗氧化活性的相关性
多酚是藜麦的主要抗氧化物质[17].模拟消化过程中3种颜色藜麦的多酚释放量与抗氧化活性的相关性如图6所示,3种颜色藜麦的多酚释放量与ABTS和DPPH自由基清除能力具有显著相关性 (<0.01).

不同大写英文字母表示同种颜色藜麦在不同消化时间的抗氧化活性有显著性差异(P<0.05);不同小写英文字母表示不同颜色藜麦在同一消化时间的抗氧化活性有显著性差异(P<0.05);
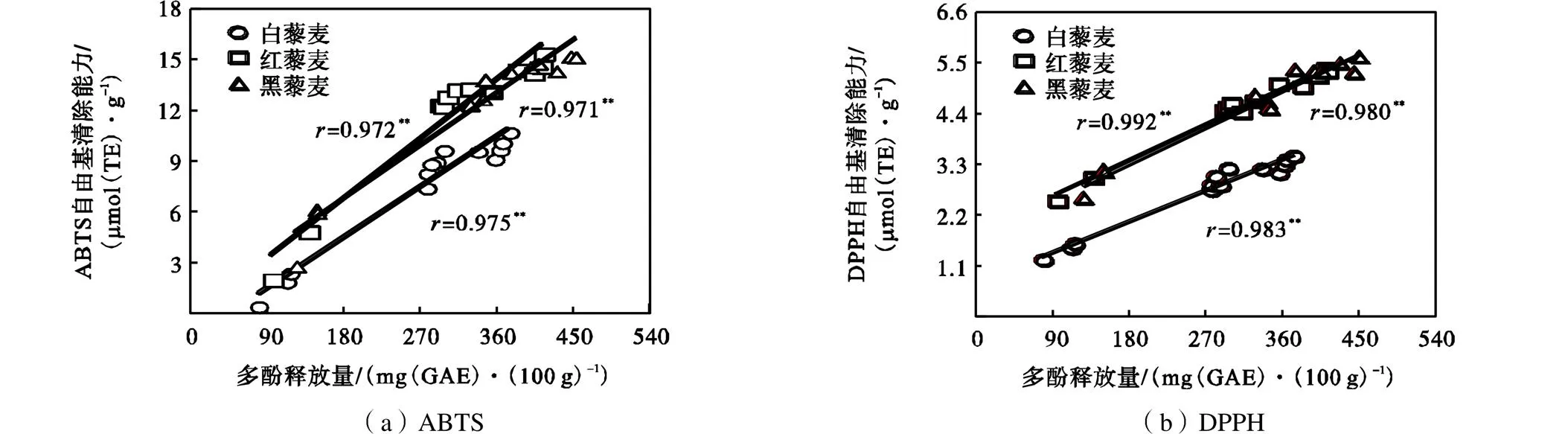
**表示相关性极显著(P<0.01)
3 讨 论
3.1 模拟消化过程中3种颜色藜麦的酚酸释放量变化
酚酸是藜麦的主要单体酚化合物[18].3种颜色藜麦的酚酸释放量在模拟口腔消化和肠消化结束时均增加,尤其是在模拟肠消化结束时增加较多;而模拟胃消化结束时的酚酸释放量是白藜麦有所减少,红藜麦和黑藜麦无显著变化(图1和表3).这表明模拟口腔和模拟肠消化可以促进藜麦酚酸释放,与籼型和粳型糙米在模拟消化过程中的酚酸释放量变化类似[9].其原因可能是由于藜麦的酚酸主要通过脂键或醚键等与纤维素、木质素、蛋白质及黄酮等相连的结合态存在[4,19-20],在口腔消化的α-淀粉酶、胃消化的胃酸和胃蛋白酶以及肠消化的胰酶作用下,结合态酚酸逐渐被水解释放游离出来[10,20-21].而模拟胃消化结束时的酚酸释放量测定结果减少或无显著增加(图1),可能是由于释放出来的对香豆酸(表3)部分被氧化或沉淀[21].
3种颜色藜麦的酚酸含量(表2)与模拟消化结束时的释放量(图1)一致,由多到少依次为黑藜麦、红藜麦和白藜麦,表明食用红藜麦和黑藜麦会获取较白藜麦更多的酚酸功能性营养成分.
3.2 模拟消化过程中3种颜色藜麦的多酚和黄酮释放量变化
在模拟口腔消化、胃消化和肠消化3个阶段,3种颜色藜麦的多酚释放量随消化进程的进行逐渐增加,其中在模拟胃消化初期有急速增加(图2);黄酮释放量在模拟胃消化和肠消化2个阶段也随消化进程的进行逐渐增加,其中在模拟肠消化初期有急速增加(图3).这些结果与糙米[9]和精米[10]在模拟消化过程中的多酚和黄酮释放量变化类似,表明藜麦的多酚和黄酮在模拟消化过程中也是逐步释放出来的.这可能是由于藜麦的多酚和黄酮多是以与淀粉、多糖和蛋白质等相结合的结合态存在[9],在模拟口腔消化的α-淀粉酶、模拟胃消化的胃酸和胃蛋白酶以及模拟肠消化的胰酶作用下被逐渐水解释放游离出来[4,9],因为α-淀粉酶可水解淀粉,胃蛋白酶可水解多糖羧基,胰酶中的胰淀粉酶可水解淀粉糖苷键,胰酶中的胰蛋白酶可水解蛋白质酯键.
3种颜色藜麦的多酚和黄酮含量(表2)与模拟消化过程中的释放量(图2和图3)一致,多酚由多到少依次为黑藜麦、红藜麦和白藜麦,黄酮由多到少依次为红藜麦、黑藜麦和白藜麦,表明食用红藜麦和黑藜麦会获取较白藜麦更多的多酚和黄酮功能性营养成分.
3.3 模拟消化结束时3种颜色藜麦的酚类化合物的生物可及性
具有生物可及性的酚类化合物功能性营养成分,才有可能在人体内发挥其生物学作用[22].模拟消化结束时,3种颜色藜麦酚酸(约90%)和多酚(约80%)的生物可及性比黄酮(约20%)高得多(图4).表明食用藜麦后酚酸和多酚的利用效率可能较高,而黄酮的可能较低.Rodríguez-Roque等[23]曾报道豆浆模拟消化结束时酚酸的生物可及性为0,可见不同食品的酚酸种类及存在形式有很大差异,藜麦酚酸的实际营养价值高于大豆.藜麦黄酮的生物可及性之所以较低,可能是由于藜麦黄酮的稳定性差,且在模拟消化过程中会与不溶性纤维[24]和a-淀粉酶[25]结合.Helal等[26]在肉桂饮料模拟消化研究中也观测到多酚的生物可及性为80%,Rodríguez-Roque等[23]在豆浆模拟消化研究中也观测到黄酮的生物可及性为16%.
藜麦酚酸的生物可及性在3种颜色藜麦间的差异(图4),可能是由于消化过程中3种颜色藜麦的各种酚酸释放量有差异(表3).多酚的生物可及性在3种颜色藜麦间的差异(图4),可能同各种酚酸释放 量不同一样,3种颜色藜麦含有的各种多酚释放量 不同[1, 7].
3.4 模拟消化过程中3种颜色藜麦的抗氧化活性变化
模拟消化过程中3种颜色藜麦的抗氧化活性随消化进程的进行逐渐增大(图5),模拟消化条件下大米[9]和小麦[27]的抗氧化活性也是逐渐增大.3种颜色藜麦的多酚释放量与ABTS和DPPH自由基清除能力的显著相关性(图6),表明在模拟消化条件下藜麦释放的多酚具有较高抗氧化生物活性,也表明酚类化合物中的多酚是藜麦的主要抗氧化物质[17].
模拟消化条件下,红藜麦和黑藜麦的ABTS和DPPH自由基清除能力反映的抗氧化活性显著大于白藜麦,表明食用红藜麦和黑藜麦会获取较白藜麦更大的抗氧化生物活性.
4 结 语
模拟消化模型能够较好地模拟食物在人体内的消化,快速准确地对食物的功能性营养成分等进行评价.研究结果表明:藜麦的酚类化合物在模拟消化过程中随消化进程的进行逐渐释放,其中酚酸和黄酮在肠消化阶段释放较多,多酚在胃消化阶段释放较多;红藜麦和黑藜麦的酚类化合物含量及模拟消化的释放量均多于白藜麦;藜麦模拟消化结束时的酚酸和多酚的生物可及性显著高于黄酮;藜麦的抗氧化活性在模拟消化过程中随消化进程的进行逐渐增大,多酚释放量与抗氧化活性呈正相关,红藜麦和黑藜麦的抗氧化活性大于白藜麦.从这些结果可以推论,食用藜麦可以获取酚类化合物功能性营养成分和抗氧化生物活性,食用红藜麦和黑藜麦会获取较白藜麦更多的酚类化合物功能性营养成分和更大的抗氧化生物活性.该结论对藜麦功能食品研发具有指导意义,但这只是藜麦在酚类化合物功能性营养成分和抗氧化生物活性两方面的利用效率,以及红藜麦和黑藜麦在这两方面较白藜麦的优势,作为功能食品研发还需要考量色泽和口感等感官品质以及蛋白质和膳食纤维等营养品质方面的差异.
[1] Repo-Carrasco-Valencia R,Hellström J K,Pihlava J M,et al. Flavonoids and other phenolic compounds in Andean indigenous grains:Quinoa(),kañiwa()and kiwicha (Amaranthus caudatus)[J]. Food Chemistry,2010,120(1):128-133.
[2] Yao Y,Yang X,Shi Z,et al. Anti-inflammatory activity of saponins from quinoa(Willd. )seeds in lipopolysaccharide-stimulated RAW 264. 7 macrophages cells[J]. Journal of Food Science,2014,79(5):H1018-H1023.
[3] Gómez-Caravaca A M,Iafelice G,Lavini A,et al. Phenolic compounds and saponins in quinoa samples(Willd. )grown under different saline and nonsaline irrigation regimens[J]. Journal of Agricultural and Food Chemistry,2012,60(18):4620-4627.
[4] Tang Y,Zhang B,Li X,et al. Bound phenolics of quinoa seeds released by acid,alkaline,and enzymatic treatments and their antioxidant and α-glucosidase and pancreatic lipase inhibitory effects[J]. Journal of Agricultural and Food Chemistry,2016,64(8):1712-1719.
[5] Brend Y,Galili L,Badani H,et al. Total phenolic content and antioxidant activity of red and yellow quinoa(Willd. )seeds as affected by baking and cooking conditions[J]. Food and Nutrition Sciences,2012,3(8):1150-1155.
[6] 申瑞玲,张文杰,董吉林,等. 藜麦的主要营养成分、矿物元素及植物化学物质含量测定[J]. 郑州轻工业学院学报:自然科学版,2015,30(增2):17-21.
Shen Ruiling,Zhang Wenjie,Dong Jilin,et al. Determination of main nutritional component,mineral element and phytochemical inWilld. [J]. Journal of Zhengzhou University of Light Industry:Natural Science Edition,2015,30(Suppl 2):17-21(in Chinese).
[7] Tang Y,Li X,Zhang B,et al. Characterisation of phenolics,betanins and antioxidant activities in seeds of threeWilld. genotypes[J]. Food Chemistry,2015,166:380-388.
[8] 李占明,蔡泓历,梁 奕,等.黄原胶对体外模拟消化过程中4种竹叶黄酮生物可及性的影响[J]. 食品科学,2019,40(21):58-64.
Li Zhanming,Cai Hongli,Liang Yi,et al.Effect of xanthan gum on bioaccessibility of four bamboo leaf flavonoids during simulatedgastrointestinal digestion[J]. Food Science,2019,40(21):58-64(in Chinese).
[9] 倪香艳,钟 葵,佟立涛,等. 糙米体外消化过程中酚类化合物含量及抗氧化活性[J]. 食品科学,2018,39(16):105-111.
Ni Xiangyan,Zhong Kui,Tong Litao,et al. Changes in polyphenols content and antioxidant activity during in vitro digestion of brown rice[J]. Food Science,2018,39(16):105-111(in Chinese).
[10] Ti H,Zhang R,Li Q,et al. Effects of cooking and in vitro digestion of rice on phenolic profiles and antioxidant activity[J]. Food Research International,2015,76:813-820.
[11] Gong L,Chi J,Zhang Y,et al.evaluation of the bioaccessibility of phenolic acids in different whole wheats as potential prebiotics[J]. LWT-Food Science and Technology,2019,100:435-443.
[12] Yao Y,Sang W,Zhou M,et al. Antioxidant and α-glucosidase inhibitory activity of colored grains in China[J]. Journal of Agricultural and Food Chemistry,2009,58(2):770-774.
[13] Guo H,Yang X,Zhou H,et al. Comparison of nutritional composition,aroma compounds,and biological activities of two kinds of tartary buckwheat tea[J]. Journal of Food Science,2017,82(7):1735-1741.
[14] Hierro J N del,Herrera T,García-Risco M R,et al. Ultrasound-assisted extraction and bioaccessibility of saponins from edible seeds:Quinoa,lentil,fenugreek,soybean and lupin[J]. Food Research International,2018,109:440-447.
[15] Shao Y,Hu Z,Yu Y,et al. Phenolic acids,anthocyanins,proanthocyanidins,antioxidant active-ity,minerals and their correlations in non-pigmented,red,and black rice[J]. Food Chemistry,2018,239:733-741.
[16] Nowak V,Du J,Charrondière U R. Assessment of the nutritional composition of quinoa(Willd. )[J]. Food Chemistry,2016,193:47-54.
[17] Miranda M,Vega-Gálvez A,López J,et al. Impact of air-drying temperature on nutritional properties,total phenolic content and antioxidant capacity of quinoa seeds(Willd. )[J]. Industrial Crops and Products,2010,32(3):258-263.
[18] 申瑞玲,张文杰,董吉林,等. 藜麦的营养成分、健康促进作用及其在食品工业中的应用[J]. 中国粮油学报,2016,31(9):150-155.
Shen Ruiling,Zhang Wenjie,Dong Jilin,et al. Nutritional components,health promoting effects of quinoa()and its application in the food industry[J]. Journal of the Chinese Cereals and Oils Association,2016,31(9):150-155(in Chinese).
[19] Abderrahim F,Huanatico E,Segura R,et al. Physical features,phenolic compounds,betalains and total antioxidant capacity of coloured quinoa seeds(Willd. )from Peruvian Altiplano[J]. Food Chemistry,2015,183:83-90.
[20] Yuan X,Wang J,Yao H. Antioxidant activity of feruloylated oligosaccharides from wheat bran[J]. Food Chemistry,2005,90(4):759-764.
[21] Ydjedd S,Bouriche S,López-Nicolás R,et al. Effect ofgastrointestinal digestion on encapsulated and nonencapsulated phenolic compounds of carob(L. )pulp extracts and their antioxidant capacity[J]. Journal of Agricultural and Food Chemistry,2017,65(4):827-835.
[22] Ortega N,Macià A,Romero M P,et al. Matrix composition effect on the digestibility of carob flour phenols by andigestion model[J]. Food Chemistry,2011,124(1):65-71.
[23] Rodríguez-Roque M J,Rojas-Graü M A,Elez-Martínez P,et al. Soymilk phenolic compounds,isoflavones and antioxidant activity as affected bygastrointestinal digestion[J]. Food Chemistry,2013,136(1):206-212.
[24] Petry F C,Mercadante A Z. Impact ofdigestion phases on the stability and bioaccessibility of carotenoids and their esters in mandarin pulps[J]. Food & Function,2017,8(11):3951-3963.
[25] Xiao J,Kai G,Ni X,et al. Interaction of natural poly-phenols witha-amylase:Molecular property-affinity relationship aspect[J]. Molecular BioSystems,2011,7(6):1883-1890.
[26] Helal A,Tagliazucchi D,Verzelloni E,et al. Bioaccessibility of polyphenols and cinnamaldehyde in cinnamon beverages subjected togastro-pancreatic digestion[J]. Journal of Functional Foods,2014,7:506-516.
[27] 刘 冬,万红霞,赵 旭,等. 小麦不同部位在体外模拟消化过程中抗氧化活性的变化规律[J]. 现代食品科技,2016,32(4):94-99.
Liu Dong,Wan Hongxia,Zhao Xu,et al. Changes in antioxidant activity in different parts of wheat duringsimulated digestion[J]. Modern Food Science and Technology,2016,32(4):94-99(in Chinese).
Phenolic Compounds Release and Antioxidant Activity of Quinoa (Willd.)During Simulated Digestion
Li Jincai1,Liu Mengjie1,Chen Yinhuan1,Guo Huimin2,Yang Xiushi2,Ren Guixing2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300350,China;2. Institute of Crop Science,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
In order to understand how functional nutrients from the seeds of the herbaceous plant, quinoa(Willd.) are utilized in the human digestive system, we examined the release of phenolic acids, polyphenols, and flavonoids together with the bioavailability and antioxidant activity of quinoa during simulated oral, gastrointestinal, and intestinal digestion. White, red, and black varieties of quinoa were used in these experiments. Our results revealed that the release of phenolic acids, polyphenols, and flavonoids from all three varieties of quinoa increases as digestion progresses. Phenolic acids and flavonoids were mainly released during intestinal digestion, while polyphenols were primarily released during gastric digestion. Red and black quinoa varieties released more phenolic compounds as compared to the white quinoa variety (<0.05). At the completion of simulated digestion, the net release of phenolic acids, polyphenols, and flavonoids was significantly different when comparing results among white, red, and black quinoa (<0.05), and these values are 34.39, 41.73, and 51.88 mg/(100 g); 362.19, 400.40, and 436.62 mg(GAE)/(100 g); and 28.73, 48.90, and 41.24 mg(RE)/(100 g) from white, red, and black varieties, respectively. At the completion of simulated digestion, the bioavailability of phenolic acids from white, red, and black quinoa was 90.33%, 85.41%, and 91.61%, respectively and the bioavailability of polyphenols was 81.44%, 84.09%, and 78.75%, respectively. We detected no significant differences in the bioavailability of flavonoids among the three varieties of quinoa(>0.05), which were all about 20%. Likewise, the antioxidant activity (the free radical scavenging capacity of ABTS and DPPH) of each of the three varieties of quinoa also increased as digestion progressed; this activity positively correlated with the release of polyphenols(<0.01). Finally, we found higher levels of antioxidant activity in red and black quinoa compared to that detected in the white variety (<0.05). Thus, our results suggest that functional nutrients and antioxidant effects are among the benefits obtained from consumption of quinoa. Moreover, when compared to white quinoa, the consumption of red or black varieties may provide relatively higher levels of phenolic compounds and antioxidant effects.
quinoa;simulated digestion;phenolic acids;polyphenols;flavonoids;bioavailability;antioxidant activity
TS201.4
A
0493-2137(2020)08-0785-10
10.11784/tdxbz201907012
2019-07-04;
2019-10-14.
李进才(1960— ),男,博士,副教授,lijincai@tju.edu.cn. Email:m_bigm@tju.edu.cn
杨修仕,yangxiushi@caas.cn.
中秘藜麦加工技术联合研究与示范资助项目(KY201402023);现代农业创新工程资助项目(F18R02-02).
the China-Peru Joint Research and Demonstration of Quinoa Processing Technology(No.KY201402023),the Inno-vation of Modern Agricultural Project(No.F18R02-02).
(责任编辑:田 军)

