施用生物炭对东台沿海杨树人工林土壤理化性质及酶活性的影响
徐 瑾, 王 瑞, 邓芳芳, 曹国华, 王国兵
(1.南京林业大学南方现代林业协同创新中心,江苏 南京 210037;2.江苏省东台市林场,江苏 东台 224200)
生物炭是生物质在无氧或少氧的高温条件下,经热裂解炭化形成的稳定富碳固体物质;其具有超高的比表面积、发达的孔隙结构和极强的吸附性,可以改良土壤理化特性,保存土壤养分,改善土壤结构,促进作物增产[1].生物炭不仅可将C素保留,而且施入土中后可有效抑制有机质的矿化速率,增汇减排,在一定程度上减缓全球变暖的影响[2-4].因此,国内外越来越多的学者在研究生物炭在环境保护和农业生态上的应用,以期全面发挥生物炭的优势作用.
作为土壤环境中最活跃的有机组分之一,土壤酶来源于土壤中动植物和微生物细胞的分泌物及残体分解物,其中微生物是主要来源[5].土壤酶参与了有机质分解、养分循环等一系列生物化学过程,是土壤物质循环过程的主要调节者;其反映了土壤物质循环进程的强度和方向,对土壤肥力评价具有重要的指示作用[6].生物炭对土壤酶活性的影响不尽相同,据报道,有的生物炭(由花生制备)提高了小麦地表层土壤微生物的数量,增强了土壤脲酶和过氧化氢酶的活性[7];有的生物炭(由树枝条制备)可以提高壤土和砂土中与N、P循环相关的酶活性,却降低壤土中与C循环有关的酶活性[8-9].由此可见,生物炭对土壤酶活性的影响与生物炭的种类、土壤的类型都密切相关[10-11],但其具体的作用机制和途径还有待进一步深入研究.
我国杨树人工林面积广阔,但由于土壤肥力衰退、长期生产力维护等问题,人工林的产量和质量有待进一步提高,如能发挥生物炭在人工林系统的作用将产生巨大的生态经济效益.目前生物炭对农业生态系统影响的研究较为充分,而对人工林土壤酶活性的研究甚少.本研究以江苏省盐城市东台杨树人工林为试验对象,观测不同水平生物炭下土壤理化性质及酶活性的动态变化,为进一步研究生物炭对人工林土壤生态系统的影响及其科学管理提供理论依据.
1 材料与方法
1.1 试验区概况
试验区位于江苏省盐城市的东台林场(E120°49′, N32°52′).东台林场成立于1965年,是江苏省沿海重点防护林.东台林场占地约2 800 hm2,场内林地面积约2 187 hm2,森林覆盖率86%.林场靠近黄海之滨,处于亚热带和暖温带的过渡区域,为明显的过渡性海洋性和季风性气候.一年四季分明,夏秋雨量集中,日照充沛,年平均气温14.6 ℃,无霜期220 d,降雨量1 051.0 mm,年均日照时数2 169.6 h.林场整体地势平坦,土壤类型为脱盐草甸土,土壤质地为典型砂质壤土,土壤pH值约8.0.样地林分特征及部分土壤理化性质见表1.林场内树种达200种以上,主要乔木植被有人工营造的72杨(Populuseuramericanacv. I-72)、35杨(PopulusdeltoidsCL‘35/66’)、水杉(MetaseguoiaglyptostroboidesHu et Cheng)等.林下草本植物种类丰富多样,常见的有狼尾草(Pennisetumalopecuroides)、罗布麻(ApocynumvenetumL.)、刺儿菜(Cirsiumsetosum)、一年蓬[Erigeronannuus(L.) Pers.]、野蔷薇(RosamultifloraThunb.)和一些蕨类.

表1 样地林分特征及部分土壤理化性质Table 1 Structure and main soil chemical and physical properties under popular plantation
1.2 试验设置
选择东台林场中7年生杨树人工林为试验对象,株行距3 m×5 m,采用随机区组法,于林分行间带内随机布置16个2 m×2 m的试验样方,尽量保持样方的4个顶点与相邻4株杨树的距离一致,不同样方间距>5 m.设置了4个水平的生物炭施用量,分别为对照(CK,0 t·hm-2)、低施用量(T1,40 t·hm-2)、中施用量(T2,80 t·hm-2)及高施用量(T3,120 t·hm-2).本试验使用的生物炭购自南京六合木炭厂,是原木在600 ℃高温下窑制成的炭粉,生物炭属性如下:pH值9.2,C含量63.26%,N含量1.49%,P含量0.31%,K含量5.31%.于2016年8月施入生物炭,施入深度约40 cm,使用农耕机械将撒施表面后的生物炭混合,充分混合均匀后轻微压实表土以复原土位(对照组同样进行翻耕和复原土位等操作).
1.3 样品测定及计算
于2017年3月20日、6月18日、10月28日及2018年1月13日进行采样,在样方内随机选择6个点,用直径2 cm的土钻采集0~10 cm土层的新鲜土壤约800 g,装入塑料自封袋并及时放入低温保温箱带回实验室进行测定.不能立即测定的土样进行以下处理:过2 mm的土筛,去除植物根系、土壤动物、石块等杂物,存储在0~4 ℃冰箱内.
土壤含水率采用烘干称重法 (105 ℃,24 h),土壤pH值采用pH计电位法(水与土质量比为1∶2.5),土壤容重采用环刀法测定,铵态氮采用KCl浸提—靛酚蓝比色法,硝态氮测定采用酚二磺酸比色法,土壤蛋白酶、脲酶、蔗糖酶活性的测定分别采用茚三酮比色法、苯酚钠—次氯酸钠显色法、3,5-二硝基水杨酸显色法;土壤全碳、总有机碳、全氮采用元素分析仪(Vario ELⅢ,德国)测定;微生物量碳采用氯仿薰蒸浸提—TOC分析仪测定.
由于评价指标量纲的不同会对酶活性的因子荷载产生一定的影响,因此将土壤酶指标(soil enzyme index, SEI)的实测值转化为在0~1区间的数值,通过指标量纲的归一化,更加全面地显示不同时间、不同处理下土壤酶活性的整体变化规律[5].
本试验采取计算公式如下[10-11]:
SEI(xi)=(xi-ximin)/(ximax-ximin)
(1)
SEI(xi)=(ximax-xi)/(ximax-ximin)
(2)
(3)
式中,公式(1)为升型酶,(2)为降型酶的隶属度值,xi为土壤酶(i)的活性值,ximax和ximin分别表示土壤酶(i)活性的最大值与最小值,wi为权重(本试验采取主成分分析法).
1.4 数据处理
采用SPSS 16.0软件进行数据统计分析,采用重复测量方差分析法比较不同生物炭施用量处理及季节变化对土壤酶活性的影响,采用配对样本均值检验法分析不同处理之间土壤理化性质及酶活性的差异显著性,采用线性回归法分析酶活性与土壤理化性质指标的相关性.采用Origin 9.0软件绘图.
2 结果与分析
2.1 生物炭施用量对土壤理化性质的影响
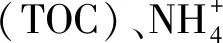
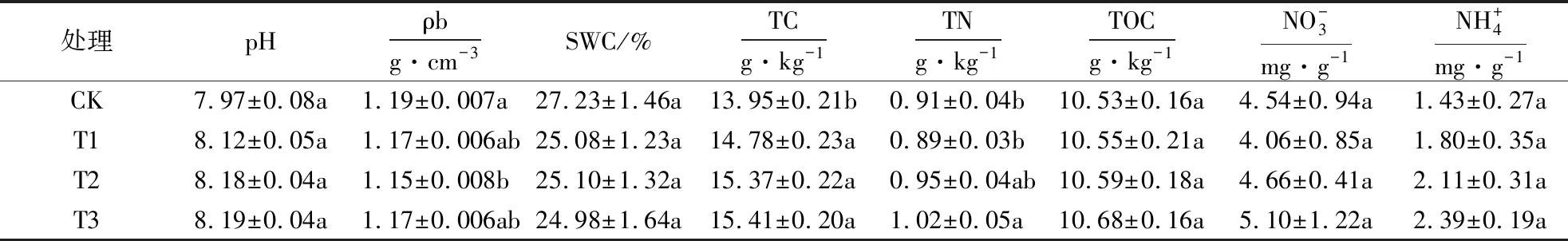
表2 施用不同量生物炭后土壤理化性质的变化1)Table 2 Changes in soil physical and chemical properties under different levels of biochar applications
1)相同字母表示不同处理的土壤之间没有显著差异;SWC:土壤含水率;TC:全碳;TN:全氮;TOC:总有机碳.
2.2 不同生物炭施用量对土壤酶活性的影响
由图1可得,土壤蛋白酶活性在夏季最高,秋季次之;除了T3处理下冬季的蛋白酶活性高于春季,其余都为春季>冬季,但春冬两季之间没有显著差异性;土壤脲酶(图2)和蔗糖酶(图3)活性的季节变化趋势较一致,具体为:秋季>夏季>春季>冬季.
施用生物炭降低了土壤蛋白酶和脲酶的活性,并且生物炭施用量越高,活性越低(图1、图2),其中高施用量下蛋白酶和脲酶的平均活性比空白对照组降低了54.1%和41.0%.T1处理降低了蔗糖酶活性(图3),降幅为11.1%,但当生物炭施用量提高到T2时,蔗糖酶活性开始升高,并且随着生物炭施用量的提高蔗糖酶活性持续升高,增幅最终可达16.1%(T3处理).
图2 生物炭施用量对土壤脲酶活性的影响
Fig.2 Effects of biochar application levels on soil urease activity
图3 生物炭施用量对土壤蔗糖酶活性的影响
Fig.3 Effects of biochar application levels on soil invertase activity
重复测量方差分析表明(表3),施用生物炭和季节变化均对土壤蛋白酶、脲酶和蔗糖酶的活性产生了显著影响(P<0.01),施用生物炭与季节之间对土壤蛋白酶和脲酶的活性产生了显著交互效应(P<0.01),但二者对蔗糖酶活性不存在交互效应(P>0.05).
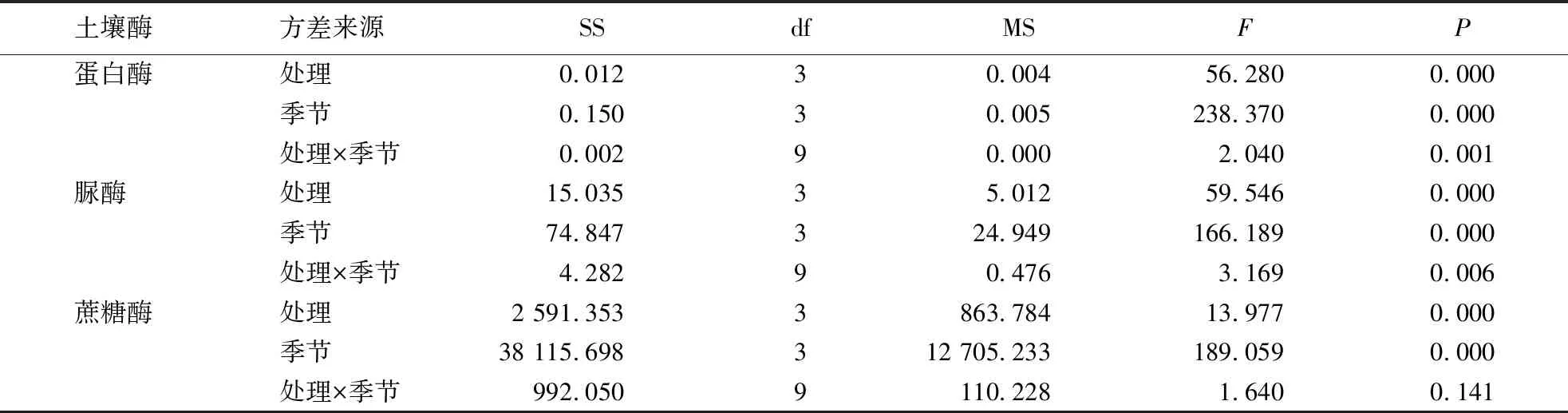
表3 施用生物炭对土壤3种酶活性影响的重复测量方差分析1)Table 3 Repeated measures ANOVA of 3 soil enzyme activities with different biochar applications
1)P<0.01水平上有极显著影响;P>0.05没有显著影响.
2.3 生物炭施用量对土壤酶指数的综合影响
酶指标可以更加直观、全面地反映了不同水平的生物炭对土壤酶的影响.由图4可得,施用生物炭降低了土壤酶指标,随着浓度升高,土壤酶指标逐渐降低,TI、T2、T3分别比对照组降低了32%、34%、38%;秋季的土壤酶指标最高,其次是夏、春、冬季.
2.4 土壤酶活性与主要土壤理化性质的关系
3 讨论与结论
3.1 生物炭对土壤物理性质的影响
土壤的物理性质(土壤结构、水力表现、热力性质等)与土壤的化学性质(土壤离子交换能力、酸碱度等)是紧密相连的,同时也直接或间接地改变土壤养分的贮存、转化及微生物群落的活动[10-11].一般认为生物炭通过改善土壤理化及生物学特性提高土壤肥力,增加农作物产量[14].本试验中生物炭的施用降低了土壤容重,这与砂壤土(大豆玉米地)中施用生物炭后土壤容重变化趋势一致[15].这是由于生物炭稳定的多孔结构提高了土壤空隙,使土壤形成稳定的团聚体,降低了土壤的容重[15].其中中等水平生物炭的降低效果最为明显,可能是由于在土壤水吸力一定的情况下,容重的降幅是有限的;当生物炭持续升高,其对原土壤空隙的影响愈发强烈,土壤持水性能反而从饱和开始降低,土壤容重随之升高[16].本试验中土壤pH值和含水率的变化并不明显(表2):pH值略有升高(P>0.05),这与澳大利亚两种农业土壤(红壤与碱性土壤)施用生物炭后pH值变化基本一致[17];土壤含水率降低了(P>0.05),这与玉米大豆地(砂壤土)中施用生物炭后含水量的变化相反[17].土壤的保水能力主要由土壤比表面积决定,虽然生物炭的多孔结构和团聚体提高了土壤比表面积,但这也可能不足以抵消原土壤结构破坏而减少的比表面积,因此施入生物炭也可能降低土壤的含水量[18].并且生物炭对不同土质的影响略有不同,质地较轻的土壤反而会因为施用生物炭而降低通透性,以抑制水分生物的入渗,含水量随之降低[16].
表4 土壤酶活性与主要土壤性质的相关性分析1)Table 4 Relationships between soil enzyme activities and main soil properties
1)**P<0.01水平上的极显著性;*P<0.05水平上的显著性.
3.2 生物炭对土壤化学性质的影响

3.3 生物炭对土壤酶活性的影响和机理
本试验中,低水平的生物炭降低了蔗糖酶活性,而中高水平的生物炭却能提高酶活性,可能是因为低水平的生物炭不仅会吸附可溶性有机质,还降低了难溶性碳物质的分解速率,使可利用的溶解性物质减少,蔗糖酶的生物过程减缓,酶活性降低.随着生物炭施用量的提高,可溶解性有机质含量随之升高,同时生物炭还能大量分解碳物质,为土壤微生物提供更丰富的营养来源,促进微生物量碳激增,蔗糖酶活性提高,因此蔗糖酶与土壤微生物量碳呈显著正相关(表4)[21-22].
本试验中,施用生物炭后土壤酶指标下降,同时随着生物炭施用量的升高,土壤蛋白酶和脲酶的活性呈现持续降低趋势,这与小麦根际土壤蛋白酶活性和华北小麦玉米轮作农田施用生物炭后脲酶活性的变化趋势相反[19,23].可能是由于生物炭的富碳性提高了土壤的碳氮比,在没有其他外源氮输入的情况下,生物炭的施用量越大,动植物和微生物会对氮素的竞争越激烈,所以降低了微生物的数量和活性.同时由于生物炭对养分及反应底物的吸附,不仅限制了酶对底物的接触,也对酶促反应的结合位点形成保护,最终抑制酶促反应的进行[24-25].周礼恺[6]提出了脲酶活性与微团聚体的关系,即随着微团聚体粒径的升高,脲酶活性呈下降趋势.由于生物炭结构、性质和酶分子构造的复杂性,土壤酶的种类、数量及生物炭施用的时间长短都可能影响酶指标,我们应该从长远的角度综合考虑酶指标的变化,以进一步深入探究其作用机理和方式.
综上所述,在杨树人工林中,施用生物炭能够改良土壤基本的理化性质,降低土壤蛋白酶和脲酶的活性,而中高水平的生物炭可以促进土壤蔗糖酶的活性.鉴于酶活性与一些土壤理化性质的显著相关性,推测生物炭可能通过改变这些理化特性以影响土壤酶活性.

