响应面法优化提取苦豆子生物碱及其抑菌性
王福玲
1. 哈尔滨商业大学药学院(药物工程技术研究中心)(哈尔滨 150076);2. 哈尔滨商业大学药学院,细胞与分子生物学研究所(哈尔滨 150076)
苦豆子(Sophora alopecuroidesL.)系豆科槐属多年生草本植物,别名草本槐、苦豆草、苦甘草、苦豆根等。全株性寒,味极苦。主要分布于我国西北地区[1],是一种分布量大的野生荒漠植物,不仅具有耐盐碱、耐干旱等环境保护性质,还具有清热解毒、祛风燥湿、止痛杀虫等药理活性。全草、根、茎及种子都可入药[2]。含有苦参碱、氧化苦参碱、槐果碱、槐果碱等20多种生物碱,其中含量较高的为喹诺里西啶结构的槐果碱。苦豆子生物碱不仅具有抗癌和杀灭各种微生物的药理活性,而且对神经系统、免疫系统、心血管系统有广泛的药理作用[3]。
1 材料与仪器
苦豆子购于泽林大药房,产地为内蒙,由哈尔滨商业大学药学院张德连教鉴定为豆科槐属植物苦豆子(Sophora alopecuroidesL.)的成熟种子,经粉碎过40目筛备用。槐果碱标准品(HPLC≥98%,批号151127,四川省维克奇生物科技有限公司);溴麝香草酚蓝(天津市东丽区天大化学试剂);无水乙醇、氯仿等试剂均为国产分析纯。
金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌由哈尔滨商业大学药学院保存。
KQ32000V数控超声波清洗器(昆山市超声仪器有限公司);高速万能粉碎机(上海一恒科学仪器有限公司);LD4-2A低速离心机(北京医用离心机厂);BSA224S精密电子天平(Sartorius);DB-20R紫外可见分光光度计(Dynamica)。
2 方法
2.1 苦豆子生物碱提取工艺流程
苦豆子粉→加入提取溶剂(乙醇)→超声波提取→离心(3 000 r/min,10 min)→上清液(粗提液)
2.2 标准曲线的绘制[4]
称取10 mg槐果碱标准品,置10 mL容量瓶,加无水乙醇溶解并稀释至刻度,摇匀得槐果碱标准液。取0,10,20,30,40和50 μL上述溶液,分别置于50 mL的磨口锥形瓶中,乙醇挥发后,加6 mL溴麝香草酚蓝pH 7.6缓冲液、6 mL氯仿,加塞剧烈振摇2 min,静置2 h后分出氯仿层,同法处理无槐果碱液为空白,在420 nm处测定吸光度,以吸光度(A)为纵坐标,氯仿层标准品浓度(C)为横坐标,绘制回归方程。
2.3 苦豆子生物碱得率测定
超声提取后将提取液过滤,提取液用无水乙醇稀释50倍,定容于50 mL容量瓶中,吸取1 mL稀释液至锥形瓶中,按2.2项下方法操作,对照标准曲线,得出提取液中生物碱的浓度,计算得率[5]。

2.4 单因素试验
称取苦豆子粉各2.000 g,以乙醇溶液为溶剂,分别考察乙醇体积分数(55%,65%,75%,85%和95%)、料液比(1∶8,1∶12,1∶16,1∶20,1∶24 g/mL)、超声提取时间(10,20,30,40和50 min)等因素对苦豆子生物碱得率的影响。
2.5 响应面法优化苦豆子生物碱提取工艺
在单因素试验结果的基础上,进行Box-Behnken中心组合试验,以苦豆子总碱得率为响应值,通过响应面分析,来确定提取苦豆子生物碱的最佳提取条件。
2.6 苦豆子生物碱的抑菌性测定
2.6.1 滤纸片法测定生物碱的抑菌圈
无菌环境下,将活化好的菌种浓度稀释到105CFU/mL。将生物碱浸膏配制成20 mg/mL质量浓度的溶液,以无菌水为对照[6]。分别用移液枪吸取150 μL菌悬液,涂布在标记好的固体平板培养基上,再取浸有生物碱的无菌滤纸片贴在含菌平板上,重复操作3次。置37 ℃恒温培养箱中培养24 h后,测量各个抑菌圈直径,计算平均值。
2.6.2 最低抑菌浓度(MIC)的测定
将20 mg/mL苦豆子生物碱溶液加入到96孔板第一行中,用倍比稀释法使其每一列质量浓度为20,10,5,2.5,1.25,0.625,0.312 5和0.156 25 mg/mL。以不含生物碱的菌液孔作对照,96孔板的其余列分为3个部分,分别加入100 μL的金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌菌液。置37 ℃恒温培养箱中过夜培养,观察溶液的澄清度,确定苦豆子生物碱对3种菌的最低抑菌浓度[7]。
3 结果与讨论
3.1 标准曲线的制备
图1为槐果碱标准曲线,线性回归方程y=0.099 5x+0.013 3,相关系数r=0.999 5。在0~8.33 μg/mL范围内,浓度与吸光度线性关系良好。
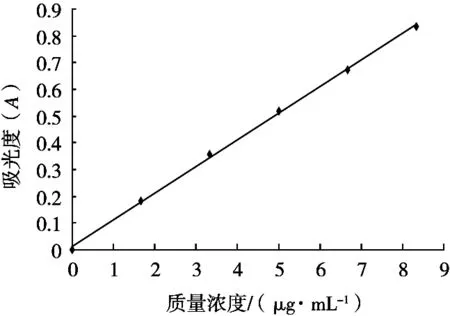
图1 槐果碱标准曲线
3.2 单因素试验
3.2.1 乙醇体积分数对苦豆子生物碱得率的影响
由图2可知,随着乙醇体积分数的增加,苦豆子生物碱得率先上升后下降。可能是乙醇体积分数过大,不利于水溶性生物碱的溶出,提取液极性过低会导致总生物碱得率下降。
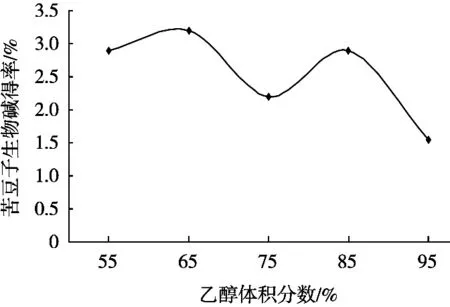
图2 乙醇体积分数对生物碱得率的影响
3.2.2 料液比对苦豆子生物碱得率的影响
由图3可知,随着料液比的增加,苦豆子生物碱得率逐渐增大,然后稍有下降。说明苦豆子生物碱在料液比为1∶16(g/mL)左右时得率达到最大,再增加提取液的体积造成溶剂的浪费。
3.2.3 超声时间对苦豆子生物碱得率的影响
由图4可知,随着提取时间的增加,苦豆子生物碱得率缓慢增加,然后略有下降。说明在30 min时苦豆子生物碱已经基本提取完全,延长时间可能会导致生物碱分解,使得率下降。
3.3 优化试验及响应面分析
以-1,0,1分别代表自变量的低、中、高水平,因子编码及水平见表1,不同条件下苦豆子生物碱的得率见表2。
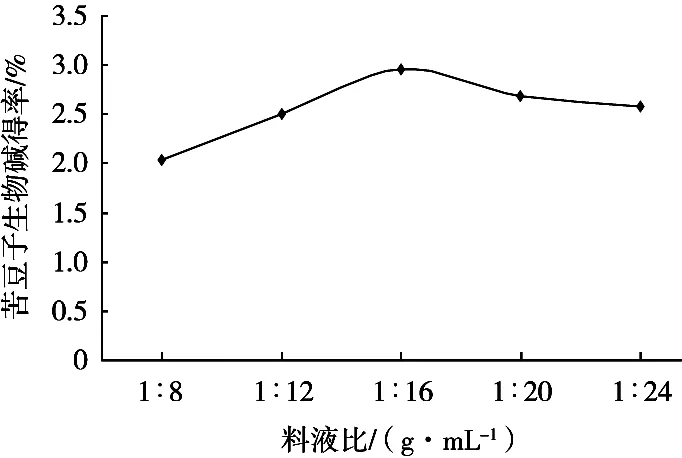
图3 料液比对生物碱得率的影响

表1 响应面试验因素水平编码表
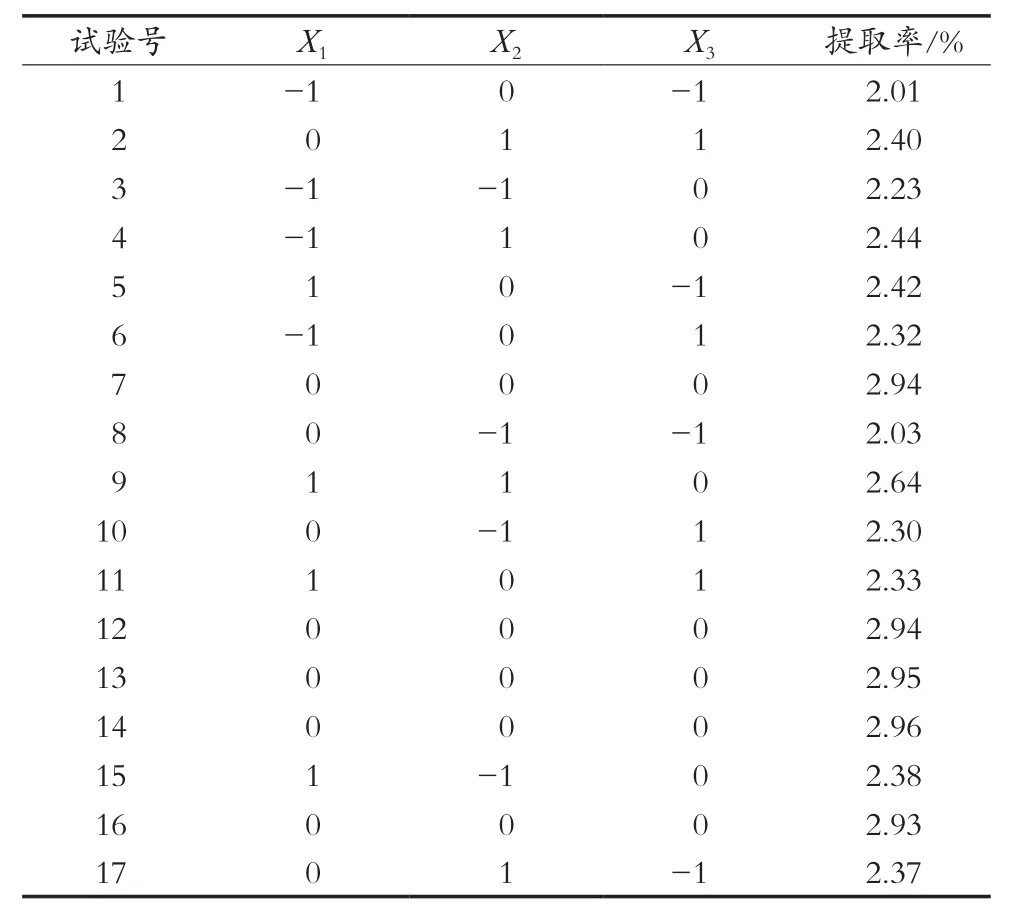
表2 响应面试验设计与结果
应用Design Expert 8.0.7.1软件对表2中的数据进行多元回归拟合,可以得到苦豆子生物碱得率(Y)对各个因素变量的二次方程为:Y=2.94+0.096X1+0.11X2+,对回归方程进行方差分析,结果见表3。
由表3可知:模型的p<0.000 1,说明试验所选用的模型具有显著性。失拟项F=3.91,失拟不显著。模型的决定系数R2Adj=0.997 2,说明该模型能解释99.72%的响应值变化,模型确定系数R2=0.998 8,R2Pred=0.985 1,说明此模型拟合度较为良好[8],可以对不同条件下苦豆子生物碱得率进行预测。由F值可知,显著性次序为料液比(X2)>乙醇体积分数(X1)>超声时间(X3)。
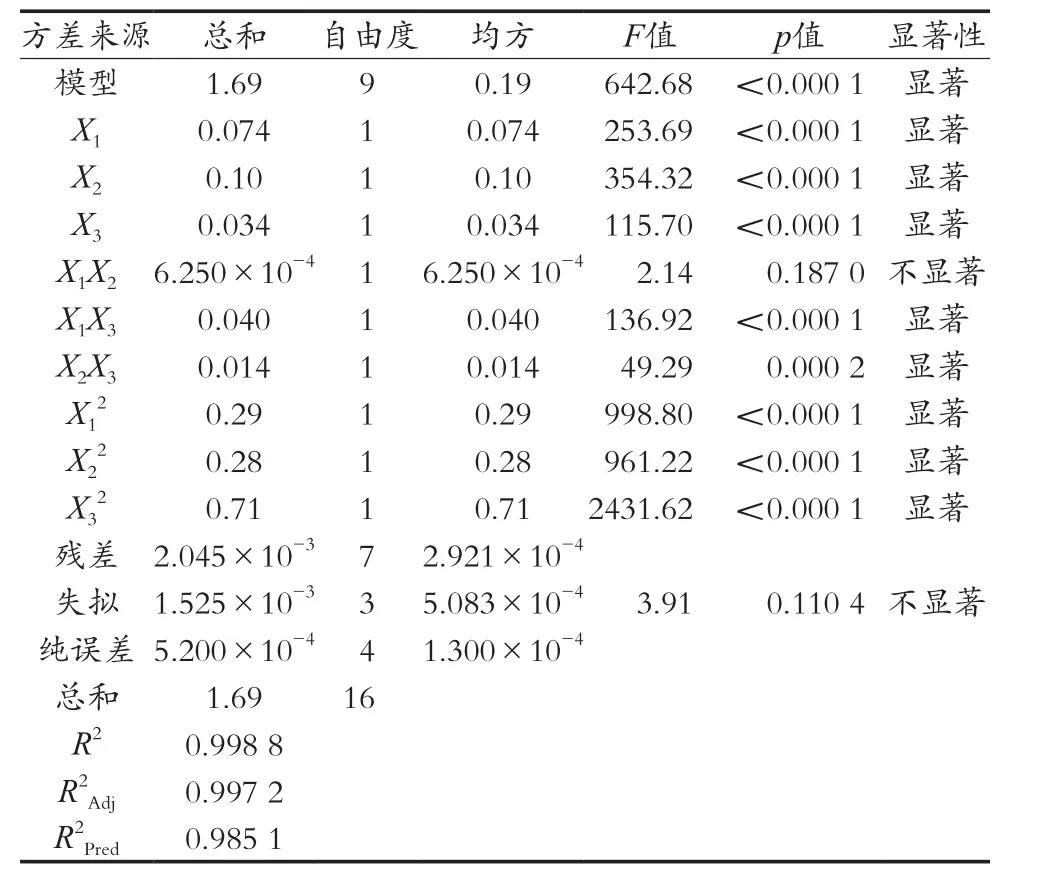
表3 回归方程方差分析表
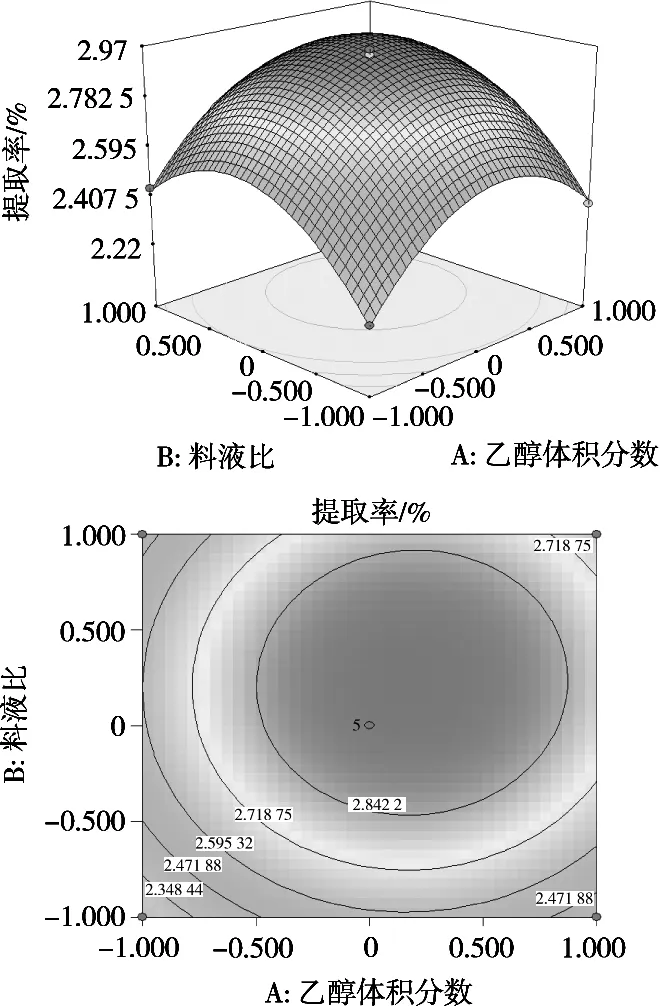
图5 Z=f(X1,X2)的响应面与等值线
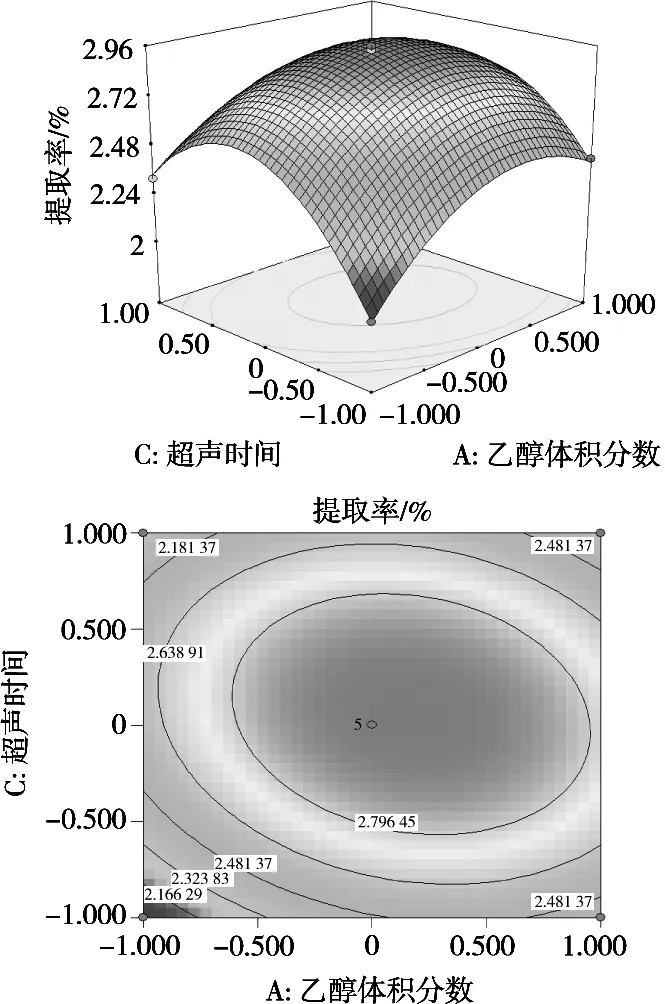
图6 Z=f(X1,X3)的响应面与等值线
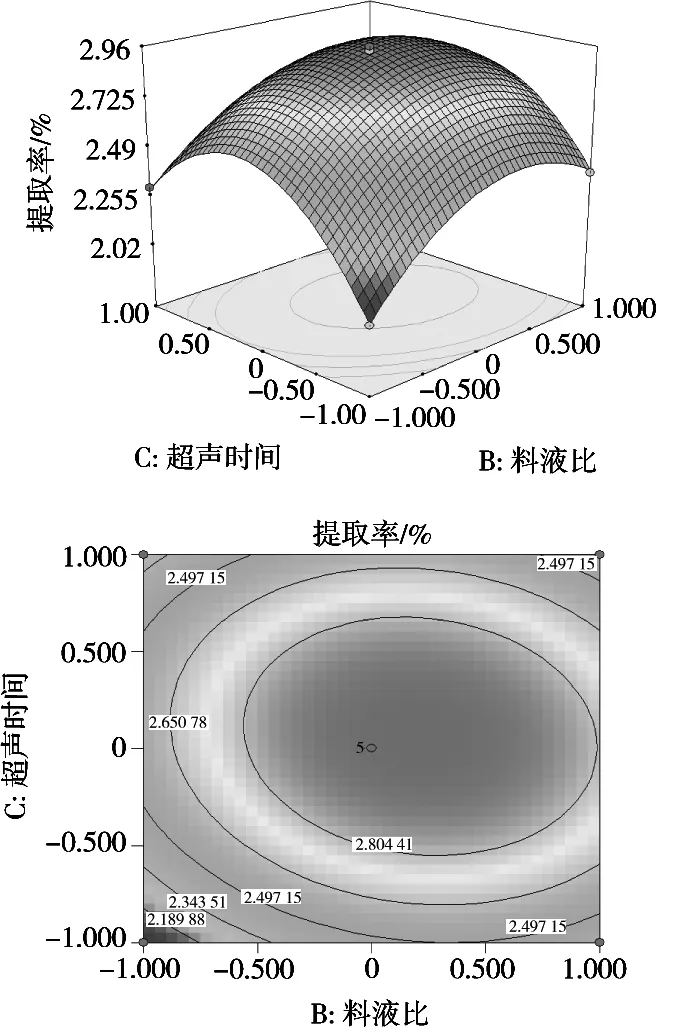
图7 Z=f(X2,X3)的响应面与等值线
应用Design Expert 8.0.7.1软件绘出响应面图及等高线进行分析。图5~图7显示3组试验参数以苦豆子生物碱得率为响应值的趋势图,等高线可以更加直观地反映出两个变量的情况。乙醇体积分数和超声时间的交互作用,以及料液比和超声时间的交互作用对苦豆子生物碱的得率影响显著,乙醇体积分数和料液比之间的交互作用不显著。
根据响应曲面模型求出最优组合,并综合响应曲面图分析,得到苦豆子总碱的最佳提取工艺参数:乙醇体积分数66.79%、料液比1∶16.88(g/mL)、超声时间30.41 min。
3.4 验证试验
考虑到实际操作的方便,将提取工艺参数修正为:乙醇体积分数67%、料液比1∶17(g/mL)、超声时间30 min。试验重复3次。在此条件下,实际测得的得率为2.96%,与理论预测值2.97%基本一致。说明能够真实反映筛选因素对苦豆子生物碱得率的影响。
3.5 苦豆子生物碱的抑菌性结果
由表4可知,苦豆子生物碱对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有一定的抑制作用,其中对枯草芽孢杆菌的抑制作用较强。

表4 苦豆子生物碱抑菌试验结果(n=3,x±s)
4 讨论与结论
我国苦豆子资源极其丰富,具有药用及生态双重价值。为了深入研究,应当采用适当的溶剂和方法,将中药材中目标成分尽可能多地从植物组织中溶出转移。超声波在液体中高频振动产生的“空化效应”,可以破坏细胞组织,有助于有效成分的溶出,操作简单,提取时间短,得率高,降低了过程能耗,有着其他传统提取方法不可比拟的优势。响应面法(RSM)通过数学模型解决受多种因素影响的各因素及它们之间的交互作用对响应值产生的影响,常用于优化有效成分的提取工艺组合[9],优于只能分析离散条件的正交试验设计。由于苦豆子中含有喹诺里西啶类生物碱,有一定的水溶性,用氯仿难以提取完全,使测定结果偏低。因此,试验采用溴麝香草酚蓝为酸性染料的紫外分光光度法测定生物碱得率。可以较好地保证测定结果的重现、稳定和准确可靠,此外溴麝香草酚蓝缓冲液最好现用现配。
试验采用超声辅助有机溶剂法提取苦豆子中总生物碱,根据酸性染料紫外分光光度法测定的得率,通过响应面法中的Box-Behnken模式优化确定超声辅助提取的最佳工艺参数,并测定其体外抑菌活性,为苦豆子的进一步开发利用提供依据,也为苦豆子生物碱的抗肿瘤、抗菌等药理活性的研究提供理论基础。

