双重动态化学键交联水凝胶的制备及性能
童艳萍, 肖 艳
(华东理工大学材料科学与工程学院,上海 200237)
水凝胶的结构是一种含有大量水的三维网络,因与生物体软组织在结构上有许多相似之处而在生物医学领域得到了广泛的研究和应用[1]。传统水凝胶通过化学键或物理相互作用进行交联,其交联点和三维网络结构相对固定,这不仅限制了细胞和营养物质在水凝胶内部的迁移和扩散,而且还会因外力作用导致凝胶结构产生不可恢复的变化[2]。采用可逆动态化学键构建的具有可注射和自修复特点的水凝胶已成为目前研究的热点。Yang 等[3]基于动态酰腙键制备了一种新型纤维素基水凝胶,由于酰腙键和二硫键的可逆性,所得水凝胶具有良好的自修复和可注射性能,可用作小鼠胚胎成纤维细胞(NIH/3T3)培养和阿霉素的控制释放。但目前报道的水凝胶自愈合大多不可自主修复,需要适当的外部刺激或额外添加交联剂、催化剂等,限制了其在生物医学领域的应用[4]。因此寻找一种温和条件下的动态化学键来构筑自发自愈合水凝胶是目前该领域亟待解决的难点。
近年来,由于天然高分子凝胶材料具有生物相容性、生物可降解性等性能,其研究和开发日益引人注目[5]。天然高分子主要包括海藻酸盐、纤维素、壳聚糖、淀粉、蛋白质等,其中基于天然蛋白质和多糖构筑的水凝胶因具有与由各种氨基酸和糖类大分子组成的细胞外基质相似的性质[6],在生物医用领域受起了广泛关注。然而,天然大分子的成分通常由其来源决定,含有的官能团也比较单一,难以适应各种应用需求[7]。聚肽具有和天然蛋白质相似的结构,能通过合成技术对聚肽的序列进行精确控制[8,9]以及对侧链进行修饰[10]以制备高性能的聚合物,拓展了其在水凝胶领域的应用[11-13]。
本文以具有良好生物相容性的聚肽-聚类肽共聚物和多糖为原料制备了基于亚胺键和酰腙键这两种动态化学键的自交联水凝胶。首先,巧妙地设计了共聚物聚(肌氨酸-co-谷氨酸苄酯)(P(Sar-co-BLG)),通过氨解反应得到水溶性良好的聚(肌氨酸-co-谷氨酸酰肼)(P(Sar-co-GH));然后,P(Sar-co-GH)的酰肼键可与氧化海藻酸钠(OSA)的醛基形成酰腙键,带有氨基的羧甲基壳聚糖(CMC)与OSA 的醛基形成亚胺键,且酰腙键和亚胺键均可在温和的条件下形成;最后,通过简单混合前驱体溶液快速得到P(Sar-co-GH)-OSA-CMC 水凝胶。双重动态化学键的存在赋予了水凝胶良好的注射性、pH 响应性、自修复性和良好的力学性能。体外细胞毒性实验和细胞培养结果表明,该水凝胶对细胞无毒并能促进其生长与繁殖,有望应用于组织工程、细胞培养、药物可控释放等领域。
1 实验部分
1.1 原料和试剂
肌氨酸、L-谷氨酸苄酯、高碘酸钠(NaIO4)、亮蓝、苋菜红:分析纯,上海阿拉丁生化科技股份有限公司;乙酸乙酯、四氢呋喃、正己烷、N,N-二甲基甲酰胺(DMF):分析纯,使用氢化钙干燥并减压蒸馏后使用,上海泰坦科技股份有限公司;正己胺:分析纯,TCI(上海)化成工业发展有限公司;海藻酸钠(200~500 MPa·s)、无水乙醚、氢化钙:分析纯,国药集团化学试剂有限公司;三光气、水合肼、α-蒎烯、(+)-柠檬烯、无水乙醇、硫酸(w=95%~98%)、盐酸(w=36%~38%)、三乙胺(TEA)、盐酸羟胺、氢氧化钠:分析纯,上海泰坦科技股份有限公司;CMC:羧化度80%,上海源叶生物科技有限公司;磷酸盐缓冲溶液(PBS):c=10 mmol/L,pH=7.4,HyClone 公司; CCK-8 试 剂:分 析纯,Sigma-Aldrich 试剂公司; α-MEM 培养基、双抗(青 链霉素混合液):分析纯,赛默飞世尔科技(中国)有限公司;Calcein-AM/PI 染色剂: 分析纯,元升生物科技(上海)有限公司。
1.2 实验步骤
1.2.1 P(Sar-co-GH)的合成[14]聚合所需的单体肌氨酸-N-羧酸内酸酐(Sar-NCA)与谷氨酸苄酯-N-羧酸内酸酐(BLG-NCA)参照文献[14]的步骤制备。在通氩气下称取1.42 g(12.3 mmol)的Sar-NCA 与867 mg(3.29 mmol)BLG-NCA 溶解于20 mL 无水DMF 中,待溶解后加入的1.38 mL 正己胺的DMF 溶液 (59.5 mmol/L)。将容器密封并在室温下搅拌72 h,将聚合物在无水乙醚中沉降并离心(8 000 r/min,5 min),使用超声将沉淀物重新悬浮在新的无水乙醚中,离心和悬浮的过程重复3 次。最后将共聚物在真空下干燥至恒重,得到P(Sarco-BLG)。称取一定量的P(Sar-co-BLG)溶解于DMF 中,然后加入共聚物质量20 倍的水合肼(w = 80%)[15],在40 ℃下反应48 h,将产物用截留分子量为7 000 的透析袋在去离子水中透析3 d,将透析液冷冻干燥3 d,冻干后得到的白色絮状物即为P(Sar-co-GH),产物于低温干燥处保存备用。电导滴定仪[16]测得其含有酰肼基团(2.43 ± 0.31) mmol/g。
1.2.2 OSA 的制备[17]以乙醇溶液(φ=0.5)为溶剂,将5 g 海藻酸钠分散在50 mL 乙醇溶液中。然后将NaIO4(其物质的量是海藻酸钠糖单元的0.5 倍)溶于50 mL 去离子水中,并加入海藻酸钠的乙醇溶液中,在黑暗环境下于25 ℃搅拌6 h 后,用过量的乙二醇(―OH 与NaIO4的物质的量之比为3∶1)淬灭0.5 h 后,立即将反应液装入透析袋(截留分子量为14×103)中,于去离子水中透析5 d。最后收集透析液并冻干,得到最终的纯化产物OSA。OSA 的氧化度采用盐酸羟胺滴定法[18]测定,每个样品滴定3 次,测得醛基含量为(4.47 ±0.23) mmol/g,实际氧化度为(44 ± 2)%。
1.2.3 水凝胶的制备 称取一定量的P(Sar-co-GH)和CMC 溶解在PBS 中形成溶液,称取OSA 溶解在PBS中形成溶液。将两种溶液混合均匀,得到P(Sar-co-GH)-OSA-CMC 水凝胶。其中OSA 中的醛基(―CHO)物质的量与P(Sar-co-GH)中的酰肼基团(―CONHNH2)、CMC 中的氨基(―NH2)物质的量之和相等,水凝胶的总质量分数设定为7%。定义R1=n(―CONHNH2)/n(―CHO),R2=n(―NH2)/n(―CHO)。CMC 中氨基的含量根据文献[19]进行滴定,每个样品重复测定3 次取平均值,计算得到氨基的含量为(1.21 ± 0.18) mmol/g。
1.2.4 水凝胶中的细胞培养 将P(Sar-co-GH)和CMC 的PBS 溶液与OSA 的PBS 溶液使用紫外光灭菌30 min (设定R1=R2=0.5)。向24 孔板中加入20 μL NIH/3T3 细胞(1 mL 溶液中约含1×107个细胞),然后再将P(Sar-co-GH)和CMC 的PBS 溶液和OSA 的PBS 溶液分别加入孔板中混合均匀制得载有细胞的水凝胶,于培养箱中培养15 min 后,加入2.5 mL α-MEM 培养基,之后在37 ℃、体积分数为5% CO2的培养箱中培养24、48 h,观察细胞生长情况。观察时加入200 μL 死/活细胞染色剂Calcein-AM/PI 染色30 min,然后用荧光倒置显微镜观察细胞生长情况。
1.3 表征
核磁共振波谱仪(瑞士布鲁克公司AVANCE Ⅲ型):将P(Sar-co-BLG)溶于氘代二甲基亚砜(DMSO-d6)中,经400 MHz 核磁共振波谱仪于25 ℃测试; 将P(Sar-co-GH)溶于氘代三氟乙酸(CF3COOD)中,经500 MHz核磁共振波谱仪于25 ℃测试;傅里叶变换红外光谱仪(美国热电公司Nicolet 6700 型):使用溴化钾压片法,光谱范围4 000~500 cm−1;凝胶渗透色谱仪(美国沃特世有限公司Waters 1515 型):以聚甲基丙烯酸甲酯(PMMA)为标样、DMF 为流动相溶剂;电导滴定仪(中国禾工科学仪器有限公司 AT-6 型):以0.1 mol/L NaOH溶液作为滴定液,每个样品测3 次取平均值;旋转流变仪(美国Thermo Hakke 公司MARS Ⅲ型):采用变频扫描模式,固定应变为1%,频率范围为0.1~10 Hz,相应的强度测试(储能模量(G′)和损耗模量(G′′))采用厚度为1.5 mm、直径为20 mm 的圆盘形试样;荧光倒置显微镜(日本尼康公司Eclipse Ti-S 型):细胞经死/活细胞染色剂染色后于不同激发光下观察形貌;酶标仪(美国伯乐公司Bio-Rad 550 型):测试各样品在450 nm 处的吸光度。
1.4 性能测试
1.4.1 水凝胶的注射性能 选择R1=R2=0.5 的P(Sar-co-GH)-OSA-CMC 水凝胶作为实例。水凝胶前驱体溶液使用苋菜红进行染色,将其装入带有23 G 针头的5 mL 注射器中。注射时推动注射器活塞在板上书写字母。
1.4.2 水凝胶的自修复性能 将由苋菜红和亮蓝染色的2 个圆盘状水凝胶(R1=R2=0.5)分别切成两半。随后,将2 个不同颜色的半圆放在原始模具中(直径35 mm),并在室温下湿润环境中放置12 h。肉眼直接观察判断P(Sar-co-GH)-OSA-CMC 水凝胶是否具备自愈合能力。
1.4.3 水凝胶的pH 响应性 取2 g P(Sar-co-GH)-OSA-CMC 凝胶(R1=R2=0.5)并用亮蓝染色以便更好地观察。对于凝胶-溶胶转变,加入80 μL 盐酸(6 mol/L)处理水凝胶;对于溶胶-凝胶转变,用65 μL TEA 处理溶胶以中和酸,此过程重复数次。
1.4.4 细胞活性 将共聚物的PBS 溶液经0.22 μm 滤膜过滤除菌。将NIH/3T3 接种到96 孔板中(1 mL 溶液中约含1×105个细胞),然后在培养箱中培养24 h 至细胞贴壁。将培养液取出并加入不同浓度的聚合物溶液继续培养24 h 后,向每孔中加入20 μL CCK-8 溶液以及200 μL α-MEM 培养基,培养1.5 h 后每孔取50 μL 溶液用酶标仪在激发波长450 nm 处测吸光度(ODSample)。未加聚合物的培养基为控制组,所测得的吸光度为ODControl,细胞活性即为ODSample与ODControl的比值。
1.4.5 细胞毒性 将冻干的水凝胶(R1=R2=0.5)样品经紫外灯照射30 min 除菌后,按水凝胶与培养基的体积比为1∶10 浸入α-MEM 完全培养基中,在37 °C 浸泡72 h 制得水凝胶的浸提液。将NIH/3T3 接种到96 孔板中,并在水凝胶浸提液中培养24、48、72 h 后测定吸光度并计算细胞活性。
2 结果与讨论
2.1 水凝胶的结构表征
图1(a)为P(Sar-co-BLG)的核磁共振氢谱图,a 峰是引发剂正己胺的端甲基质子峰,c 峰是肌氨酸链段上氮原子上的甲基峰,g 峰对应着苄基上亚甲基质子峰,h 峰对应着苄基的苯环质子峰。P(Sar-co-BLG)的聚合度可以通过各峰的积分面积比算出,设计Sar 与BLG 的聚合度分别为150 和40,产物标记为P(Sar150-co-BLG40),经核磁算出Sar 与 BLG 的实际聚合度为151 和38。图1(b)为P(Sar-co-GH)的核磁共振氢谱图,与P(Sar-co-BLG)相比,对应着苄基上亚甲基质子的g 峰和苯环的h 峰已完全消失,说明苄基已完全脱除。
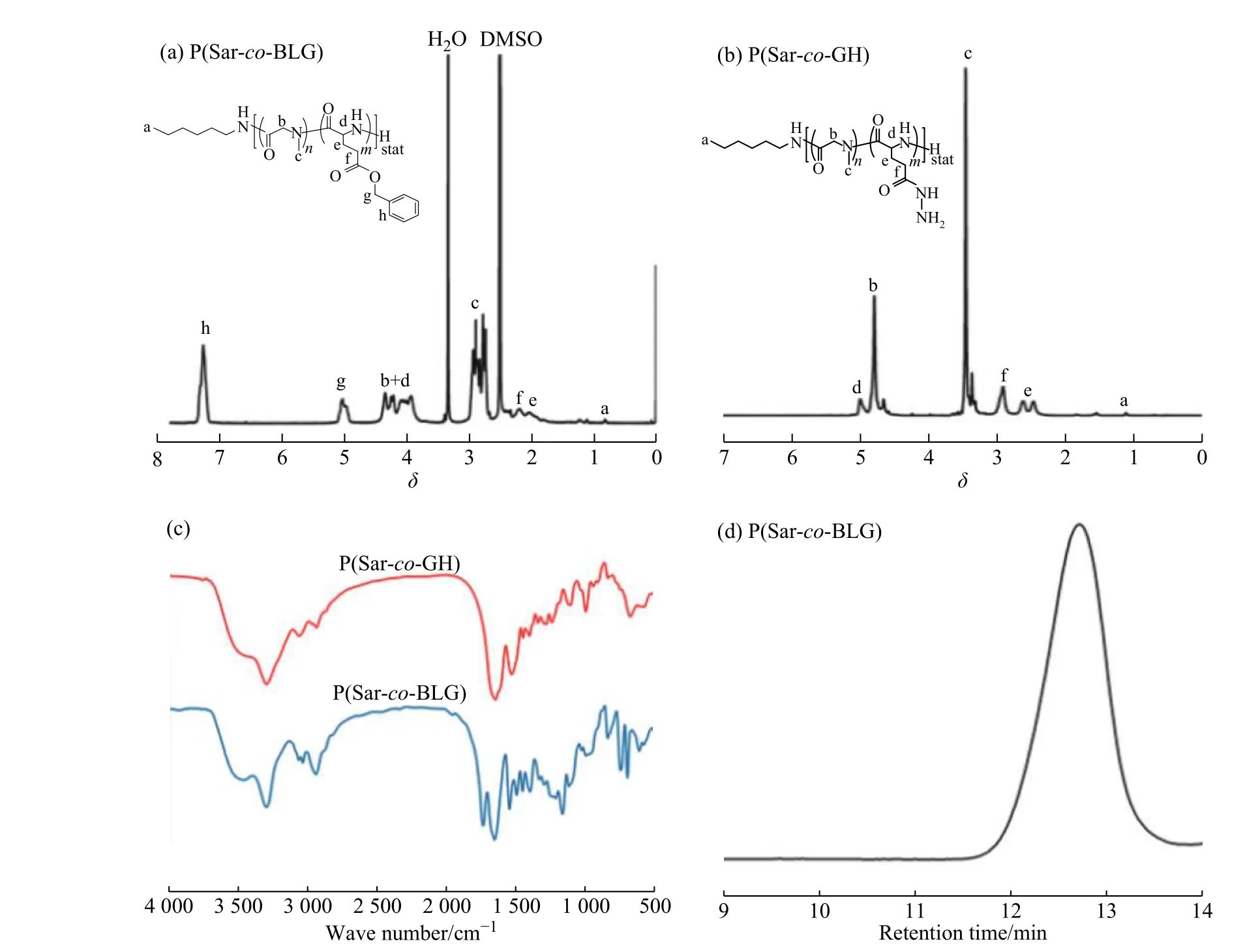
图 1 P(Sar-co-BLG)(a)与P(Sar-co-GH)(b)的核磁共振氢谱图;(c)P(Sar-co-BLG)和P(Sar-co-GH)的红外谱图;(d)P(Sar-co-BLG)的GPC 曲线Fig. 1 1H-NMR spectra of P(Sar-co-BLG) (a) and P(Sar-co-GH) (b); (c) FT-IR spectra of P(Sar-co-BLG) and P(Sar-co-GH); (d) GPC curve of P(Sar-co-BLG)
通过对比P(Sar-co-BLG)和P(Sar-co-GH)的红外谱图(图1(c))可以看出,P(Sar-co-BLG)的红外谱图上位于1 737 cm−1处谷氨酸苄酯单元上苄酯的羧羰基(C=O)伸缩振动峰消失,746 cm−1及698 cm−1处的单取代苯环特征峰也消失,而P(Sar-co-GH)红外谱图中1 649 cm−1及1 525 cm−1处出现了酰肼C―N 振动信号峰,这些峰的变化证明了苄基的脱除以及酰肼键的形成,说明已成功合成P(Sar-co-GH)。
P(Sar-co-BLG)的GPC 曲线(图1(d))呈现单峰且服从正态分布,说明制得相对均一的P(Sar-co-BLG),且其合成过程可控。GPC 测得数均分子量为1.32×104,分子量分布(1.14)较窄。
2.2 水凝胶的形成机理及性能测试
2.2.1 水凝胶的形成机理 水凝胶的制备如图2(a)所示,通过小瓶倒置法[20]确认已形成P(Sar-co-GH)-OSACMC 水凝胶。在生理pH 和室温下,将OSA 的PBS 溶液与P(Sar-co-GH)和CMC 的PBS 溶液均匀混合后,在不到30 s 内,小瓶子里的流体混合物即转化为稳定的凝胶态,其成胶机理图如图2(b)所示。
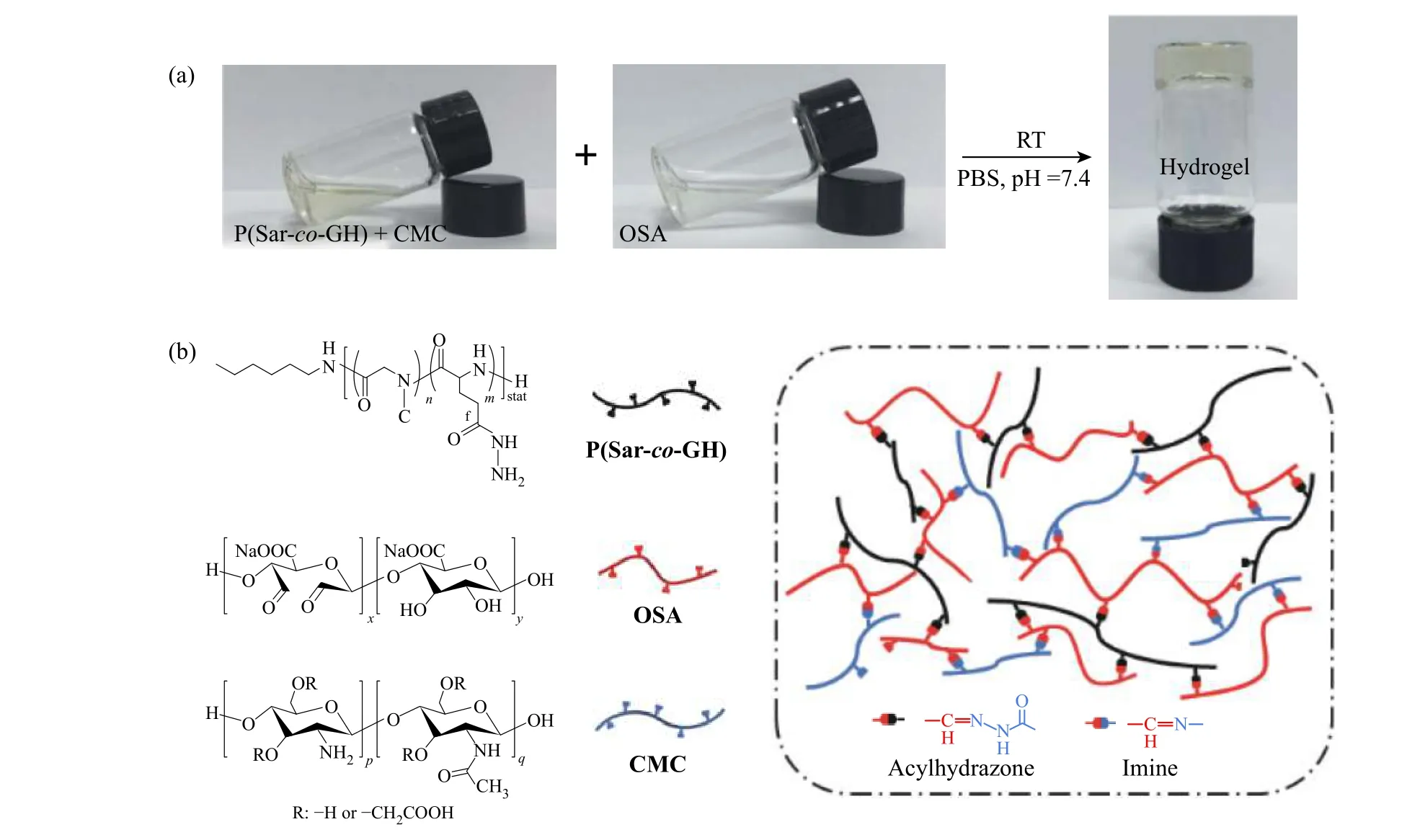
图 2 水凝胶的(a)制备与(b)成胶机理Fig. 2 (a) Preparation and (b) gelation mechanism of the hydrogels
水凝胶样品的红外光谱如图3 所示。OSA 在1 727 cm−1处的醛基(C=O)对称伸缩振动吸收峰在冻干的P(Sar-co-GH)-OSA 以及P(Sar-co-GH)-OSA-CMC 凝胶的红外光谱中完全消失。同时,在P(Sar-co-GH)-OSA的红外谱图中,1 634 cm−1处出现酰腙键的羰基峰,证实了OSA 与P(Sar-co-GH)之间发生了反应。此外,在P(Sar-co-GH)-OSA-CMC 的红外谱图中检测到源自CMC 的1 421 cm−1处的羧酸基团(―COO–)对称伸缩振动峰。在1 637 cm−1处观察到新的亚胺(C=N)伸缩振动吸收峰,表明CMC 和OSA 之间反应形成了亚胺键。以上吸收峰的变化证明了亚胺键和酰腙键的形成。
2.2.2 水凝胶的流变学性能测试 图4 为P(Sar-co-GH)-OSA-CMC 水凝胶的流变图。从图4 可以看出,各样品的G'始终大于G'',且几乎不随频率变化,说明整个体系处于凝胶态。随着R1的增大,水凝胶中P(Sar-co-GH)和酰腙键的比例逐渐增大,对应的CMC 和亚胺键的比例逐渐减小。水凝胶的G'表现出先增大后减小的趋势,当R1从0 增大到0.5 时,G'从2 900 Pa 增大到最大值5 690 Pa,G'的增大可能是由于体系中存在更多酰腙键,而酰腙键的稳定性大于亚胺键所致。当R1继续由0.5 增大到1 时,G'迅速降到了840 Pa,这可能是由于体系中高分子量的CMC 大量减少,导致其力学性能急剧下降。综合来看,通过调节P(Sar-co-GH)-OSA-CMC水凝胶中亚胺键和酰腙键的比例可以得到具有较好力学性能的水凝胶。
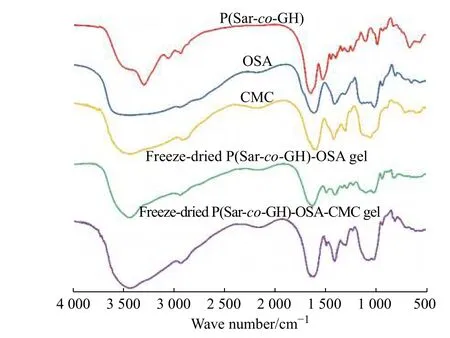
图 3 样品的红外谱图Fig. 3 FT-IR spectra of samples
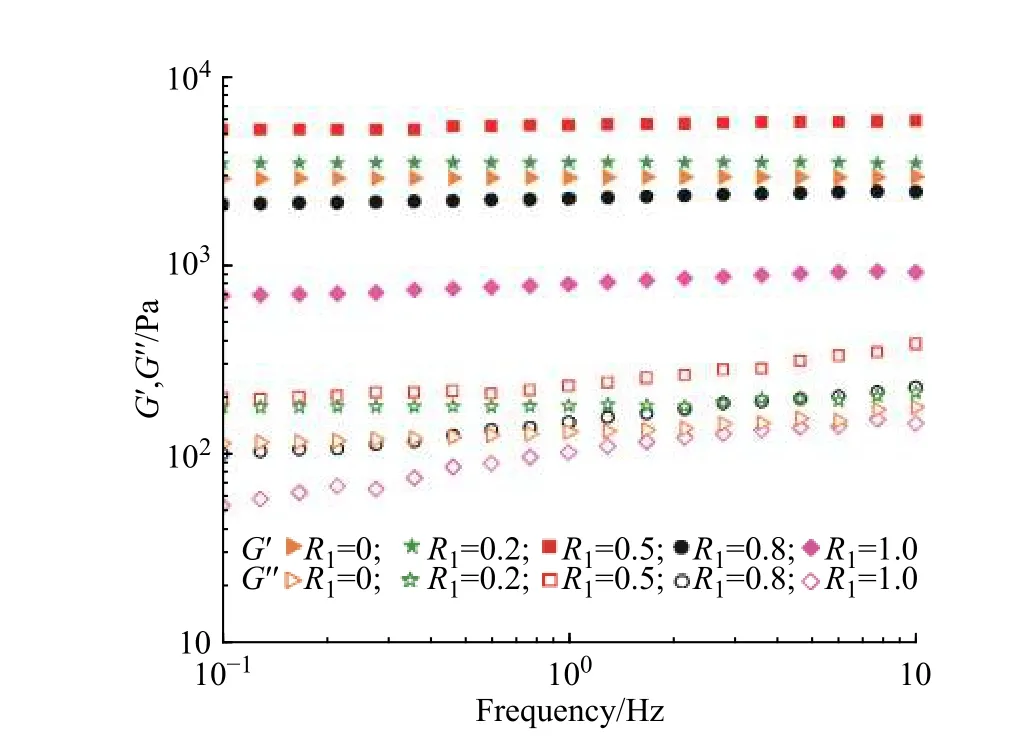
图 4 P(Sar-co-GH)-OSA-CMC 水凝胶的流变图Fig. 4 Rheological curves of P(Sar-co-GH)-OSA-CMC hydrogels
2.2.3 水凝胶的注射性能 将经苋菜红染色的水凝胶前驱体溶液装入容量为5 mL 的注射器后,推动注射器活塞将其从注射器的针头中挤出后可顺利地在板上写出字母“ECUST”(图5),这表明基于亚胺键和酰腙键交联的P(Sar-co-GH)-OSA-CMC 水凝胶具有良好的可注射性。

图 5 P(Sar-co-GH)-OSA-CMC 凝胶的注射过程Fig. 5 Injectable process of P(Sar-co-GH)-OSA-CMC hydrogel
2.2.4 水凝胶的自修复性能 如图6 所示,取2 个水凝胶分别被苋菜红和亮蓝染色,并分别切成两半。随后在室温且没有任何外部干预的情况下,将2 个不同颜色的半圆沿着切割线保持紧密接触12 h。在愈合过程中,2 种染料分子不断地在切割表面扩散,并相互渗透,最终完全融合成一体,所得水凝胶与修复前的水凝胶无明显差异,且能够承受沿切割表面垂直方向的自身重力而不分裂。

图 6 水凝胶的自修复性能Fig. 6 Property of self-healing process of hydrogel
2.2.5 水凝胶的pH 响应性 如图7 所示,加入盐酸后,P(Sar-co-GH)-OSA-CMC 水凝胶完全变成液体;加入TEA 中和盐酸后,溶液重新变回凝胶态。通过反复添加盐酸和TEA,水凝胶能够显示出溶胶-凝胶转变过程,且在添加盐酸和TEA 前后水凝胶的形态没有显著差异,所以制备的这种动态交联水凝胶具有pH 响应性。这是由于亚胺键和酰腙键是对pH 变化比较敏感的动态化学键,水凝胶的pH 响应性可以解释为在pH 刺激下亚胺键和酰腙键可逆的断裂和重构,从而在宏观上出现溶胶-凝胶转变。

图 7 P(Sar-co-GH)-OSA-CMC 水凝胶的可逆pH 响应性溶胶-凝胶转变Fig. 7 Reversible pH-responsive sol-gel transition of P(Sar-co-GH)-OSA-CMC hydrogel
2.3 体外细胞毒性与细胞培养
图8(a)给出了NIH/3T3 在不同质量浓度的P(Sar-co-GH)溶液中培养24 h 后的细胞活性。从图中可以看到,细胞在不同质量浓度的共聚物溶液中培养后,细胞活性均在90%以上,这表明细胞能够在共聚物溶液中正常生长,说明所制备的P(Sar-co-GH)具有良好的生物相容性。
图8(b)展示的是NIH/3T3 在水凝胶的浸提液中培养24、48、72 h 后的细胞活性图。从图中可以看出,培养24 h 后,NIH/3T3 的存活率接近100%;培养48 h 和72 h 后,细胞存活率略大于100%,说明随着培养时间的增加,NIH/3T3 能够正常生长和增殖,这表明P(Sar-co-GH)-OSA-CMC 水凝胶未释放抑制细胞生长的有害物质,具有优异的细胞相容性。
经过24 h 的培养后,细胞呈现圆形的状态分散在凝胶中,此时细胞数量比较少(图8(c))。培养48 h 后,视野中一部分细胞的形态发生了变化,呈现为梭形,而且细胞数量也多于24 h 培养后的细胞数量(图8(d)),这一现象说明细胞在水凝胶中开始铺展并繁殖。在整个细胞培养过程中,只观察到个别红色荧光点,这表明所制备的P(Sar-co-GH)-OSA-CMC 水凝胶能够用于包载NIH/3T3,并且有效促进细胞的生长,可用作细胞培养支架材料。
3 结 论
(1)通过开环聚合法成功制备了具有良好水溶性的P(Sar-co-GH),并将海藻酸钠氧化制得带有醛基的OSA。基于P(Sar-co-GH)、OSA、CMC 这3 种组分的水凝胶可在温和的条件下通过简单混合快速形成。
(2)水凝胶网络中亚胺键和酰腙键这两种动态化学键的存在赋予了水凝胶可注射性、pH 响应性和自修复性能,并且通过调节两种动态化学键的比例可得到具有良好力学性能的P(Sar-co-GH)-OSA-CMC 水凝胶。
(3)该水凝胶具有良好的生物相容性和动态交联网络,其中包载的NIH/3T3 保持了高活性和增殖能力。

