电泳沉积技术制备海藻酸钙-纳米铜复合抗菌膜
雷 雨, 屈 雪
(华东理工大学材料科学与工程学院,教育部医用生物材料工程研究中心,上海 200237)
随着耐药性细菌的出现,传统的抗菌手段已面临十分严峻的挑战[1,2]。目前,新型抗菌材料的研究和产品开发主要围绕抗菌肽和金属离子展开。大多数抗菌肽通过高选择性和特异性靶向细胞质和干扰细胞代谢来发挥作用,但是抗菌肽生产成本高,体内稳定性差。许多金属纳米粒子被发现具有高效抗菌性能[3,4],比如银和铜。尽管银的抗菌活性强,但是作为外来重金属,它的远期生物安全性一直为人们所担忧[5]。铜是生物体生理学和基础代谢的必需微量元素[6],人体每天需要摄入约1 mg 铜。铜是众多生物体内酶的结构组分和催化中心,比如皮肤中的超氧化物歧化酶依赖于铜。铜还能加速上皮组织生长,诱导血管内皮生长因子促进成血管化[6]。
铜对各种真菌、寄生虫甚至病毒都具有杀灭性[6],主要的作用机理是:Cu2+和Cu+的氧化还原循环能催化羟基自由基的生成(局部芬顿(Fenton)反应),进而对细菌膜脂质、DNA 进行超氧化破坏[7];Cu2+能插入DNA的胞嘧啶-鸟嘌呤(G-C)碱基对,破坏氢键;Cu2+特异性攻击蛋白质双功能酪氨酸磷酸酶(VHR),氧化其半胱残基,同时还攻击细菌蛋白质和多肽链中的组氨酸、脯氨酸,消耗细菌细胞膜中的还原性谷胱甘肽[7];Cu2+也与细菌表面的负电区域发生静电作用,选择性地撕裂菌膜表面[7]。
目前,很多学者研究了铜的不同化学形式产生的抗菌效果,包括纯铜[7]、铜合金(如黄铜)[7,8]、铜离子[9]、难溶铜盐[10]、铜离子配合的杂环化合物[11]、纳米铜[12-14]、纳米氧化铜[15-17]、硫化铜纳米量子点[18]、纳米铜-镍合金[19]、含Cu2+的纳米壳聚糖凝胶[20]、嵌入纳米铜的海泡石微球[21]、含铜的纳米硅球[22]、铜离子螯合的天然染料[23-26]、嵌入纳米氧化铜的纤维织品[6]等。张俐娜课题组[27]制备了纳米铜涂覆的纤维素膜,该纤维膜具有高效抗菌活性。Villanueva 等[28]合成了氧化硅包覆的纳米铜并保持了连续4 个循环的抗菌活性。
虽然上述工作用铜作为抗菌功能组分,但是制备方法复杂、耗时。因此本文拟将纳米铜引入海藻酸钙凝胶膜中,利用纳米铜的抗菌功能,使创口敷料获得抗菌活性。具体借助电泳沉积技术,以碳酸钙-海藻酸(Alg)-纳米铜混合体系为电解液主要成分,在阳极诱导海藻酸钙(Ca2+-Alg)-纳米铜复合膜(Ca2+-Alg-Cu)的形成,并对膜的表观形貌、化学结构、抗菌性能和体外细胞相容性进行了初步研究和分析。
1 实验部分
1.1 试剂与仪器
海藻酸钠:分析纯,上海阿拉丁化学试剂有限公司;纳米铜(Cu NPs, 粒径小于50 nm)、噻唑兰(MTT):分析纯,Sigma-Aldrich 化学品公司;氯化钠、碳酸钙、十二水合磷酸氢二钠、一水合磷酸二氢钾、二甲基亚砜(DMSO):分析纯,上海凌峰化学试剂有限公司;杜尔贝科的改良伊格尔培养基(DMEM)、胎牛血清(FBS)、青链霉素溶液、胰蛋白酶:生物试剂纯度,Hyclone 生物试剂有限公司。
冷冻干燥机:宁波新芝生物科技公司Scientz-10N 型;电化学工作站:上海辰华仪器公司CHI 660E 型;铂片电极:上海辰华仪器公司,15 mm×15 mm×0.2 mm;Ag/AgCl 电极:上海辰华仪器公司CHI 111 型;铂丝电极:上海辰华仪器公司CHI 115 型;高压灭菌锅:上海申安医疗机械厂LDZX-50KBS 型;细胞培养箱:美国赛默飞世尔科技公司SERIES 8000W 型;酶标仪:美国分子器械公司SPECTRA max 384 型;扫描电子显微镜(SEM):日本日立公司S4800 型,喷金40 s,电压10 kV;能谱仪(EDS):牛津仪器Ultim,EXTREME 无窗型电制冷;傅里叶变换红外光谱(FT-IR):美国热电公司Nicolet 5700 型,测定波数范围为650~4 000 cm−1。
1.2 阳极电泳沉积制备Ca2+-Alg-Cu
各样品按表1 配制电解液,将电解液搅拌10 min 后放入超声机中超声处理5 min,使纳米铜充分分散,再继续搅拌10 min。将上述混合液倒入50 mL 的烧杯,打开电化学工作站,用三电极体系(阴极和阳极都是铂片电极,参比电极是Ag/AgCl 电极)以恒电流模式进行电泳沉积,电流密度为4.44 mA/cm2,通电电量是1.8 C。沉积结束后,用去离子水冲洗沉积的纳米铜膜,用镊子将膜剥离下来,并放在干净的培养皿中,放入冷冻干燥机中干燥24 h 后,置于干燥器或者冰箱冷藏室中待用。
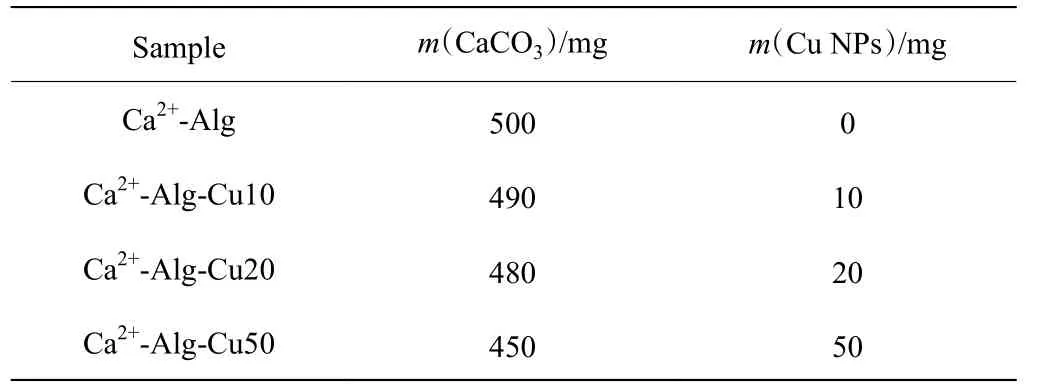
表 1 海藻酸钙-纳米铜电解液的组成Table 1 Composition of calcium alginate-copper nanoparticles electrolyte
1.3 Ca2+-Alg-Cu 的抗菌性能表征
1.3.1 平板计数法 用生理盐水将菌液梯度稀释至约107CFU/mL 或106CFU/mL,24 孔板每孔加入1 mL菌液和Ca2+-Alg 或Ca2+-Alg-Cu 膜,以只加入1 mL菌液的样品为空白对照,放入37 ℃恒温培养箱内共培养12 h。用生理盐水将共培养菌液梯度稀释,取100 μL菌液滴在固体琼脂平板上,轻轻震荡使菌液均匀铺满平板,将平板放入37 ℃恒温培养箱内培养15 h,记录形成的菌落数,计算杀菌率,每组样品设置3 个平行样。
1.3.2 细菌的形貌表征 将空白对照组菌液与Ca2+-Alg 或Ca2+-Alg-Cu 共培养12 h 的菌液(1 mL)高速离心,去除500 μL 上清液,加入1 mL w=2.5%的戊二醛溶液,静置固定2~3 h。高速离心5 min,去除部分上清液,加入1 mL w=30%的酒精,静置10 min 后再高速离心5 min,依次用w= 50%,75%,85%,90%,100%的酒精进行10 min 梯度脱水,最后加入乙酸异戊酯置换酒精。将脱水后的菌液滴在硅片上,放入冷冻干燥机中冻干24 h。将硅片黏在导电胶上,通过SEM 观察细菌形貌。
1.4 Ca2+-Alg-Cu 的细胞相容性表征
将小鼠成纤维细胞(L929)以每孔2×104cells 的细胞密度接种到12 孔板后,把孔板放到细胞培养箱24 h后至细胞贴壁。接着在培养孔中加入新鲜制备的Ca2+-Alg-Cu 培养24 h 后,去除膜材料,在避光条件下向每孔加入200 μL 噻唑兰溶液,把孔板放回细胞培养箱4 h 后,吸取上清液,向每孔加入1 mL DMSO,37 ℃恒温箱中培养10 min 使紫色结晶完全溶解,吹打均匀后取100 μL 溶液至96 孔板,放入酶标仪测定492 nm 波长的吸光度。实验数据用OriginLab 作图。每组设置3 个平行样。

图 1 Ca2+-Alg 和Ca2+-Alg-Cu 的照片Fig. 1 Photographs of Ca2+-Alg and Ca2+-Alg-Cu
2 结果与讨论
2.1 Ca2+-Alg-Cu 的电化学制备及表面形貌
阳极沉积形成的膜如图1 所示。Ca2+-Alg 呈白色,而Ca2+-Alg-Cu10,Ca2+-Alg-Cu20 和Ca2+-Alg-Cu50 呈现逐渐变深的绿色,可能是由于纳米铜的加入能够增加材料的折射率,使膜颜色逐渐加深,也可以据此定性判断出纳米铜含量在各种膜中的变化。
图2 是Ca2+-Alg 和Ca2+-Alg-Cu 的SEM 表面形貌。随着Cu 含量的增加,Ca2+-Alg-Cu 表面的粗糙度逐渐增加,纳米团簇的密度越来越大,表面的颜色越来越暗。同时一些不光滑、褶皱和类似气泡的结构出现,可能是在阳极附近水电解产生氧气,同时碳酸钙溶解时释放出一些CO2,两种气体同时在电极附近存在,使沉积出来的样品膜出现气泡样形貌。
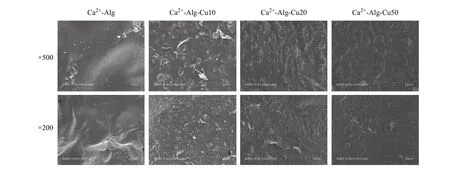
图 2 Ca2+-Alg 和Ca2+-Alg-Cu 的SEM 照片Fig. 2 SEM images of Ca2+-Alg and Ca2+-Alg-Cu
2.2 Ca2+-Alg-Cu 的化学结构表征
Ca2+-Alg-Cu 的EDS 元素分析结果如图3 所示。可以看出,只有加入纳米铜的实验组出现了铜元素的峰,说明纳米铜成功地包入了海藻酸钙膜,而且随着纳米铜含量的增加,Cu 元素信号峰的强度增强。
Ca2+-Alg 和Ca2+-Alg-Cu 的红外谱图如图4 所示。图中1 597 cm−1处的峰对应COO−的不对称伸缩振动,1 410 cm−1处的峰对应COO−的对称伸缩振动,1 300 cm−1处的峰对应C―O(H)键,1 120 cm−1处的峰对应C―C 的伸缩振动,1 084 cm−1处的峰对应古罗糖醛酸中C―O 的伸缩振动,1 030 cm−1处的峰对应C―O―C基 团,935 cm−1处 的峰对 应 古罗糖 醛 酸中受 到C―C―H 和C―O―H 形变影响的C―O 键,887 cm−1对应甘露糖醛酸中的C―C―O 和C―O―C 基团,810 cm−1处的峰对应甘露糖醛酸中的C―O 基团,776 cm−1处的峰对应C―H 键的平面外弯曲振动。可以看到,随着纳米铜含量的增加,1 597 cm−1处COO−的不对称伸缩振动峰强度和1 410 cm−1处对称伸缩振动峰强度都在减弱,说明纳米铜会与海藻酸钙中的羧酸根离子COO−相互作用,从而弱化信号峰的强度。

图 3 Ca2+-Alg 和Ca2+-Alg-Cu 的EDS 图谱Fig. 3 EDS spactra of Ca2+-Alg and Ca2+-Alg-Cu

图 4 Ca2+-Alg 和Ca2+-Alg-Cu 的红外吸收光谱Fig. 4 FT-IR spactra of Ca2+-Alg and Ca2+-Alg-Cu
同时,1 300 cm−1处C―O(H)键的信号峰也随着纳米铜含量的增加逐渐消失,说明纳米铜也会与海藻酸钙中的羟基相互作用。值得注意的是,1 030 cm−1处C―O―C 的红外吸收峰强度随着纳米铜加入量的增加而减弱,说明纳米铜除了可以与海藻酸钙中的羟基和羧基反应外,还可以与醚键发生相互作用。最后,887 cm−1处甘露糖醛酸中的C―C―O 和C―O―C 基团的吸收峰强度随着膜中纳米铜含量的增加而减弱,说明纳米铜主要与海藻酸钙中的甘露糖醛酸链段发生反应,而基本不与海藻酸钙中的古罗糖醛酸链段反应,说明古罗糖醛酸链段主要用于和碳酸钙解离出的钙离子发生离子交联反应,形成鸡蛋盒子结构,而未参与离子交联的甘露糖醛酸链段参与了和纳米铜的相互作用。
2.3 Ca2+-Alg-Cu 的抗菌性能评价
2.3.1 平板计数法 将大肠杆菌(E. coli)和金黄色葡萄球菌(S.aureus)分别作为革兰氏阴性菌模型和革兰氏阳性菌模型,细菌浓度为1×107CFU/mL。细菌与Ca2+-Alg、Ca2+-Alg-Cu 共培养2 h 后的膜片颜色变化如图5 所示。经过2 h 的培养后,Ca2+-Alg-Cu 的绿色逐渐褪去变成白色,说明原本包在Ca2+-Alg-Cu 中的纳米铜颗粒逐渐释放到菌液里。

图 5 Ca2+-Alg-Cu 在37 ℃ E. coli 菌液中的颜色变化Fig. 5 Color fading of Ca2+-Alg-Cu in E. coli suspension at 37 ℃
细菌生长情况如图6 所示,空白对照组和Ca2+-Alg 都不能抑制细菌生长,而Ca2+-Alg-Cu10、Ca2+-Alg-Cu20、Ca2+-Alg-Cu50 均能抑制细菌生长,且随着纳米铜用量的增加,抗菌效果逐渐增强,说明纳米铜对细菌的生长和繁殖具有显著的抑制作用。
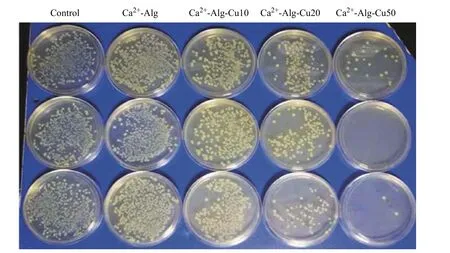
图 6 Ca2+-Alg-Cu 与高浓度(1×107 CFU/mL)E. coli 共培养后的菌落Fig. 6 E. coli colony after high turbidity(1×107 CFU/mL) bacterial suspension incubated with Ca2+-Alg-Cu
将图6 中的菌落数转换为细菌存活率柱状图(图7)。可以看出,Ca2+-Alg-Cu 的杀菌活性随着纳米铜用量的增加而增加,Ca2+-Alg-Cu50 的杀菌率高达100%。
采用低浓度(1×106CFU/mL)的3 种常见细菌(E.coli、 S. aureus 和绿脓杆菌(P. aeruginosa))测试Ca2+-Alg-Cu的抗菌活性,实验结果见图8。结果表明,即使是Ca2+-Alg-Cu10 也能产生约100%的杀菌率,这种材料对常见细菌具有高效广谱杀菌性能。

图 7 用高浓度(1×107 CFU/mL)E. coli 与Ca2+-Alg-Cu 共培养2 h 的细菌存活率Fig. 7 Surviving rate of E. coli in high initial turbidity(1×107 CFU/mL) after incubation with Ca2+-Alg-Cu for 2 h

图 8 用低浓度(1×106 CFU/mL)细菌与Ca2+-Alg-Cu 共培养2 h 的细菌存活率Fig. 8 Surviving rate of bacteria in low initial turbidity(1×106 CFU/mL) after incubation with Ca2+-Alg-Cu for 2 h
2.3.2 细菌的形貌表征 图9 为与Ca2+-Alg-Cu50 共培养2 h 后的细菌形貌SEM 照片。E. coli 和S. aureus 严重变形,表面出现褶皱,说明Ca2+-Alg-Cu50 在杀菌过程中也会改变细菌形貌。

图 9 Ca2+-Alg-Cu50 处理E.coli 和S.aureus 前后的SEM 照片Fig. 9 SEM images of Ca2+-Alg-Cu50 before and after treated E. coli and S. aureus
2.4 Ca2+-Alg-Cu 的细胞相容性评价
体外细胞相容性实验结果如图10 所示。随着纳米铜含量的增加,细胞存活率逐渐降低。Ca2+-Alg 和Ca2+-Alg-Cu10 处理的L929 存活率均高于80%,分别为98%和83%;而在Ca2+-Alg-Cu20 和Ca2+-Alg-Cu50 处理组,L929 存活率低于80%,分别为75%和40%。经过24 h 处理,L929 的有效线粒体数随着膜中纳米铜含量的增加而降低,意味着存活状态细胞比例在降低,细胞毒性逐渐增加。表2为与Ca2+-Alg-Cu 共培养的E. coli 以及L929 的存活率。由表可见,Ca2+-Alg 对E. coli 没有抑菌作用,E. coli 的存活率增加到108%,而L929 的存活率为100%。相 反,与 Ca2+-Alg-Cu50 共孵育24 h 后,L929 的存活率只有39%,而E. coli 的存活率低至1%。Ca2+-Alg-Cu20 和Ca2+-Alg-Cu10 能够实现低于20%的E. coli 存活率和大于75%的L929 存活率。

图 10 Ca2+-Alg-Cu 与L929 共培养后的细胞存活率Fig. 10 Surviving rate of L929 incubated with Ca2+-Alg-Cu
众所周知,纳米材料的体外生物相容性具有时间和剂量依赖性,而本文验证了纳米铜在电泳沉积膜中的含量增加会导致细胞存活率下降,即具有剂量依赖性。同时,值得注意的是,L929 相比人细胞对纳米铜的敏感度可能更高,而且纳米铜作用下的细胞存活率与膜材料和细胞共培养的时间有关。共培养24 h 的细胞存活率说明Ca2+-Alg-Cu10 和Ca2+-Alg-Cu20 具备优良的细胞相容性,而Ca2+-Alg-Cu50的细胞相容性可能需要做更长期的体外实验来研究,因此Ca2+-Alg-Cu 的体外生物毒性需要进一步研究确认。

表 2 与Ca2+-Alg-Cu 共培养的E.coli 与L929 存活率Table 2 Surviving rates of E.coli and L929 after incubation with Ca2+-Alg-Cu
3 结 论
(1)采用电泳沉积技术制备了Ca2+-Alg-Cu,纳米铜成功引入海藻酸钙电沉积膜中。
(2)Ca2+-Alg-Cu 的颜色随电解液中纳米铜的含量增加而加深。
(3)Ca2+-Alg-Cu 具有对抗大肠杆菌、金黄色葡萄球菌和绿脓杆菌的广谱抗菌活性,能够通过破坏细菌菌膜诱导细菌死亡。
(4)Ca2+-Alg-Cu 对细胞存活率的影响主要依赖于纳米铜的含量。Ca2+-Alg-Cu10 和Ca2+-Alg-Cu20 具有优良的细胞相容性,能实现优良抗菌性和体外生物相容性的平衡。

