右美托咪定对脂多糖诱导的子宫内膜炎小鼠子宫组织中TLR4-NF-κB/NLRP3炎性小体介导的炎性反应的影响
李鲜风 杨丽绢
子宫内膜炎是女性常见的生殖道疾病,其特点是子宫内膜的持续性炎性反应,并引起许多生育问题,包括自发性早产和习惯性流产等[1]。脂多糖(LPS)作为革兰阴性细菌外膜的主要成分,是诱发子宫内膜炎的关键因素[2]。
Toll样受体(TLR)是一类细胞内模式识别受体(PRR),通过识别脂多糖(LPS)、膜脂蛋白等分子参与机体的先天性和适应性免疫反应[3]。TLR4是TLR家族重要的成员之一,能够识别外源性配体LPS[4]。LPS与TLR4结合能够引起细胞内的信号转导反应,如激活核因子(NF)-κB信号通路,NF-κB信号活化能够促进细胞内相关信号分子的转录,包括NLRP3炎性小体相关分子及细胞因子(IL-1β、TNF-α)的表达[5]。NLRP3炎性小体是细胞内的重要胞质识别受体,主要成分包括NLRP3、caspase-1、ASC等[6]。NLRP3炎性小体活化后,其能够诱导细胞产生大量的IL-1β和IL-18,加重炎性反应[7]。因此,抑制TLR4-NF-κB信号介导的NLRP3炎性小体活化对于炎性疾病的治疗具有潜在的价值。
右美托咪定(dexmedetomidine,DEX)是一种有效的选择性α-肾上腺素能受体激动剂,具有镇静、镇痛的效果[8]。近年来,研究表明DEX能够通过阻断NF-κB信号通路对脊髓损伤、心肌缺血再灌注及脓血症等模型发挥良好的抗炎效果[9]。但是DEX对子宫内膜炎的作用和相关分子机制尚未完全清楚,因此,本研究采用LPS诱导的小鼠子宫内膜炎模型探索DEX的抗炎作用及相关分子机制。
材料与方法
1.实验材料:脂多糖(LPS)(美国西格玛奥德里奇公司);HE染色液(上海碧云天生物技术有限公司);IL-1β、IL-18、TNF-α 小鼠ELISA试剂盒(杭州联科生物技术股份有限公司);RT-PCR反转录试剂盒、荧光定量试剂盒(南京诺唯赞生物科技有限公司);caspase-1、ASC及NLRP3抗体(美国细胞信号技术公司);TLR4、p-p65、p65、GAPDH抗体(上海艾博抗贸易有限公司);HRP标记山羊抗兔IG(美国英杰生命技术有限公司),右美托咪定注射剂(江苏扬子江药业集团有限公司)。
2.动物分组给药及小鼠子宫内膜炎模型建立:所有动物试验均经过动物伦理学委员会的同意和批准,将40只C57BL/6小鼠(雌性,20~22g)随机分为对照组、模型组、右美托咪定组(10、20、40μg/kg),每组8只,右美托咪定腹腔注射给药,对照组和模型组给予等体积的0.9%NaCl注射液。给药后30min,小鼠腹腔注射戊巴比妥钠(50mg/kg)麻醉,倒提固定,用自制小鼠子宫灌注器向小鼠子宫内注射LPS(5mg/ml,溶解于PBS溶液)20μl,对照组注射等体积PBS溶液。在LPS注射24h后,眼球取血,脱颈椎处死,解剖分离小鼠子宫组织。
3.HE病理染色:分离收集小鼠子宫组织,切取约0.5cm,置于中性甲醛溶液中固定,石蜡包埋,切成4μm薄片,苏木精-伊红(HE)染色观察子宫组织的病理变化,并评分。评分标准:(1)水肿:正常为0分;轻微为1分;适中为2分;严重为3分。(2)炎性细胞浸润:0~1为0分;2~5为1分;6~10为2分;11~15为3分;16~20为4分;>20为5分。
4.ELISA法:采用ELISA法检测小鼠血清中IL-18、IL-1β、TNF-α的分泌水平,小鼠眼球取血,用1.5ml EP管收集血液,4℃静置过夜,3000r/min离心5min,吸取上清,使用ELISA试剂盒根据制造商说明检测小鼠血清中IL-18、IL-1β、TNF-α的含量。
5.RT-PCR检测:分离收集小鼠子宫组织,称取约30mg,加入1ml TRIzol(南京诺唯赞生物科技有限公司)提取组织总RNA,用NanoDrop 2000 Spectrophotometer(美国赛默飞世尔科技公司)检测总RNA的纯度和浓度,用反转录试剂盒将RNA(1μg)反转录为cDNA,使用配有SYBRs Green Master Mix(南京诺唯赞生物科技有限公司)的CFX ConnectTMReal-Time系统(美国伯乐公司)进行qRT-PCR定量分析,扩增条件:95℃预变性5min;95℃变性15s,60℃延伸30s,重复40个循环,最后根据2-ΔΔCt法计算IL-18、IL-1β、TNF-α、GAPDH mRNA的表达水平,RT-PCR引物序列详见表1。

表1 RT-PCR引物序列
6.蛋白印迹免疫分析(Western blot法):分离收集小鼠子宫组织,称取约30mg,采用Western blot法检测子宫组织中caspase-1、ASC、NLRP3、TLR4、p-p65及p65的蛋白表达水平。根据制造商说明操作提取组织总蛋白,采用BCA法(上海碧云天生物技术有限公司)对蛋白进行定量,加入Loading buffer(4X)于100℃煮沸5min,然后进行SDS-PAGE电泳来达到分离蛋白的目的,电泳条件:80V,30min;120V,60min。随后采用100V,90min将电泳分离后的蛋白转移至聚偏佛乙烯(PVDF)膜(美国密理博公司),用5%脱脂奶粉封闭60min,TBST洗涤5次,5分钟/次,用一抗(caspase-1、ASC、NLRP3,按1∶1000稀释;TLR4、p-p65、p65及GAPDH,按1∶500稀释)4℃孵育过夜,TBST洗涤5次,5分钟/次,用二抗(HRP标记山羊抗兔IG,按1∶10000稀释)孵育90min,TBST洗涤5次,5分钟/次,用ECL化学发光法(Millipore,MA)显影检测,Image J分析灰度值,GAPDH用作内参对照。

结 果
1.右美托咪定(DEX)对子宫内膜炎小鼠子宫组织病理变化的影响:采用HE染色检测小鼠子宫组织的病理变化情况,与对照组小鼠比较,模型组小鼠的子宫组织中出现大量的炎性细胞浸润,子宫肌层出现水肿,黏膜出现损伤和增生,同时炎症评分显著增加;与模型组比较,腹腔注射给予右美托咪定呈剂量依赖性缓解子宫内膜炎小鼠子宫组织中LPS诱导的炎性细胞浸润和子宫肌层水肿,并缓解子宫黏膜损伤,显著减少炎症评分(图1)。
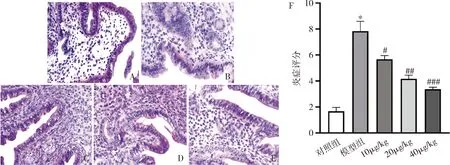
图1 右美托咪定对子宫内膜炎小鼠子宫组织病理变化的影响A~E.HE染色;A.对照组;B.模型组;C~E.右美托咪定组(10、20、40μg/kg);F.子宫内膜炎小鼠子宫组织病理炎症评分比较。与对照组比较,*P=0.000;与模型组比较,#P<0.05,##P<0.01,###P=0.000
2.右美托咪定(DEX)对子宫内膜炎小鼠血清中炎性因子分泌水平的影响:采用ELISA法检测子宫内膜炎小鼠血清中炎性因子的分泌水平,与对照组比较,模型组小鼠血清中IL-1β、IL-18、TNF-α的含量均显著增加;与模型组比较,腹腔注射给予右美托咪定呈剂量依赖性降低子宫内膜炎小鼠血清中IL-1β、IL-18、TNF-α的水平(图2)。
3.右美托咪定对子宫内膜炎小鼠子宫组织中炎性因子表达水平的影响:采用RT-PCR法检测子宫内膜炎小鼠子宫组织中炎性因子的表达水平,与对照组比较,模型组小鼠子宫组织中IL-1β、IL-18、TNF-α mRNA的表达水平显著上调;与模型组比较,腹腔注射给予右美托咪定呈剂量依赖性显著下调子宫内膜炎小鼠子宫组织中IL-1β、IL-18、TNF-α mRNA的表达水平(图3)。

图2 右美托咪定对子宫内膜炎小鼠血清中炎性因子分泌水平的影响A.子宫内膜炎小鼠血清中IL-1β的水平;B.子宫内膜炎小鼠血清中IL-18的水平;C.子宫内膜炎小鼠血清中TNF-α的水平,与对照组比较,*P=0.000;与模型组比较,#P<0.01,##P=0.000

图3 右美托咪定对子宫内膜炎小鼠子宫组织中炎性因子表达水平的影响A.子宫内膜炎小鼠子宫中IL-1β mRNA的表达水平;B.子宫内膜炎小鼠子宫中IL-18 mRNA的表达水平;C.子宫内膜炎小鼠子宫中TNF-α mRNA的表达水平,与对照组比较,*P=0.000;与模型组比较,#P<0.01,##P=0.000
4.右美托咪定(DEX)对子宫内膜炎小鼠子宫组织中NLRP3炎性小体活化的影响:采用Western blot法检测子宫内膜炎小鼠子宫组织中NLRP3炎性小体相关分子的蛋白表达水平,与对照组比较,模型组小鼠子宫组织中caspase-1、ASC及NLRP3的蛋白表达显著上调;与模型组比较,腹腔注射给予右美托咪定呈剂量依赖性下调子宫内膜炎小鼠子宫组织中caspase-1、ASC及NLRP3的蛋白表达(图4)。
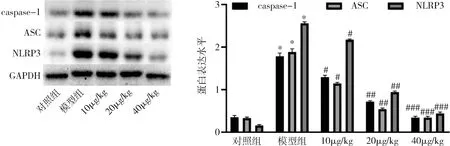
图4 右美托咪定对子宫内膜炎小鼠子宫组织中NLRP3炎性小体活化的影响与对照组比较,*P=0.000;与模型组比较,#P<0.05,##P<0.01,###P=0.000
5.右美托咪定(DEX)对子宫内膜炎小鼠子宫组织中TLR4-NF-κB通路活化的影响:采用Western blot法检测子宫内膜炎小鼠子宫组织中TLR4-NF-κB通路相关分子的蛋白表达水平,与对照组比较,模型组小鼠子宫组织中TLR4、p-p65/p65的蛋白表达显著上调;与模型组比较,腹腔注射给予右美托咪定呈剂量依赖性下调子宫内膜炎小鼠子宫组织中TLR4、p-p65/p65的蛋白表达水平(图5)。

图5 右美托咪定对子宫内膜炎小鼠子宫组织中TLR4-NF-κB通路活化的影响与对照组比较,*P=0.000;与模型组比较,#P<0.05,##P<0.01,###P=0.000
讨 论
子宫内膜炎发生于女性的子宫内膜,是一种常见的妇科疾病,其能够引起包括不孕、流产在内的诸多生育问题,这对患者造成了严重的经济负担[10]。脂多糖(LPS)是革兰阴性细菌外膜的主要成分,是诱发子宫内膜炎的关键因素,近年来LPS诱导的子宫内膜炎动物模型广泛应用于该疾病的研究[11]。右美托咪定(DEX)是一种选择性α-肾上腺素能受体激动剂,其具有镇痛和镇静的效果。本研究发现,小鼠子宫注射LPS能够引起小鼠子宫发生肌层水肿及炎性细胞浸润等炎性反应,腹腔注射给予小鼠DEX能够缓解子宫内膜炎的发展,包括抑制子宫肌层水肿及炎性细胞浸润,上述结果表明本研究成功建立了小鼠子宫内膜炎模型,并表明DEX对治疗子宫内膜炎具有潜在的价值。
LPS通过激活先天性免疫反应产生强烈的促炎信号,这些促炎信号在机体的免疫系统稳态调节过程中发挥至关重要的作用[12]。但是,释放过量的炎性因子能够引起炎症级联反应,并且损害组织[13]。因此,抑制炎性因子的产生对治疗炎症疾病具有重要意义。IL-1β是一种重要的促炎细胞因子,具有广泛的全身和局部作用,并能够调节免疫细胞和非免疫细胞功能[14]。TNF-α是一种急性期蛋白,可启动细胞因子级联反应,增加血管通透性,促进巨噬细胞和中性粒细胞向感染部位募集,并参与炎症疾病[15]。IL-18是一种前炎性细胞因子,能够调节多种细胞因子的分泌,在免疫调节、感染性及慢性炎症疾病过程中具有重要的作用。本研究表明DEX能够显著降低子宫内膜炎小鼠血清中IL-1β、IL-18、TNF-α的水平,同时下调子宫组织中IL-1β、IL-18、TNF-α的表达水平,上述结果表明DEX对子宫内膜炎的治疗作用与下调子宫内膜炎小鼠的炎性因子水平有关。
成熟的IL-1β和IL-18产生和分泌与NLRP3炎性小体活化密切相关,除此之外,IL-1β和TNF-α产生和分泌也是基于NF-κB信号通路活化的[16]。NLRP3炎性小体激活后,ASC和NLRP3结合诱导caspase-1聚集,自激活和促进IL-1β和IL-18成熟[17]。本研究表明DEX能够抑制子宫内膜炎小鼠子宫组织中ASC、NLRP3和caspase-1的表达水平,上述表明DEX的抗炎作用与抑制NLRP3炎性小体活化有关。
TLR4是TLR家族的成员,其作为LPS的受体介导细胞免疫应答,最终导致NF-κB信号通路的活化,NF-κB信号转导通路对于调节NLRP3炎性小体活化具有重要作用[18]。因此本研究假设DEX的抗炎作用与抑制TLR4介导的NF-κB信号通路活化有关。本研究结果表明DEX能显著下调子宫内膜炎小鼠子宫组织中TLR4的表达水平。在正常情况下,p65与IκBα结合存在于细胞质中,当LPS刺激时,IκBα将会磷酸化并降解,p65磷酸化并进入细胞核,促进核基因的转录,包括NLRP3炎性小体相关成分、IL-1β、IL-18、TNF-α,从而加重炎性反应[19]。本研究表明DEX能够通过下调p-p65/p65的表达抑制NF-κB信号通路的活化,上述结果表明DEX的抗炎作用可能与TLR4介导的NF-κB信号通路相关分子的表达下调有关。
综上所述,本研究表明右美托咪定(DEX)腹腔注射给予子宫内膜炎小鼠,能够缓解小鼠子宫内膜炎,并且与抑制子宫组织中TLR4-NF-κB/NLRP3炎性小体介导的炎性反应有关,因此右美托咪定对于治疗子宫内膜炎具有潜在的价值。

