右肾包膜动脉化疗栓塞在原发性肝癌介入治疗中的安全性及有效性研究
常旭 张林 孙鹏 谢印法 吴会勇 刘吉兵 张健鑫
原发性肝癌(primary hepatic carcinoma,PHC)是全球常见消化道恶性肿瘤之一,由于起病隐袭、侵袭性高、进展迅速和早期诊断困难,我国原发性肝癌患者确诊时多为局部晚期或者发生远处转移,失去外科手术切除机会[1-2],经肝动脉化疗栓塞(transcatheter-arterial chemoembolization,TACE) 已成为不能手术切除原发性肝癌的首选治疗方法[3]。TACE治疗过程中,只有将所有肿瘤供血动脉精准完全栓塞才能发挥其最佳抗肿瘤作用,但临床工作中常见肝外肿瘤供血动脉形成,导致不完全栓塞影响TACE疗效。既往研究报道,已经发现的参与肝脏肿瘤供血的侧支多达26支[4],常见的肝外侧支包括肠系膜上动脉、膈下动脉、胃左动脉、网膜动脉等,且相关报道相对较多。而近几年我科工作中发现肾包膜动脉也是TACE治疗时重要侧支血管(图1),但关于肾包膜动脉参与肝癌供血的文献较少。因此本研究回顾性分析山东省肿瘤医院介入科收治的13例肾包膜动脉参与肝癌供血的病历,研究其影像学特征,并探讨肾包膜动脉化疗栓塞的有效性及安全性。
资料与方法
一、研究对象
回顾性分析2016年5月至2019年12月,13例就诊于山东省肿瘤医院介入科确诊为原发性肝癌并行右肾包膜动脉化疗栓塞的患者。所有患者术前均经病理确诊或临床诊断(原发性肝癌诊疗规范2019年版)为原发性肝癌,其中男性11例,女性2例。中位年龄58.0(42~72)岁,Child-Pugh A级9例,B级3例。ECOG评 分0分10例,1分3例。所有患者术前均签订了医院伦理委员会批准的知情同意书,符合伦理学规定。
二、仪器设备
数字减影血管造影X线机器,型号:Artis zee ceilling,德国西门子公司;Philips Allura Xper FD20,荷兰飞利浦公司。
三、研究方法
(一)经导管化疗栓塞术过程
整个手术操作均在数字平板X线血管机下实施。局麻后常规行seldinger穿刺,置入5 F导管鞘组,后置入5 F RH导管,主动脉弓成袢后将导管插至腹腔干动脉,行造影。以下情况下寻找右肾包膜动脉观察是否参与肿瘤供血:(1)术前影像学评估,肿瘤位于肝右后叶且负荷较大,呈外生型凸出肝外生长,挤压右肾或与右肾关系紧密:(2)术前影像肝内病灶明确,行肝动脉、右侧膈下动脉、肾上腺动脉等造影未见明显肿瘤染色:(3)既往已行TACE治疗,影像学复查发现病灶碘油沉积不完全。造影明确右肾包膜动脉参与肿瘤供血后,采用微导管(泰尔茂,日本)超选至肿瘤供血动脉,DSA监视下行栓塞术。
(二)栓塞材料的选择
通常采用化疗药物与超液态碘化油(罂粟乙碘化油注射液,10 ml/支,江苏恒瑞医药股份有限公司)组成的悬液进行栓塞。悬液剂量根据肿瘤大小及血供情况而定。常用的化疗药物有:表柔比星(艾达生,10 mg/支,海正辉瑞制药有限公司)20~30 mg,洛铂(50 mg/支,贵州益佰制药有限公司)50~75 mg,奥沙利铂(艾恒,50 mg/支,江苏恒瑞医药股份有限公司)100~200 mg。当存在明显动-静脉分流时,给予少量明胶海绵颗粒栓塞后,再给予碘化油悬液栓塞。若虽然本次超选成功,但超选难度大,预计下次超选可能失败时,可给予微弹簧圈栓塞。
(三)随访
化疗栓塞术后4~6周复查胸部及腹部强化CT,根据mRECIST[5]标准对术后1个月、3个月进行疗效评价。
结 果
一、患者肿瘤特点
13例原发性肝癌患者,其中BCLC分期B期患者8例、C期5例。肝肿瘤大小2.4~15.6 cm,平均为8.0±4.25 cm。所有患者肿瘤均位于Ⅴ、Ⅵ、Ⅶ段中某一段或两段。69.2%(9/13)患者肝脏肿瘤压迫右肾或与右肾紧贴,另外4名患者肝肿瘤与右肾关系不甚密切。(具体见表1)
二、手术及栓塞过程
本研究中所有患者均使用微导管超选至右肾包膜动脉,技术成功率100%。其中,5例存在动-静脉分流,给予明胶海绵颗粒栓塞后好转;2例患者由于首次超选困难,考虑后续可能超选失败,给予微弹簧圈栓塞。
三、患者肿瘤供血情况
13例肾包膜动脉供血的病例中,10例患者仅由肾包膜上动脉供血,2例患者仅由肾包膜中动脉供血(图2),1例患者同时由肾包膜上动脉、中动脉供血。无肾包膜下动脉供血病例。同时,所有13例肾包膜动脉参与供血的病例当中,9例患者合并除肝动脉外的血管供血,其中9例患者均合并右侧膈下动脉供血,2例患者合并肋间动脉供血(图3),2例患者合并肾上腺动脉供血(图4),1例患者合并网膜动脉供血。(具体见表1)

表1 13例行右肾包膜动脉化疗栓塞患者一般信息
四、不良反应
术后不良反应多为栓塞后综合征,10例患者出现恶心、呕吐,5例患者出现发热,6例患者出现腹部疼痛,10例患者出现转氨酶升高。不良反应多为栓塞肝内动脉引起,给予对症治疗后均好转。术后1个月复查胸、腹部CT,无患者出现右侧胸腔积液或右下肺炎症,无患者出现右肾局部碘化油沉积。
五、疗效评价
因绝大多数患者合并肝动脉化疗栓塞,因此仅评估右肾包膜动脉供血部分化疗栓塞后短期局部控制率。术后1个月,经右肾包膜动脉化疗栓塞后病灶局部疾病控制率(disease control rate,DCR)为92.3%,术后3个月DCR为84.6%。(具体见表2)

表2 13例患者右肾包膜动脉化疗栓塞后临床疗效分析
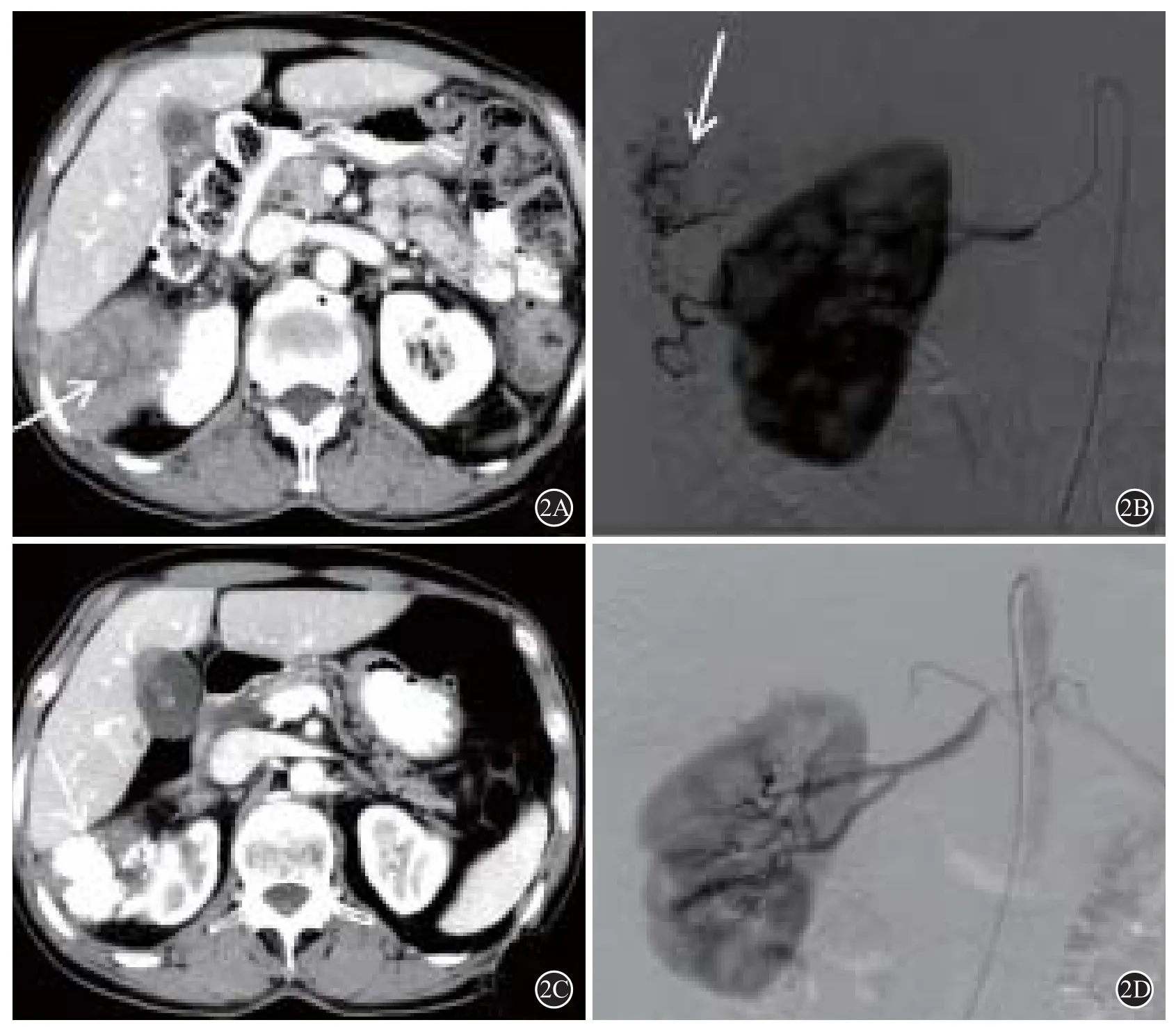
图2 右肾包膜中动脉供血病例

图3 右膈下动脉、肾包膜上动脉、肋间动脉同时供血肝癌影像学
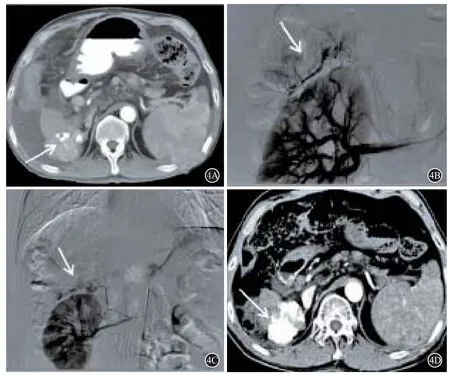
图4 右肾包膜上动脉、肾上腺动脉供血病例
讨 论
既往研究报道,有17%~27%的原发性肝癌患者存在肝外血管供血[6-8]。其中位于右后叶的肿瘤,文献报道肝外供血血管前两位分别为右侧膈下动脉及右侧肾上腺动脉。而右肾包膜动脉为另一重要供血血管,且发生率约1.8%~12%不等[9-12]。但临床工作中由于许多晚期肝癌患者未行TACE治疗或TACE过程中未明确右肾包膜动脉是否供血,其真实发生情况可能更高。但针对右肾包膜动脉供血病例的临床特点、行TACE治疗的安全性及疗效既往文献报道较少。因此本研究回顾性分析行右肾包膜动脉化疗栓塞的安全性及疗效。
肾包膜动脉主要分布于肾包膜及肾周间隙,由肾包膜上动脉、中动脉、下动脉三条分支构成,分支间可形成吻合。文献报道肾包膜上动脉是参与原发性肝癌肝外供血最常见的肾包膜动脉分支[13]。在本研究中,10例患者仅由肾包膜上动脉供血,2例患者仅由肾包膜中动脉供血,1例患者由肾包膜上动脉合并中动脉供血。未见肾包膜下动脉供血病例。本研究结果与既往研究结果类似,Ishikawa等[10]统计的19例右肾包膜动脉参与肝癌供血的病例中供血动脉全部来自肾包膜上动脉。在罗家敏等[9]的研究中,行右肾包膜动脉化疗栓塞的23例患者中,单纯由肾包膜上动脉供血的患者有20例,上动脉合并中动脉供血2例。可见,绝大多数肾包膜动脉参与肝癌供血血管为肾包膜上动脉,但肾包膜上动脉多起自肾动脉开口,因此临床操作中应避免导管插入过深导致错过其显影。
因本研究中的13例患者多同时行肝动脉化疗栓塞术,因此仅对肾包膜动脉参与供血的病灶进行疗效评价。本研究中,大部分患者(9/13)肾包膜动脉仅参与少量肿瘤供血,术后1个月及3个月肿瘤的局部控制率分别为92.3%、84.6%。对于肿瘤负荷较小且右肾包膜动脉为主要责任血管的2例患者都达到了CR,而对于仅参与少量肿瘤供血且肿瘤负荷较大的患者,局部控制率稍差。在Ishikawa等[10]的研究中,经过右肾包膜动脉化疗栓塞后,26个病灶CR、PR、SD分别为23%、31%、38%,肿瘤的局部控制率与本研究类似。
另外本研究发现,右侧肾包膜动脉参与肿瘤供血的病例,9例合并其他肝外血管供血,而且这9例患者的右侧膈下动脉均参与肿瘤供血。因此在临床工作中,遇到右后叶肿瘤且合并膈下动脉供血时,可常规寻找右肾包膜动脉造影,明确有无供血。既往文献报道右肾包膜动脉常作为巨大肝癌的侧支供血动脉,但也有少量文献报道右肾包膜动脉作为肝恶性肿瘤唯一供血动脉的情况。因此,对于直径较小或位于肝裸区的肿瘤,肝内造影未见明显肿瘤染色,应考虑是否存在右肾包膜动脉供血。
术后患者不良反应多为恶心、呕吐、腹痛、发热等常见表现。未见明显由直接栓塞肾包膜动脉引起的严重并发症。因肾包膜动脉常与膈下动脉毗邻或存在交通,若超选不到位,或者栓塞剂反流进入膈下动脉,可能出现胸腔积液、右侧肩膀疼痛等膈下动脉栓塞常见并发症[10],若同时合并膈下动脉-肺动脉或肺静脉分流,则可引起肺栓塞、咯血、脑栓塞等严重并发症。同时膈下动脉常与腰动脉、肋间动脉、肾上腺上下动脉、性腺动脉,栓塞剂误栓可引起种多种不同表现的并发症。此外,Miyayamae等[7]报道1例,肾包膜动脉栓塞后CT复查可见肾上极少量碘化油沉积,但无明显症状的病例。综上,行肾包膜动脉栓塞时,务必在DSA下缓慢注射栓塞剂,同时注意有无异常交通支、异常动-静脉分流等,在超选到位的情况下,右肾包膜动脉化疗栓塞是相对安全的。
结合本研究及既往文献,对于肾包膜动脉参与供血的原发性肝癌患者来说,化疗栓塞技术上安全可行,并且能够有效降低肿瘤负荷,短期疗效确切。对于病灶位于肝右后叶或者肝裸区的患者,若肝内动脉造影未见与术前CT相符的病灶,则应考虑肾包膜动脉供血可能。

