菌根真菌与施肥对杜鹃苗养分吸收的影响
杨舒婷,欧 静,李林盼
(贵州大学林学院,贵州 贵阳 550025)
杜鹃(Rhododendron simsii)是杜鹃花科(Ericaceae)杜鹃属(Rhododendron)落叶灌木,主要分布在我国西南山区[1],杜鹃花科大多数植物能与杜鹃花类菌根真菌(Ericoid mycorrhiza,ERM)形成内生菌根共生体。马尾松(Pinus massoniana)是松科(Pinaceae)松属(Pinus)乔木[2],能与外生菌根真菌(Ectomycorrhiza,ECM)形成外生菌根共生体[3]。杜鹃与马尾松均喜酸性土,且在贵州山林中杜鹃常以马尾松的伴生树种存在。贵州多为喀斯特地貌,土壤较贫瘠[4],施肥能促进植株生长,但长期施肥实验发现,养分过高或过低对植株生长都不利,且成本过高,破坏土壤结构[5]。养分吸收是植物生长发育的重要基础,近年来,植物–微生物共生系统对养分吸收的促进效应受到广泛关注。欧静等[6]对桃叶杜鹃(R. annae)接种ERM,能促进植株生长;张春英等[7]对云锦杜鹃(R. fortunei)接种菌根真菌,菌根苗对氮源吸收增强,促进植株干物质的积累。关于马尾松外生菌根真菌的研究表明,马尾松与菌根真菌共生在干旱条件下可以促进马尾松苗木生长[8];马尾松接种外生菌根真菌,能促进植株对土壤养分的吸收[9]。对混合菌剂的接种也有相应的研究,真菌群落较单一接菌的菌根效应更明显,如用彩色豆马勃(Pisolithus tinctorius)和美味牛肝菌(Boletus edulis)混合接种马尾松,其幼苗生长效果最好[10];陈应龙等[11]采用彩色豆马勃和 VA菌根真菌苏格兰球囊霉(Glomus caledonium)对尾叶桉(Eucalyptus urophylla)苗进行混合接种,苗高和生物量均超过单接种,同时混合接种还促进幼苗氨基酸的合成,说明仿自然真菌群落较单一接菌具有更重要的现实意义。
研究菌根真菌的接种效应,不仅有利于进一步筛选适宜的菌根真菌,亦有助于解释植株对立地的适应性。然而,马尾松外生菌根与杜鹃花类菌根对杜鹃促生作用的对比研究较为欠缺,利用杜鹃花类菌根真菌群落与马尾松外生菌根真菌群落共同作用减少化肥施用的研究也较少。本实验在前期对马尾松–杜鹃群落杜鹃根内和根围真菌进行分离与鉴定的基础上[12—13],模拟自然马尾松–杜鹃自然群落状态,利用前期从马尾松林下杜鹃根内分离鉴定的菌根真菌菌株回接杜鹃苗,比较ERM和ECM+ERM对杜鹃生长和营养吸收积累的影响,旨在充分利用菌根真菌资源,促进杜鹃栽培合理施肥。
1 材料与方法
1.1 试材
供试的4个菌株MG27、LL16、LL03、MG17分离自贵州省贵阳市孟关镇及龙里市马尾松林下杜鹃根系[12—13],包括杜鹃内生菌在内的丰度较高的内生真菌,具体菌株分别属于锤舌菌纲(Leotiomycetes)、子囊菌门(Ascomycota)(2种菌)、担子菌纲(Basidiomycota)。采用PDA液体培养基对实验菌株进行培养,置于28 ℃摇床上振荡(160 r·min-1)暗培养15 d,打碎并制成液体菌剂备用。供试的外生菌菌株为市场购买的美味牛肝菌。
杜鹃2年生无菌扦插苗种植于花盆中。种植土壤有机质 27.38 g·kg-1,全氮 1.10 g·kg-1,全磷 0.31 g·kg-1,全钾 9.33 g·kg-1,有效氮 33.67 mg·kg-1,有效磷 2.48 mg·kg-1,有效钾 120.90 mg·kg-1,pH 5.39。在种植前利用高温高压法(121 ℃,0.1 MPa)对基质灭菌120 min。
1.2 实验设计
1.2.1 接菌
3个接菌组合,分别为ERM菌株混合接种处理(J1)、ECM+ERM菌株混合接种处理(J2)和等量不接菌的土豆培养液处理(J3)。第一次接菌采用蘸根法,与换盆同时进行,第二次和第三次接菌采用注射法,每次间隔10 d,每盆施用10 mL菌液。
1.2.2 施肥组合
设14组N、P、K施肥配比组合(表1)。N肥主要成分为CO(NH2)2,有效N含量46.2%;P肥主要成分为P2O5,有效P含量为16.0%;K肥主要成分为K2O,有效K含量为51.0%。
1.2.3 实验方法
每个接菌处理下均设置1.2.2中的14个施肥处理,共42个处理,每处理重复9次,共378盆。2018年5月开始实验。实验中进行日常浇水、除草等管理,2019年1月5日至6日采集数据。
1.2.4 项目测定
菌根侵染率采用醋酸墨水染色法统计[14];株高、冠幅用卷尺和游标卡尺在实验前后测量;实验结束时分别采集各处理幼苗,在105 ℃下杀青30 min后于75 ℃烘36 h,然后称取整株植物干重生物量;用蒸馏法、钼蓝比色法、火焰光度计法依次测定植株的N、P、K含量[15]。

表1 施肥方案Table 1 Fertilization scheme
1.2.5 数据处理
利用 SSPS24.0单因素分析比较处理间的差异性,采用Duncan法进行多重比较,用Origin 8.0软件作图及参数分析。
2 结果与分析
2.1 菌根侵染率
取样前对根系用醋酸墨水染色法进行浸染率测定,发现两组接菌组合杜鹃苗均被成功侵染,两组菌株的侵染率存在显著差异(P<0.05),其中ECM+ERM菌株混合接种(J2)侵染率最高,比ERM菌株混合接种(J1)高 4.07%,未接种的对照处理(J3)幼苗根系侵染率为 8.85%,显著低于接种处理幼苗根系的侵染率。
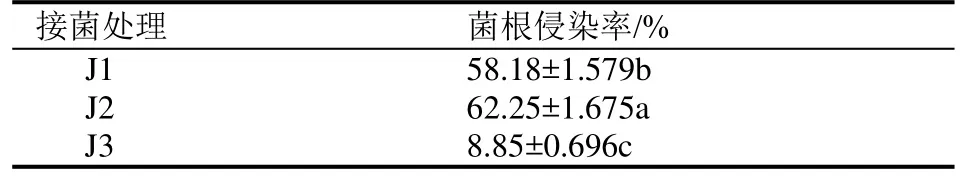
表2 不同接菌处理杜鹃菌根真菌侵染率比较Table 2 Comparison of infection rate of mycorrhizal fungi of azalea under different treatment
2.2 菌根真菌与施肥对杜鹃苗生长的影响
如表3所示,对于株高而言,ERM菌株混合接种(J1)处理中,各施肥处理比 F1(N0P0K0)增加0.16~2.10 倍,F12(N1P1K2)和 F3(N1P2K2)对 ERM菌株混合接种(J1)处理的株高促进作用最为显著;ECM+ERM 菌株混合接种(J2)处理中,各施肥处理比F1增加0.31~1.50倍,F3(N1P2K2)和F6(N2P2K2)对ECM+ERM 菌株混合接种(J2)处理的株高促进作用最为显著;J3对照处理中,各施肥处理比 F1增加0.30~1.98倍,F3(N1P2K2)和F12(N1P1K2)对J3对照株高促进作用最显著。ERM 菌株混合接种(J1)和J3对照处理的N水平在1水平时对杜鹃苗的纵向生长具有明显的促进作用,ECM+ERM菌株混合接种(J2)处理的N水平在1水平和1/2水平时促进株高生长,过低与过高养分都不利于ECM+ERM菌株混合接种(J2)处理杜鹃苗纵向生长,且不同接菌处理的株高是J2>J1>J3。
对于冠幅而言,ERM菌株混合接种(J1)处理中,各施肥处理比F1增加0.10~1.12倍,F6(N2P2K2)对ERM菌株混合接种(J1)处理的冠幅促进作用最显著;ECM+ERM 菌株混合接种(J2)处理中,各施肥处理比 F1增加 0.06~1.35倍,F6(N2P2K2)对ECM+ERM 菌株混合接种(J2)处理的冠幅促进作用最显著;J3对照处理中,各施肥处理比 F1增加0.32~1.55 倍,F12、F13(N1P2K1)、F14(N2P1K1)对J3对照处理的冠幅促进作用最为显著,说明随着施肥量增加而促进冠幅生长。在接菌处理下,N、P、K施用 1/2水平对冠幅促进效果明显,过低与过高养分都不利于冠幅横向生长,且不同接菌处理的冠幅是J2>J1>J3。
对于干重而言,ERM菌株混合接种(J1)处理中,各施肥处理比F1增加0.17~1.77倍,F5(N2P1K2)对ERM菌株混合接种(J1)处理的干重促进作用最显著;ECM+ERM菌株混合接种(J2)处理中,各施肥处理比F1增加0.15~2.24倍,F5对ECM+ERM菌株混合接种(J2)处理的干重促进作用最显著;J3对照处理中,各施肥处理比F1增加0.10~1.63倍,F3、F5、F12、F13、F14施肥处理对J3对照处理的干重促进作用最显著。ERM 菌株混合接种(J1)和ECM+ERM菌株混合接种(J2)处理在施P为1水平时促进效果最显著,J3对照处理在N、P、K施用量为1水平时对干重促进最显著,且不同接菌处理的干重是J2>J1>J3。

表3 菌根真菌与施肥下杜鹃苗生长指标的对比Table 3 Comparison of growth indexes of azalea seedlings with mycorrhizal fungi and fertilization
综上所述,施肥处理F3、F5、F6、F12、F13、F14,接菌处理J2、J1较能有效促进杜鹃苗生长。
2.3 菌根真菌与施肥对杜鹃苗N含量的影响
如表4所示,对于根而言,ERM菌株混合接种(J1)处理中,各施肥处理的N含量比F1(N0P0K0)增加 1.16~6.76 倍,F3(N1P2K2)和 F12(N1P1K2)对ERM 菌株混合接种(J1)处理的氮素积累最为显著,其次是F5(N2P1K2)和F9(N2P2K1);ECM+ERM菌株混合接种(J2)处理中,各施肥处理比 F1增加0.91~19.8倍,F3(N1P2K2)对ECM+ERM菌株混合接种(J2)处理的氮素积累促进作用最显著,其次是F6(N2P2K2);J3对照处理中各施肥处理的N含量比F1增加0.75~5.39倍,F3(N1P2K2)和F12(N1P1K2)对J3对照处理的氮素积累促进作用最为显著,其次是F5(N2P1K2)。可见施用氮磷钾为1水平促进ERM菌株混合接种(J1)处理根系氮素积累,氮为1水平和氮磷钾均为1/2水平促进ECM+ERM菌株混合接种(J2)处理根系氮素积累,氮、磷为1水平促进J3对照处理根系氮素积累,且不同接菌处理杜鹃苗根的氮含量是J1>J3>J2。
在杜鹃苗茎中,ERM 菌株混合接种(J1)处理下各施肥处理比 F1处理氮含量增加 0.89~3.93倍,F3(N1P2K2)对ERM菌株混合接种(J1)处理氮素积累促进效果最明显;ECM+ERM 菌株混合接种(J2)处理中,各施肥处理比 F1处理的氮含量增加 1.45~9.97倍,F3(N1P2K2)对ECM+ERM菌株混合接种(J2)处理氮素积累促进效果最明显;J3对照处理中,各施肥处理比 F1处理氮含量增加 0.13~2.04倍,F3(N1P2K2)、F12(N1P1K2)和 F13(N1P2K1)对 J3 对照处理的氮素积累效果最明显。由此可见,施用氮磷钾为1水平促进ERM菌株混合接种(J1)处理和J3对照处理茎中氮的积累,氮、磷为1水平和氮磷钾均为1/2水平能促进ECM+ERM菌株混合接种(J2)处理茎的氮素积累,且不同接菌处理杜鹃苗茎的氮含量是J1>J3>J2。
在杜鹃苗叶中,ERM 菌株混合接种(J1)处理下各施肥处理比 F1处理的氮含量增加 5.94%~78.32%,ECM+ERM 菌株混合接种(J2)处理下各施肥处理的氮含量增加0.58%~104.11%,J3对照处理下各施肥处理的氮含量增加 23.01%~152.08%。F3(N1P2K2)对ERM菌株混合接种(J1)、ECM+ERM菌株混合接种(J2)处理的氮素积累促进效果最明显,F12(N1P1K2)对J3对照处理氮素积累效果最明显。施用氮磷钾为1水平促进ERM菌株混合接种(J1)处理和J3对照处理叶片氮的积累,氮为1水平和氮磷钾均为1/2水平促进ECM+ERM菌株混合接种(J2)处理叶片氮的积累,且不同接菌处理杜鹃苗叶的氮含量是J2>J3>J1。

表4 菌根真菌与施肥下杜鹃苗根、茎和叶的N含量Table 4 N content in roots, stems and leaves of azalea seedlings under mycorrhizal fungi and fertilization treatment
综上所述,接菌和施肥均能提高植株氮含量,特别是施氮肥;施肥处理为1水平,即F3、F5、F9、F12、F13时,ERM菌株混合接种(J1)和J3对照处理促进植株积累氮含量,而ECM+ERM菌株混合接种(J2)处理除施氮为1水平外,氮磷钾各处理为1/2水平也显著促进植株积累氮含量,ERM菌株混合接种(J1)处理的根茎氮含量高于对照J3,说明ERM菌株混合接种(J1)处理氮含量集中在根茎中,ECM+ERM 菌株混合接种(J2)处理氮素集中在叶片中,J2促进养分向叶片运输。
2.4 菌根真菌与施肥对杜鹃苗P含量的影响
如表5所示,在杜鹃苗根中,ERM菌株混合接种(J1)、ECM+ERM菌株混合接种(J2)处理下各施肥处理比F1处理的P含量分别增加0.30~2.04倍和0.42~1.87倍,F5(N2P1K2)施肥处理对ERM菌株混合接种(J1)、ECM+ERM菌株混合接种(J2)处理的磷积累促进作用最显著;J3对照处理中各施肥处理比处理F1的P含量增加0.20~3.68倍,F12(N1P1K2)和F14(N1P2K1)施肥处理对J3对照处理磷积累促进作用最为显著,其次是F5(N2P1K2)。施用磷或钾为1水平处理(F5、F9)促进 ERM 菌株混合接种(J1)根系磷素积累,磷、钾为1水平(F5、F14)和氮磷钾均为 1/2水平(F6)促进 ECM+ERM 菌株混合接种(J2)根系中磷的积累,氮磷或磷钾为 1水平(F12、F14)促进J3对照处理根系磷素积累。不同接菌处理的杜鹃苗根的磷含量是J2>J1>J3。
在杜鹃苗茎中,ERM 菌株混合接种(J1)、ECM+ERM 菌株混合接种(J2)处理下各施肥处理比F1处理的 P含量分别增加 0.14~1.62倍和 1.03~5.40倍,F5(N2P1K2)对两种接菌处理磷含量促进作用最为显著;J3对照处理中各施肥处理的P含量比F1增加 0.68~3.78倍,其中 F5(N2P1K2)、F12(N1P1K2)、F13(N1P2K1)、F14(N1P2K1)处理对磷积累的促进作用最为显著,其次是F9(N2P2K1)。施用磷为1水平时促进ERM菌株混合接种(J1)和J3对照处理杜鹃苗茎部磷的积累,磷为 1水平(F5)和氮磷钾均为1/2水平(F6)促进ECM+ERM菌株混合接种(J2)茎部磷的积累。不同接菌处理的杜鹃苗茎的磷含量是J2>J1>J3。
对于叶而言,ERM 菌株混合接种(J1)、ECM+ERM 菌株混合接种(J2)处理中各施肥处理的P含量比 F1处理分别增加 0.39~3.26倍和 0.11~1.63倍,F5(N2P1K2)对 ERM 菌株混合接种(J1)、ECM+ERM 菌株混合接种(J2)处理的磷积累促进作用最为显著;J3对照处理中,各施肥处理的P含量比 F1增加 0.13~0.62倍,F12(N1P1K2)、F13(N1P2K1)、F14(N1P2K1)处理对 J3对照处理叶的磷积累促进作用最为显著,其次是F5(N2P1K2)。不同接菌处理的杜鹃苗叶片磷含量依次是 J3>J2>J1。施用磷、钾为1水平时促进ERM菌株混合接种(J1)处理叶片磷的积累,施用磷为1水平或氮磷钾均为1/2水平时促进ECM+ERM菌株混合接种(J2)处理叶片磷的积累,施用氮磷钾为1水平时促进J3对照处理叶片磷的积累。

表5 菌根真菌与施肥下杜鹃苗根、茎和叶中P含量Table 5 P content in roots, stems and leaves of azalea seedlings under mycorrhizal fungi and fertilization treatment
综上所述,接菌和施肥均能提高根茎P含量,特别是施磷肥;施肥处理的磷钾为1水平时,即F5、F9、F12、F13、F14施肥处理,ERM菌株混合接种(J1)和J3对照处理促进P含量积累,ECM+ERM菌株混合接种(J2)处理除施磷在1水平外,氮磷钾各处理在1/2水平,即F5、F6,也显著促进杜鹃苗P含量的积累;ERM菌株混合接种(J1)、ECM+ERM菌株混合接种(J2)处理的杜鹃苗根和茎P含量高于J3对照,但在叶中低于J3对照,说明接菌处理促进磷养分向根茎积累。
2.5 菌根真菌与施肥对杜鹃苗K含量的影响
如表6所示,对于根而言,ERM菌株混合接种(J1)处理中,各施肥处理比F1增加0.10~1.16倍,F9(N2P2K1)对ERM菌株混合接种(J1)处理钾含量促进效果最显著,其次是F5、F13和F14;ECM+ERM菌株混合接种(J2)处理中,各施肥处理比 F1增加0.11~0.95倍,F9(N2P2K1)对ECM+ERM菌株混合接种(J2)处理钾含量促进效果最显著,其次是 F6;J3对照处理中,各施肥处理比 F1增加 0.29~1.71倍;F9、F13、F14对J3对照处理钾含量的积累作用最为显著,其次是 F5和 F12,且接菌处理是 J3>J1>J2,说明氮磷钾为1水平促进ERM菌株混合接种(J1)和J3对照的积累,钾为1水平和氮磷钾均为 1/2水平促进ECM+ERM菌株混合接种(J2)根系中钾的积累。
对于茎而言,ERM 菌株混合接种(J1)处理中,各施肥处理比F1增加0.12~1.12倍,F9(N2P2K1)对ERM菌株混合接种(J1)处理钾含量促进效果最显著,其次是F5和F14;ECM+ERM菌株混合接种(J2)处理中,各施肥处理比 F1增加 0.11~1.29倍,F9(N2P2K1)对ECM+ERM菌株混合接种(J2)处理钾含量促进效果最显著,其次是F6;J3对照处理中,各施肥处理比F1增加0.13~1.04倍,F9、F13、F14对J3对照处理钾含量的积累作用最为显著,其次是F3、F5、F12,且接菌处理是J2>J3>J1,说明磷和钾为1水平促进ERM菌株混合接种(J1)钾含量的积累,钾为 1水平和氮磷钾均为 1/2水平促进ECM+ERM 菌株混合接种(J2)茎部钾的积累,氮磷钾为1水平促进J3对照的积累。
对于叶而言,ERM 菌株混合接种(J1)、ECM+ERM 菌株混合接种(J2)处理中各施肥处理的钾含量比F1处理分别增加 0.05~1.37倍和0.06~1.40倍,F9(N2P2K1)对 ERM 菌株混合接种(J1)、ECM+ERM 菌株混合接种(J2)的杜鹃苗叶钾积累效果最显著;J3对照处理中,各施肥处理比 F1增加0.19~0.68倍,F9、F13、F14对J3对照处理钾含量的积累作用最为显著,其次是 F5、F12,且接菌处理是J2>J1>J3,说明磷和钾为1水平促进ERM菌株混合接种(J1)钾含量的积累,钾为1水平和氮磷钾均为 1/2水平促进ECM+ERM菌株混合接种(J2)叶部钾的积累,氮磷钾为1水平促进J3对照的积累。
综上所述,接菌和施肥均能提高植株钾含量,特别是施钾肥;氮磷钾施肥在1水平,即F3、F5、F9、F12、F13、F14,ERM 菌株混合接种(J1)和 J3对照促进钾含量积累,ECM+ERM菌株混合接种(J2)处理除施钾在1水平(F9)外,氮磷钾各处理在1/2水平(F6)也显著促进杜鹃苗钾含量的积累;接菌处理根部K含量低于对照,茎部和叶部高于对照,说明接菌处理促进钾向地上部分运输。

表6 菌根真菌与施肥下杜鹃苗根、茎和叶中K含量Table 6 K content in roots, stems and leaves of azalea seedlings under mycorrhizal fungi and fertilization treatment
3 讨论
菌根真菌能与宿主形成良好的共生关系,扩大根系吸收面积,在植株根际形成庞大的菌丝网络,提高植物吸收养分的能力,扩大根系吸收范围,从而促进植物生长[16]。本研究表明,不同养分条件下,接种ERM菌群与ERM+ECM菌群均能显著提高杜鹃苗菌根侵染率和生物量。由此可见,ERM菌群、ERM+ECM 真菌菌群与杜鹃之间的选择适应性更好,可以更好地发挥菌根–植株共生体优势作用。此外,ERM、ERM+ECM真菌菌群对杜鹃的高侵染率和良好的促生长能力,揭示了菌根真菌在喀斯特地区的养分吸收能力与可持续发展的重要潜力。
接种ERM能促进杜鹃对N源的吸收[17—18],因为ERM可分泌胞外蛋白酶、糖酶、几丁质酶等从蛋白质以及复杂有机质中吸收 N素[19]。唐振尧等[20]和Fdriss等[21]认为接种ERM可以提高植物的P含量,菌根共生体能促进难溶P转变为易被根系吸收利用的P[22]。菌丝可以伸到K亏缺区以外,吸收根系吸收不到的K并运输给植物[21]。也有学者指出,接种菌根真菌在提高植物吸收P量的同时也提高植物吸收K量[23]。菌根真菌促进植株对N、P、K的吸收,且主要体现在植株的N、P、K含量上。与对照相比,ERM菌群促进N向根茎部积累,ERM+ECM菌群促进N向叶部运输,ERM、ERM+ECM菌群均促进P向根茎积累,促进K向茎叶积累,可能是接种菌根真菌P转运蛋白基因在根茎中表达[24]。此外,接种外生菌根真菌可以使N和K积累在叶中[25—26],而接种ERM真菌菌群N却向根茎积累,其原因可能与菌株类型、菌株间相互作用等因素有关。
研究表明,高养分会抑制菌根真菌生长和代谢活性[27],降低菌根效应,过高养分环境中,植物依靠根系即可吸收养分,满足自身生长需求[28],同时,过量施用养分还会使菌根菌丝成为光合产物的消耗者[29]。本实验中,ERM+ECM真菌菌群在较低养分条件下就能使植株养分吸收量高于其他水平,可能因为低养分条件更有利于菌根效应的发挥[30],而ERM真菌菌群促进植株氮磷钾积累,但是总体远低于ERM+ECM真菌菌群,却高于对照,可能是ERM真菌菌群处理只接种了杜鹃花类内生菌根真菌,杜鹃花类菌根是在皮层细胞充满大量菌丝圈[31],扩大根系面积,促进根系生长,而ERM+ECM真菌菌群是同时接种外生菌根真菌和杜鹃花类内生菌根真菌,皮层细胞充满菌丝圈,同时每个细胞内的菌丝圈都直接同根表面的根外菌丝相联[31],根系面积较只扩大菌丝圈的杜鹃花类内生菌根真菌更大,所以ERM+ECM真菌菌群吸收的养分高于ERM真菌菌群,而接菌处理总体高于不接菌处理,前人对杜鹃花菌根的观察也证实了这一点[32—33]。

