高钙血症型卵巢小细胞癌CT 及超声表现二例
黄华仪 周小琦 肖煦阳 胡笑笑 关键
病例资料病例1:女,22 岁,因间断性下腹胀痛3 d入院。患者于入院3 d 前开始无明显诱因出现间断性下腹胀痛,可自行缓解,伴有尿频尿急,无伴胸闷、心悸、乏力、嗜睡、口干、多饮。实验室检查:基础代谢组合提示血钙3.74 mmol/L(参考值2.10~2.60 mmol/L),血磷0.91 mmol/L(参考值0.97~1.62 mmol/L),血钾3.22 mmol/L(参考值3.50~5.30 mmol/L);妇科肿瘤标记物组合CA-125 117.1 U/ml(参考值0.00~35.00 U/ml)、人附睾蛋白4(HE-4)89.90 pmol/L(参考值绝经前:<70 pmol/L)。本例患者血钙升高明显,但其高钙血症临床症状不明显,入院后临床予生理盐水水化、呋噻米利尿、降钙素静滴等降钙处理。
超声示盆腔内见一巨大混合性肿块影,内部部分为无回声,部分为实性低回声,实质性部分可见较多分支状彩色血流信号(图1a,1b)。CT 平扫及增强示盆腔内见一巨大肿块影,以实性为主,内见大片状密度减低影,增强扫描见实性部分明显强化,不规则坏死区未见强化(图1c~1e)。超声、CT 均诊断为左侧卵巢囊腺癌。
术中所见:经下腹正中向左绕脐切开,进入腹腔可见左侧卵巢包块,大小约12 cm×12 cm×13 cm,囊实性,灰黄、灰红色,表面凹凸不平,包膜光滑完整,与周围无黏连。剪开左骨盆漏斗韧带表面腹膜,游离左卵巢骨盆漏斗韧带,于骨盆入口平面高位断扎,断端双重结扎。切除左侧附件,并送快速病理检查。
病理表现:(左侧附件及卵巢肿物)肿瘤由大小较一致的卵圆形细胞构成,弥漫分布或略呈小巢状,核深染,胞浆少,可见核分裂象(图1f)。免疫组织化学染色结果:瘤细胞CK 灶性(+),CD56 灶 性(+),Syn 灶 性(+),WT1(+),EMA灶性(+),CD99(+),CR 灶性(+),CgA 灶性(+),Ki-67 约50%(+),E-cadherin 部 分(+),M-CEA(-),Inhibinα(-),LCA(-)。病理诊断高钙血症型小细胞癌。
病例2:女,27 岁,因胸闷、心悸、恶心、呕吐1 周入院。患者于入院1 周前开始无明显诱因出现胸闷、心悸、乏力、嗜睡,伴口干、多饮、尿量多及上腹部不适,伴恶心、呕吐,为胃内容物,无咖啡样物,无伴腹痛、腹泻、黑便、血便。实验室检查:基础代谢组合提示血钙3.9 mmol/L(参考值2.10~2.60 mmol/L),血钾3.46 mmol/L(参考值3.50~5.30 mmol/L),血磷0.84 mmol/L(参考值0.97~1.62 mmol/L);妇科肿瘤标记物组合CA125 25.40 U/ml(参考值0.00~35.00 U/ml)、人附睾蛋白4(HE-4)70.70 pmol/L(参考值绝经前:<70 pmol/L)。本例患者血钙明显升高,伴胸闷、心悸、口干、多饮、多尿,高钙血症临床症状明显,临床予血液透析、唑来磷酸、水化等降钙处理。
超声示盆腔内见一巨大肿块影,以实性低回声为主,内见多个小无回声区。实质性部分可见较多分支状彩色血流信号(图2a,2b)。超声诊断:生殖细胞来源肿瘤。CT 平扫及增强示盆腔内见一实性为主的巨大肿块影,其内见斑片状密度减低区,增强后病灶实性部分明显强化,内部斑片状坏死区未强化、密度减低区及小囊变区(图2c~2e)。由于已有两年前对病例1 的诊断经验结合实验室检查,CT诊断为左侧卵巢高钙血症型小细胞癌。
术中所见:经下腹正中绕脐切开,进入腹腔可见左侧卵巢包块,大小约11 cm×11 cm×8 cm,囊实性,灰红色,表面凹凸不平,包膜光滑完整,与周围无黏连,未见明显正常卵巢组织。剪开左侧骨盆漏斗韧带表面腹膜,游离出左侧骨盆漏斗韧带,高位剪断结扎。紧贴宫角钳夹剪断卵巢固有韧带及输卵管,完整取出左侧附件。剖视左卵巢包块,见剖面灰黄色,质实,送冰冻病理检查。
病理表现:(左侧附件)肿瘤细胞呈小圆形或短梭形,胞浆稀少,核大深染,核分裂象易见,排列成团巢状、梁索状或片状,伴片状凝固性坏死(图2f)。免疫组织化学染色结果:瘤细胞CK 个别(+),CD56 部分(+),WT1(+),Vimentin(+),CD99 部分(+),P16 灶性(+),Ki-67 约50%(+),M-CEA、Inhibin-α、CR、EMA、ER、PR、Syn、CgA、TTF-1、LCA、TdT、SALL4、Melan-A、HMB-45 均(-)。病理诊断高钙血症型卵巢小细胞癌。
讨论1.概述
高钙血症型卵巢小细胞癌(hypercalcemic type-small cell carcinoma of the ovary,HT-SCCO)是一种组织起源未定的高度恶性小细胞癌,非常罕见。在WHO 女性生殖器官肿瘤学分类(2014 版)中被归入卵巢杂类肿瘤[1]。本病病因尚不明确。部分学者认为SMARCA4 基因突变导致的BRG1蛋白表达缺失可能是SCCOHT 的病因之一[2-4]。
2.临床病理特征
HT-SCCO 好发于年轻女性,平均年龄22 岁[5],通常为单侧卵巢受累。临床表现缺乏特异性,以腹痛、腹胀及邻近器官压迫症状最为常见。由于肿瘤细胞具有旁分泌特征,可产生甲状旁腺素相关蛋白(PTH-rp)促进骨钙释放入血,从而引起血钙升高,甚至部分患者出现高钙血症症状(如恶心、呕吐、烦渴、多尿等症状[6])。文献报道75%患者伴有血清CA-125 升高[7],HE4 对卵巢实质来源的恶性肿瘤具有更高特异度和敏感度[8]。我院2 例患者术前血钙浓度及HE4 均有升高,1 例伴有CA-125 升高,均符合其临床特征。HT-SCCO 多为单发实性肿瘤,分叶或结节状,直径11~20 cm,切面呈灰白、灰黄色,常伴有囊性变,可见滤泡、黏液性物质及出血灶,质软,偶呈致密颗粒状或质脆。镜下肿瘤主要由相对一致的小细胞组成,大多病例表现为瘤细胞呈滤泡样腔隙,大小不等、形状不规则,腔内含嗜酸性胶样物质[6,9]。免疫组织化学染色结果:常有p53、EMA、CK(AEI/AE3)、Calretnin、WTI 和CD10 阳性,偶见Syn 和CD56 阳性[10,11]。我院2 例患者,其中一例免疫组织化学染色结果示CK、CD56、Syn、WT1、EMA 阳性,另一例免疫组织化学染色结果示CK、CD56、WT1 阳性,均符合HTSCCO 免疫组织化学染色改变。
3.影像诊断体会
术前依靠病变影像学表现(肿块体积大,以实性为主,肿块内见片样坏死,增强扫描实性部分明显强化,由卵巢静脉供血)诊断为卵巢恶性肿瘤并不难,但要定到高钙血症型卵巢小细胞癌比较困难,结合其临床实验室检查高钙血症及CA125、HE-4 升高特点,有助于实现准确的术前诊断。患者多为年轻有生育要求女性,术前诊断明确有助于手术方案的选择。HT-SCCO 主要影像表现为盆腔内体积较大的肿块,直径约11~20 cm,以实性为主,肿块内见斑片样坏死,可互相融合成片状密度减低影,边界较清晰,增强扫描实性部分明显强化,多呈单侧发生,由卵巢静脉供血。本报道中的两例患者的盆腔肿块在CT 和超声上的影像特征基本与之相符。
高钙血症型卵巢小细胞癌的影像表现需与以下疾病相鉴别:(1)卵巢囊腺癌:表现为囊实性肿块,囊壁厚薄不均,囊内可见乳头状璧结节[12]。(2)卵黄囊瘤:血清AFP 升高,可表现为囊壁厚而不均匀的囊实性肿块,增强扫描肿瘤包膜、分隔及实质部分表现为渐进强化,实质内可见丰富的肿瘤血管影[13]。(3)无性细胞瘤:多房实性肿块伴突出的纤维血管分隔,可见坏死、出血及斑点状钙化[14]。(4)卵巢转移瘤:有原发肿瘤病史,胃肠道来源最多见;影像表现病变一般具有完整包膜,边界清晰,常表现为混杂囊实性肿 块[14]。

图1 病例1。a)超声示盆腔内见一巨大混合性肿块影,大小约113 mm×115 mm×122 mm,边界清,类圆形,内部部分为无回声,部分为实性低回声;b)彩色多普勒超声示盆腔肿块实质性部分可见较多分支状彩色血流信号;c)全腹CT 平扫,轴位示盆腔内见一巨大肿块影,以实性为主,内见大片状密度减低影,边界清晰;d)增强CT 轴位及e)冠状位示盆腔肿块实性部分明显强化,不规则坏死区未见强化,肿块由左侧卵巢静脉供血,左侧卵巢静脉增多、增粗;f)病理证实为小细胞癌(HE 染色,×100)
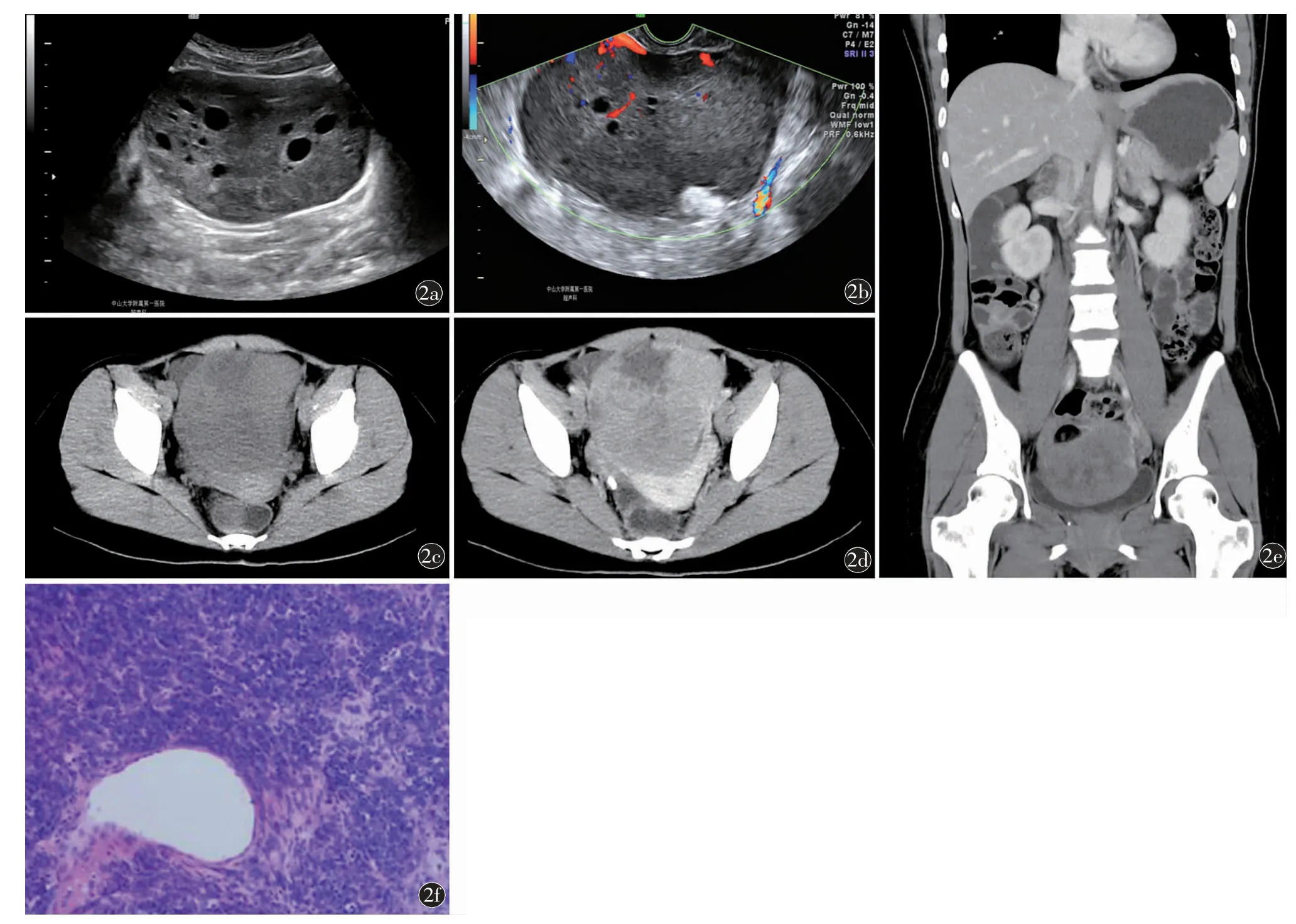
图2 病例2。a)超声示盆腔内见一巨大肿块影,大小约114 mm×81 mm,边界清,类椭圆形,包膜完整,以实性低回声为主,内见多个小无回声区;左侧卵巢显示不清;b)彩色多普勒超声示盆腔肿块实质性部分可见较多分支状彩色血流信号;c)全腹CT 平扫,轴位示盆腔内见一实性为主的巨大肿块影,其内见斑片状密度减低区,边界光整清晰;d)增强CT 轴位及e)冠状位示盆腔肿块实性部分明显强化,内部斑片状坏死区未强化、密度减低区及小囊变区,边缘尚清楚,病灶由左侧卵巢静脉供血,左侧卵巢静脉增多、增粗;f)病理证实为小细胞癌(HE 染色,×40)
4.治疗
目前国际上尚无HT-SCCO 的标准治疗方案,传统治疗方法包括手术及术后的辅助化疗。预后极差,75%的患者在1~2 年内死亡[6,15]。
综上所述,高钙血症型卵巢小细胞癌(HT-SCCO)是一种罕见的恶性肿瘤,好发于年轻女性,结合其影像学特点及实验室检查高钙血症,CA-125、HE4 升高病史,应考虑此病。为了更好的记忆其特点,笔者用顺口溜来总结其特点如下:
桃李年华①瘤似瓜②,
实性为主高强化,
坏死斑斑连成片,
血钙超标预后差。
(注释:①桃李年华:指二十岁女性,这里代指年轻女性;②瓜:代指肿块体积大。)

