放射性分子显像剂在阿尔茨海默病中的应用
代玉银 于丹 关锋 林秋玉 李英华
(1吉林大学第一医院核医学科,吉林 长春 130000;2 空军航空大学基础部)
阿尔茨海默病(AD) 是老年痴呆常见临床类型,随着世界人口逐步向老龄化发展,老年痴呆患者成几何倍数增长,2019年约有新增病例1 000万人。在中国,65岁以上人群患病率已超过5%,且随着年龄的增长明显升高〔1,2〕。AD是一种不可逆性、进展性神经退行性疾病,是常见的神经系统变性疾病之一〔3〕。病理特征是神经细胞外β淀粉样蛋白(Aβ)老年斑(SPs)沉积和神经纤维缠结(NFTs)形成和广泛神经元及神经突触的丢失,临床特征是记忆缺失和认知损害〔4~6〕。AD临床症状出现前15年即发生病理变化,确诊时神经系统通常已发生不可逆的损伤,通常在确诊后7~10年内死亡〔7,8〕。目前AD的诊断方法主要包括临床行为学测试、磁共振成像(MRI)、正电子发射计算机断层显像-计算机断层成像(PET-CT)、脑脊液标志物检测〔9,10〕。其中PET-CT是分子级别的功能影像学手段,能够在CT、MRI尚没有明显解剖结构改变前,提供病灶的功能和代谢信息,从而达到皮摩尔级别浓度下进行无创、精准诊断,及时反映病情进展及严重程度〔11〕。PET-CT是当今核医学发展最为迅猛的领域,也是最先进、最灵敏的分子显像技术,在AD诊断中显示出显著优势〔12,13〕。本文对PET-CT检查所用放射性分子显像剂葡萄糖、Aβ和tau蛋白显像的研究及临床应用现状进行综述。
1 糖代谢类放射性分子显像剂
人脑代谢的主要能源是葡萄糖,18F-脱氧葡萄糖(FDG)作为葡萄糖的类似物,是临床上最常用的PET-CT显像剂,它与天然葡萄糖的代谢途径一致,能够反映细胞内糖代谢水平,18F-FDG进入细胞,在己糖激酶作用下磷酸化,但不能进行下一步代谢,使其能长时间停留在细胞内,从而反映不同细胞的糖代谢水平。AD患者由于大脑皮质神经元变性,发生萎缩,其PET-CT典型表现为双侧颞、顶、额叶代谢减低,特别是颞、顶叶的皮质降低最明显,早期双侧不对称的发生,随着病情的逐步进展,范围逐渐加大,最后累及额叶皮质并呈现对称性〔11〕。通过PET-CT扫描,可用于AD的诊断及鉴别诊断。Zhang等〔14〕分析研究18F-FDG的PET-CT,预测其诊断敏感性为78.7%,特异性为74.0%。Bloudek等〔15〕研究表明,18F-FDG能够精准诊断AD,但缺点是缺乏特异性。
2 Aβ类放射性分子显像剂
Aβ由淀粉样前体蛋白(APP)序列发生断裂后生成,一般由39~43个氨基酸构成。异常聚集的Aβ是SPs主要成分,其病理学特征是蛋白酶类代谢异常,导致Aβ的生成大于降解,Aβ沉积是导致AD的一个重要因素,在治疗中起重要作用。在AD早期,Aβ就已出现明显的沉积现象,并逐步达到饱和状态,之后沉积不再随病情加重而增加。在FDG显像中,脑代谢随着病情加重而持续降低,葡萄糖代谢降低与Aβ沉积并未呈现线性关系,对于AD患者,Aβ沉积理论上早于FDG摄取降低,Aβ显像能够比葡萄糖代谢显像更早地预测及诊断AD〔16,17〕。
目前有三种已被美国食品药品监督局(FDA)批准使用的Aβ显像剂,分别是11C-匹兹堡化合物(PIB)、18F-Florbetapir(18F-AV45)和18F-Flutemetamol(18F-GE67)。
2.1硫磺素(Th)T类衍生物 ThT是用于诊断AD的苯并噻唑类荧光染料,难以穿透血脑屏障(BBB)。在此基础上研发的11C-PIB〔18,19〕,如图1所示,其亲脂性好(LogP=2.48),能够顺利穿透BBB,迅速进入脑内并很快从正常脑组织清除(大脑摄取值2 min∶30 min为11∶4)。其与Aβ具有良好的亲和能力,且与Aβ发生特异性结合,而其放射性代谢产物无法穿透BBB,使其在Aβ处凝聚,由此来诊断早期AD。
由于11C半衰期较短(20 min),合成效率低下,而18F具有相对更长的半衰期(110 min),空间分辨率及灵敏度高的特点,基于ThT结构,衍生出18F标记的另一种放射性显像剂18F-GE67,如图1所示,临床研究表明,二者对Aβ结合能力相似。Mountz等〔20〕对比两种药物后认为18F-EG67和11C-PIB之间存在高度线性相关,表明两种示踪剂具有相似的保留特性。当使用标准化技术将扫描分类为Aβ阳性或阴性时,其与标准摄取值(SUV)相关性很高。
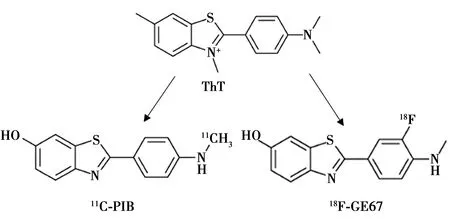
图1 Th T及其衍生物11C-PIB和18F-GE67
2.2二苯乙烯基吡啶类衍生物18F-AV45是第一批获得美国FDA批准上市的二苯乙烯类药物,如图2所示,它具有快速进入BBB的能力,并与Aβ特异性结合。静脉注射40 min后即可获得优质图像。临床研究显示,18F-AV45可用于区分AD和正常对照组,其敏感性为92%,特异性100%。但与11C-PIB相比,18F-AV45在脑白质区域有较高的非特异性摄取,对医生的分析判断造成一定困难〔21〕。专利持有者礼来公司规范了图像分析方法,一定程度上提高了分析的准确性〔22〕。刘楠等〔23〕使用国产氟多功能模块,通过自主合成前体AV105,成功标记合成18F-AV45,标记率为(20.3±2.2)%(n=5,未经衰减校正),放化纯>98%。
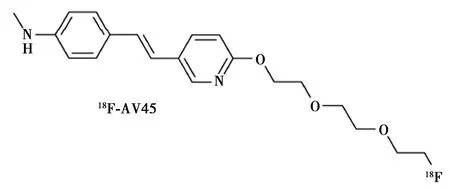
图2 美国礼来公司18F-AV45结构
3 Tau蛋白类放射性分子显像剂
Tau蛋白是人体细胞内微管蛋白(MAPs)的一种,是一种含磷糖蛋白,构成神经细胞骨架成分,位于第17号染色体的长臂上,由31~32个氨基酸序列构成。Tau蛋白分布广泛,主要有大脑额叶、颞叶、海马和外周神经细胞的轴突内。正常人体内Tau蛋白磷酸化是维持生理功能的正常现象,磷酸化位点很少,但是AD患者脑内Tau蛋白发生过度磷酸化,并聚集起来形成双螺旋纤维丝(PHF),进而形成细胞内的NFTs,并含有神经毒性,导致神经元退行性病变,AD患者脑内Tau蛋白随着病情增加而增加,由此,监测大脑内Tau浓度即可判断AD进展〔24,25〕。相比Aβ蛋白异常沉积,Tau蛋白能更早发现AD患者,这对评估与治疗意义重大,所以也是目前研究者们关注的热点。
Tau蛋白类放射性分子显像剂目前已研发出多种类型,如图3所示。第一代Tau蛋白类显像剂包括喹啉衍生物,BF-158、BF-170和BF-242(THK523)〔26〕。其中Harada等〔4〕对比18F-THK523与11C-PIB,证实18F-THK523对Tau的亲和力明显高于对Aβ蛋白的亲和力。放射自显影研究证明其在AD患者脑内PHF浓聚,对转基因小鼠的小动物PET-CT也证实了这点。然而,临床PET-CT研究发现,AD患者大脑灰质未发现Tau蛋白沉积,原因可能是这种示踪剂与其亲和力不强导致〔27〕。18F-THK5105和18F-THK5117改进了合成工艺,提高了其在PHF的亲和力和特异性结合。这两种放射性示踪剂在健康人群和AD患者脑内有明显的摄取区别。Okamura等〔28〕对比了11C-PIB与18F-THK5105和18F-THK5117,结果显示18F-THK5105在AD患者皮质的滞留时间明显高于健康对照组,与tau蛋白的分布吻合,与患者病情严重程度呈线性关系,而与11C-PIB的分布无关联性。对比示踪剂18F-THK5117发现,AD患者颞叶摄取明显增高,且海马部位摄取与海马体积正相关,提示其有更高的灵敏度与特异性结合〔29〕。
研究人员还研发了苯并咪唑嘧啶衍生物18F-fortaucipir(18F-T807或18F-AV-1451)与18F-T808正电子分子显像剂,18F-T808在AD患者脑内均与PHF发生特异性结合,敏感性远高于Aβ〔30〕。放射自显影研究表明,18F-T807与Tau蛋白沉淀结合,但不与Aβ结合,PET-CT研究表明,AD患者脑内颞叶和顶叶后皮质聚集明显,18F-T807分布遵循已知的NFTs分布,其数量与面积与痴呆的严重程度呈正相关〔31〕。在一些正常健康老年人中,也观察到了聚集现象,少数病例报告中提示,延迟扫描发现新皮质的保留率增高,18F-T807是否能真正反映AD患者Tau蛋白与正常老年人的区别有待进一步确认〔32〕。
在第一代Tau蛋白放射性分子显像剂研发之后,几家制药公司一直在努力改进Tau-PET-CT的特异性结合和药代动力学。其中18F-RO6958948(18F-RO-948)、11C-RO6931643(11C-RO-643)和11C-RO6924963 (11C-RO-963)是三种很有潜力的放射性分子显像剂〔33〕。这三种显像剂都能在Tau蛋白浓聚,并且对NFTs有很好的特异性结合和药代动力学,而对Aβ不敏感。其中18F-RO-948小鼠的PET-CT研究表明,其代谢与分布符合临床AD患者的病理。对比研究表明18F-RO-948比11C-RO-643和11C-RO-963有更好的本底,更长的半衰期及稳定性〔34〕。18F-GTP1基于18F-T808设计,用来提高18F-T808脱氟后的不稳定性,临床研究显示18F-GTP1成功阻止了显像剂在颅骨的浓聚,而且能明确区分AD患者与对照组〔35〕。18F标记苯基/吡啶-丁二烯基-苯并噻唑(PBB)类衍生物,18F-AM-PBB3和18F-PM-PBB3,由日本的国家放射科学研究所所开发。新的显像剂有更良好的本底背景降噪,能够突出目标信号,更便于临床观察。18F-MK-6240是由默克公司开发的一种异喹啉胺衍生物,与PHF-Tau结合,有很高的灵敏度和特异性。研究表明,18F-MK-6240在大脑灰质中聚集,其分布与NFTs神经病理分期一致,未观察到其在基底神经节浓聚,只有轻微的滞留发生在黑质和脑膜中〔36〕。
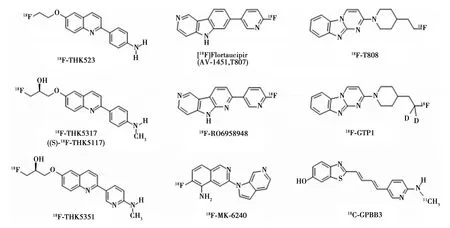
图3 几种Tau蛋白类分子显像剂结构
4 结论与展望
放射性分子显像剂的研究使无创监测老年AD进展成为可能,随着Aβ放射性分子显像剂的研究,尤其是近年来Tau蛋白显像剂的大力发展,将进一步推动对AD患者自然过程的了解,特别是对Tau蛋白病理学进展的了解〔37〕。然而,这项技术依然存在一些问题亟待解决,现有的Tau类分子显像剂还没有被尸检完全证实,与Aβ蛋白类分子显像剂相比,临床研究还比较匮乏,建立Tau-PET-CT作为PHF-Tau的生物标志物,就必须确定Tau蛋白类分子显像剂在大脑内的分布与Tau蛋白分布吻合,需要影像学与尸检相互验证〔38〕。目前为止,Aβ和Tau蛋白病理学与老年AD进展的研究有助于澄清AD的形成史。最新研究发现,Tar DNA结合蛋白(TDP)-43可能是除Aβ和tau蛋白以外与AD发病相关的第3种蛋白质,针对TDP-43研发新的放射性分子显像剂,例如小胶质细胞和星形胶质细胞,被认为是在各种蛋白质错误折叠而引发神经变性过程中起到关键作用,星形胶质细胞也被认为与AD进展和其他神经退行性疾病密切相关〔39,40〕。发展新型放射性分子显像剂,结合PET-CT技术,必将成为诊断、评估与治疗AD的一把利器。

