背根神经节STAT3/CCL2信号通路在泰素诱导慢性疼痛中的作用
廖维勇,王 勇,黄文君,唐名杰
(1.桂林医学院生理教研室,2.桂林市妇女儿童医院肿瘤科,广西桂林 541500)
泰素是治疗实体瘤的一线抗肿瘤药物,长期使用泰素可导致患者出现痛性神经病变,主要表现为痛觉过敏或自发性疼痛等慢性疼痛[1-2]。该种痛性神经病变经常是患者化疗终止或者化疗药物剂量减少的重要原因,严重影响肿瘤患者的治疗[3-4]。由于泰素诱导慢性疼痛的机制并不清楚,目前并无有效的防治手段。炎症反应可促进细胞因子或趋化因子表达上调,并参与多种生理、病理过程[5]。趋化因子CCL2 也称单核细胞趋化蛋白,通过募集巨噬细胞或者小胶质细胞,参与神经系统疾病[6]。此外,同行的研究显示:趋化因子CCL2也参与了神经损伤诱导的痛觉过敏[7],抑制CCL2上调显著缓解神经损伤诱导的慢性疼痛[8]。然而,目前并不清楚背根神经节CCL2 是否参与泰素诱导的慢性疼痛,且其上调机制也无文献报道。本研究拟观察连续腹腔注射泰素后,背根神经节CCL2 和转录因子STAT3 表达变化,同时观察抑制CCL2 或STAT3 功能后,机械性慢性疼痛的变化;最后明确STAT3 是介导CCL2 上调的上游分子。
1 材料与方法
1.1 实验动物和分组
SPF 级成年雄性SD 大鼠,体质量220~280 g,桂林医学院实验动物中心提供。于12 h 光照-黑暗循环、安静环境下单笼饲养,自由饮水摄食。室温(22.0±0.5)℃,湿度(55±10)%。所有实验操作均按照桂林医学院实验动物中心伦理要求和使用原则进行。大鼠随机分成6 组,6 组动物的平均体质量差异无统计学意义,包括:溶剂对照组24 只、泰素组18 只、鞘内注射CCL2 中和性抗体+泰素组6 只、鞘内注射S3I-201+泰素组6 只、泰素+溶剂组6 只、鞘内注射C188-9+泰素组6 只。
1.2 鞘内注射
参照同行的方法[9],异氟烷麻醉后,俯卧大鼠,以微量注射器从L4-L5 椎间隙缓慢进针,大鼠尾巴突然出现颤动或甩动,表示成功穿入鞘内,保持穿刺针位置不变将溶剂或药物缓慢注入。
1.3 行为学测试
利用Von Frey 纤毛评估动物的50%后爪撤足阈值。初次测试前,大鼠在测试笼中连续适应3 d,每天2 h。给药后进行测试,应用不同强度的von Frey 纤维丝通过箱底金属网孔对大鼠足底部皮肤施加机械性刺激,von Frey 纤维丝垂直,微弯,在大鼠足心部停留6~8 s。以2.041 g 刺激强度为初始刺激强度。如果撤足反应为阴性,则再选用刺激强度呈对数递增的相邻von Frey 纤维丝继续刺激。如果大鼠出现快速的撤足反应或舔足反应,表示撤足反应为阳性,则再选择相邻递减的刺激强度给予刺激,并记录刺激的强度。从出现阳性反应的前一次开始,共测6 次。每次检测间隔至少5 s,记录测量值(表),采用“up-down”的方法计算得出50%撤足阈值(50%withdrawal threshold):

公式中Xf=最末次测试强度的对数值,κ值根据撤足反应模式查表得出,δ=von frey 纤维笔之间对数差值的均值。50%撤足阈值数值大小直接反映大鼠机械性痛阈的高低。
1.4 免疫组织荧光实验
分别于不同时间点腹腔注射戊巴比妥钠(50 mg/kg)深度麻醉,迅速主动脉插管,快速灌注4 ℃生理盐水250 mL,后用4 ℃多聚甲醛溶液(40 g/L)400 mL 灌注固定。取L4-L6 背根神经节置于预冷的多聚甲醛溶液后固定3 h。30%蔗糖溶液脱水3 d。冰冻切片,厚度15 μm,PBS 清洗切片3 次,每次5 min。室温下,驴血清封闭1 h 后加入一抗:抗CCL2抗体(1∶200,Santa Cruz)、抗GFAP抗体(1∶500,Chemicon)、抗NF-200 抗体(1∶500,Chemicon)、抗IB4 抗体(1∶500,Chemicon)以及抗STAT3 抗体(1∶500,abcam),4 ℃孵育过夜。后用PBS 洗涤3 次,加入相应的青色荧光染料(Cy3)标记和异硫氰酸荧光素(FITC)标记的IgG(1∶200,Jackson Immuno Research),于室温下避光孵育1 h,PBS 清洗3 次。莱卡显微镜(Leica,Germany)下观察并拍照。
1.5 Western blot 实验
在不同时间点,戊巴比妥钠(50 mg/kg)麻醉下,迅速取L4-L6 背根神经节,按照每100 mg 组织加入1 mL 蛋白裂解液,低温匀浆,超声破碎,4 ℃16 000 ×g离心30 min,取上清液。采用BCA 蛋白浓度测定试剂盒测定蛋白浓度,后吸取等量样品加入上样缓冲液煮沸10 min。SDS 凝胶电泳分离目的蛋白,并转至PVDF 膜上。5%脱脂奶粉封闭PVDF 膜1 h,孵育CCL2、STAT3 或β-actin 一抗。次日TBST 缓冲液清洗3 次,后用羊抗兔辣根过氧化物酶标记的二抗孵育2 h。TBST 清洗2 次后,滴加ECL 溶液,使用化学发光成像系统LAS-400(GE 公司,美国)曝光。使用Image J 软件分析图像结果。

表1 被检查的mRNA 引物序列Table 1 Specific Primer Sequences used for PCR
1.6 RT-qPCR 检测
在不同时间点,戊巴比妥钠(50 mg/kg)麻醉下,迅速取L4-L6 背根神经节。使用Trizol 溶液抽提总RNA。按照PCR 产品试剂盒的操作说明进行实验。表1显示PCR引物序列。反应程序如下:95 ℃,3 min;95 ℃,30 s;60 ℃,20 s,40 个循环。将所得Ct 值按2-ΔΔCT方法进行数据处理。
1.7 统计学方法
使用SPSS 22.0 统计分析软件进行统计学分析,计量资料采用均数±标准差表示。正态性检验采用Shapiro-wilk 方法进行,P>0.1 表示数据符合正态分布。符合正态分布的多组计量数据比较,采用单因素方差分析,对方差齐的数据,两两比较时采用Tukey′s 法进行校正;当方差不齐时,两两比较时采用Dunnett′s T3 法进行校正。采用Person 相关分析CCL2 蛋白表达量和STAT3 蛋白表达量之间的关系。多时间点重复测量的数据采用重复测量方差分析进行比较。以α=0.05 为差异有统计学意义。
2 结果
2.1 腹腔注射泰素上调背根神经节CCL2 表达
相对于生理盐水组,连续腹腔注射泰素显著诱导机械性痛觉过敏(图1A),重复测量方差分析结果表明,相较于腹腔注射生理盐水的大鼠,注射泰素的大鼠机械痛阈较低,差异具有统计学意义(F=199.44,P<0.001),而且机械痛阈差异随时间变化而变化(F=7.04,P<0.001;表2)。Western blot 结果显示:经方差分析,4 组间差异有统计学意义(F=19.22,P<0.001);进一步作两两比较,发现Vehicle 组与注射泰素第1 天比较CCL2 蛋白无明显变化,差异无统计学意义(P=0.666),而与注射泰素第4 天(P=0.025)和第10 天(P=0.009)比较CCL2 蛋白显著上调,差异有统计学意义,提示与生理盐水组相比,注射泰素后第4 天,背根神经节CCL2 蛋白表达显著上调,并维持到第10 天(实验结束;图1B)。RT-qPCR 检测显示:经方差分析,4 组间差异有统计学意义(F=27.04,P<0.001);进一步作两两比较,发现Vehicle 组与注射泰素第1 天比较CCL2 蛋白无明显变化,差异无统计学意义(P=0.720),而与注射泰素第4 天(P<0.001)和第10 天(P<0.001)比较CCL2 mRNA 均明显上调,差异有统计学意义,提示首次注射泰素后第4 天和第10 天,CCL2 mRNA表达也显著上调(图1C)。以上结果提示,泰素诱导的CCL2 蛋白上调可能源于靶基因的转录增强。
表2 PTX 诱导痛觉过敏Table 2 Injection of paclitaxel(PTX)induced mechanical allodynia (±s)

表2 PTX 诱导痛觉过敏Table 2 Injection of paclitaxel(PTX)induced mechanical allodynia (±s)
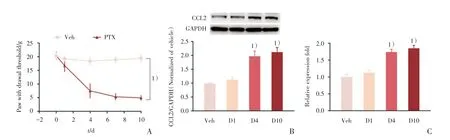
图1 腹腔注射泰素增加背根神经节CCL2 的表达Fig.1 Paclitaxel application increases the expression of CCL2 in DRG
2.2 表达于背根神经节神经元CCL2 介导泰素诱导的慢性机械性痛觉过敏
免疫组织荧光结果进一步显示:首次泰素注射后第10 天,背根神经节CCL2 的荧光强度显著高于对照组(图2A),且CCL2 主要与NF200 阳性的大神经元和IB4 阳性的小神经元共染,与GFAP阳性的胶质细胞不存在共染(图2B)。重要的是,行为学结果显示:预先注射CCL2 中和性抗体,显著缓解泰素诱导的机械性痛觉过敏,重复测量方差分析结果表明,注射不同药物的大鼠机械痛阈差异具有统计学意义(F=50.69,P<0.001),而且机械痛阈差异随时间变化而变化(F=3.94,P<0.001)。组间比较结果显示:腹腔注射生理盐水的大鼠机械痛阈高于注射泰素的大鼠,差异有统计学意义(P<0.001);鞘内注射CCL2 中和性抗体的大鼠机械痛阈高于注射对照抗体的大鼠,差异有统计学意义(P<0.001;表3,图2C)。
2.3 转录因子STAT3 上调介导泰素诱导机械性痛觉过敏
研究显示:转录因子STAT3可通过调节细胞因子的表达,从而参与神经免疫疾病[10]。我们检测了STAT3 的表达。免疫印迹结果显示:经方差分析,四组间差异有统计学意义(F=32.59,P<0.001);进一步作两两比较,发现应用泰素的第1 天与Vehicle 组相比,STAT3 蛋白表达量无明显改变,差异无统计学意义(P=0.626),而应用泰素的第4天(P<0.001)和10 天(P<0.001),与Vehicle 组相比STAT3 蛋白的表达显著升高,差异具有统计学意义(图3A)。免疫组织荧光实验进一步证实:腹腔注射泰素显著上调STAT3 表达(图3B),且上调的STAT3 表达在NF200 阳性的大神经元和IB4 阳性的小神经元共染(图3C)。此外,行为学结果显示:注射STAT3 的抑制剂S3I-201,显著缓解泰素诱导的机械性痛觉过敏,重复测量方差分析结果表明,注射不同药物的大鼠机械痛阈差异具有统计学意义(F=36.03,P<0.001),而且机械痛阈差异随时间变化而变化(F=3.12,P=0.005)。组间比较结果显示:腹腔注射生理盐水的大鼠机械痛阈高于注射泰素的大鼠,差异有统计学意义(P<0.001);鞘内注射CCL2 中和性抗体的大鼠机械痛阈高于注射对照抗体的大鼠,差异有统计学意义(P=0.003;表4,图3D)。此外,鞘内注射另一种STAT3 的抑制剂C188-9 后也显著缓解泰素诱导的痛觉过敏。重复测量方差分析结果表明,注射不同药物的大鼠机械痛阈差异具有统计学意义(F=44.83,P<0.001)。组间比较结果显示:腹腔注射生理盐水的大鼠机械痛阈高于注射泰素的大鼠,差异有统计学意义(P<0.001);鞘内注射CCL2 中和性抗体的大鼠机械痛阈高于注射对照抗体的大鼠,差异有统计学意义(P=0.001;表5,图3E)。以上结果表明,背根神经节神经元表达的STAT3 参与泰素诱导的慢性疼痛。
表3 CCL2 的中和性抗体缓解PTX 诱导痛觉过敏Table 3 Application of CCL2 neutralizing antibody attenuated the paclitaxel-induced mechanical allodynia (±s,g)

表3 CCL2 的中和性抗体缓解PTX 诱导痛觉过敏Table 3 Application of CCL2 neutralizing antibody attenuated the paclitaxel-induced mechanical allodynia (±s,g)
PTX:paclitaxel

图2 背根神经节神经元CCL2 的上调介导泰素诱导慢性疼痛Fig.2 Enhanced CCL2 expression in DRG neurons contributing to the paclitaxel-induced mechanical allodynia
2.4 STAT3 介导泰素诱导的CCL2 上调
为了确定是否STAT3 介导泰素诱导的CCL2上调,我们首先执行了双荧光实验。结果显示:在背根神经节中,STAT3 表达在CCL2 阳性细胞中,两者表现出明显的共定位(图4A)。将CCL2 和STAT3 蛋白表达情况采用Pearson 相关性分析,其表达呈正相关,差异具有统计学意义(r=0.98,P<0.001;图4B)。重要的是,鞘内注射STAT3 抑制剂S3I-201 显著抑制泰素诱导的CCL2 蛋白上调(图4C),免疫印迹结果经方差分析发现3 组间差异有统计学意义(F=43.97,P<0.001);进一步作两两比较,发现PTX 组与Vehicle 组相比,CCL2蛋白明显上调,差异具有统计学意义(P<0.001),PTX+S3I-201 组与PTX 组相比,CCL2 蛋白明显下调,差异具有统计学意义(P=0.001)。同时,S3I-201 也显著抑制CCL2 mRNA 表达(图4D),RT-qPCR 结果经方差分析发现3 组间差异有统计学意义(F=42.04,P<0.001);进一步作两两比较,发现PTX 组与Vehicle 组相比,CCL2 mRNA 明显上调,差异具有统计学意义(P<0.001),PTX+S3I-201组与PTX 组相比,CCL2 mRNA 明显下调,差异具有统计学意义(P<0.001)。此外,鞘内注射另一种STAT3 的抑制剂C188-9,也能够显著抑制CCL2 mRNA 的表达(图4E),RT-qPCR 结果经方差分析发现3 组间差异有统计学意义(F=14.59,P<0.001);进一步作两两比较,发现PTX 组与Vehicle 组相比,CCL2 mRNA 明显上调,差异具有统计学意义(P<0.001),PTX+C188-9 组与PTX 组相比,CCL2 mRNA 明显下调,差异具有统计学意义(P=0.002)。
表4 S3I-201 缓解PTX 诱导痛觉过敏Table 4 Application of S3I-201 attenuated the paclitaxel-induced mechanical allodynia (±s,g)
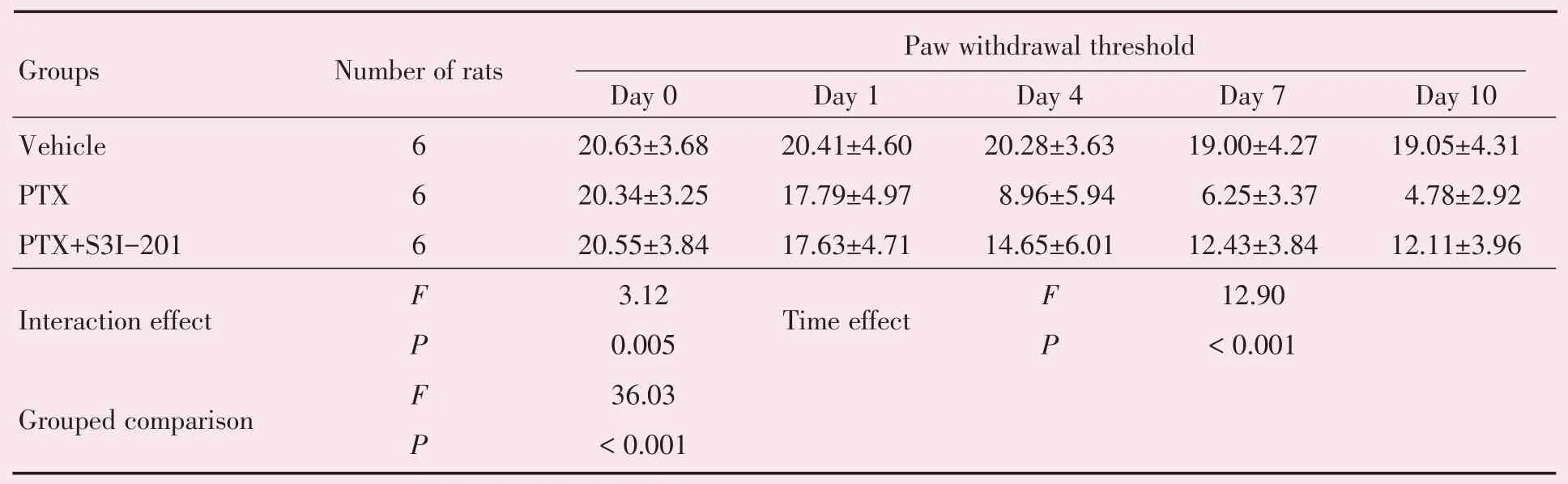
表4 S3I-201 缓解PTX 诱导痛觉过敏Table 4 Application of S3I-201 attenuated the paclitaxel-induced mechanical allodynia (±s,g)
PTX:paclitaxel
表5 C188-9 缓解PTX 诱导痛觉过敏Table 5 Application of C188-9 attenuated the paclitaxel-induced mechanical allodynia (±s,g)

表5 C188-9 缓解PTX 诱导痛觉过敏Table 5 Application of C188-9 attenuated the paclitaxel-induced mechanical allodynia (±s,g)
PTX:paclitaxel
3 讨论
研究已显示:神经炎症反应参与化疗药诱导的痛觉过敏[11]。本研究发现:泰素显著上调背根神经节CCL2 蛋白和mRNA 的表达,鞘内注射CCL2 中和性抗体缓解泰素诱导的机械性痛觉过敏。此外,泰素也增加了STAT3 的表达,且CCL2和STAT3 共表达在背根神经节相同神经元中。预先应用STAT3 抑制剂S3I-201 缓解慢性疼痛,同时阻断泰素诱导的CCL2 蛋白和mRNA 的上调。这些结果表明:转录因子STAT3 通过上调背根神经节CCL2 表达,介导化疗药泰素诱导的慢性疼痛。

图3 背根神经节神经元STAT3 上调参与泰素诱导痛觉过敏Fig.3 Upregulation of CCL2 expression involved in paclitaxel-induced allodynia in DRG neurons
CCL2,作为一个可以被神经元合成并释放的趋化因子,已被证实在几种病理性疼痛模型中介导疼痛反应[12]。此外,报道显示:脊髓背角CCL2/CCR2 信号通路参与紫杉醇诱导的痛性神经病变[13]。目前的研究显示:泰素处理显著增加背根神经节神经元CCL2 的表达,且鞘内注射CCL2 中和性抗体缓解泰素诱导的机械性痛觉过敏。这些结果表明:外周和中枢CCL2 均可能参与化疗药泰素诱导的痛性神经病变。研究也显示:CCL2 显著增加背根神经节神经元的兴奋性突触后电流的频率[14],因此,泰素诱导上调的CCL2 可能通过提高背根神经节神经元的活性[15],从而介导慢性疼痛。值得注意的是,我们也发现:阻断CCL2 信号通路并没有完全缓解泰素诱导的痛觉过敏,提示其他的分子机制可能也涉及泰素诱导的痛性神经病变。

图4 STAT3 介导泰素诱导的CCL2 上调Fig.4 STAT3-mediated upregulation of CCL2 expression following paclitaxel application
信号转导和转录激活因子3(STAT3)作为一种转录因子,最初被认为介导炎症和免疫反应,现在被认为在中枢神经系统的神经变性、突触可塑性和记忆形成中起着关键作用[10]。研究显示:STAT3 参与神经病理性疼痛的诱导和维持。例如,脊神经损伤显著激活脊髓星形胶质细胞中STAT3[16],且抑制STAT3 激活缓解神经损伤诱导的痛觉过敏[17-18]。目前的研究发现:化疗药泰素的应用显著上调背根神经节STAT3 的表达,且鞘内注射STAT3 抑制剂S3I-201 显著缓解泰素诱导的痛觉过敏。已有研究显示:STAT3 可通过调节脊髓背角趋化因子CXCL12 的表达介导长春新碱诱导的痛觉过敏[19]。在目前的研究中,我们发现,STAT3 与CCL2 共表达在背根神经节同一神经元中,且鞘内注射STAT3 抑制剂阻断泰素诱导的CCL2 表达上调。总之,这些结果提示,背根神经节STAT3 通过介导趋化因子CCL 上调在化疗药泰素诱导的痛觉过敏中起重要作用。

