三嵌段聚合物搭载藻蓝蛋白对人晶状体上皮细胞氧化损伤的保护作用
陈梦婷,郝莉莉,刘 莲,陈填烽,钟敬祥
(暨南大学1.附属第一医院眼科;2.化学院,广东广州 510630)
白内障是全球最常见的致盲性眼病[1],氧化损伤引起细胞凋亡是年龄相关性白内障发病的主要机制之一[2-3]。人晶状体上皮细胞(human lens epithelial cell,HLEC)主要负责调节晶状体的生理平衡[4]。因此,减少HLEC 氧化应激损害并抑制其凋亡,对白内障的防治具有重要作用。在过去的几十年中,天然产物在疾病预防和治疗的应用变得越来越重要。越来越多的植物提取物被发现具有显著的抗氧化和抗凋亡的作用。藻蓝蛋白(phycocyanin,PC)是一种海洋天然提取物,可从多种海藻中分离和纯化[5]。藻蓝蛋白具有抗氧化功能、抗凋亡作用和抗炎作用[6]。藻蓝蛋白能保护红细胞免受氧化损伤[7],抑制肝脏脂质过氧化损伤[8]。纳米材料具有良好的穿透能力和药物递送能力,而生物素共轭的三嵌段聚合物是新型的递送系统,具有更高的生物相容性、生物降解性、稳定性和更低的生物毒性[9]。本研究构建了三嵌段聚合物搭载藻蓝蛋白(PEI-PLGA-PEG @PC,PPP-PC)纳米药物,检测该药物对HLEC 的安全性,探究其在2,2-偶氮(2-甲基丙基咪)二盐酸盐(2,2′-azobis-2-methyl-propanimidamide,AAPH)诱导HLEC 氧化损伤中对细胞的保护作用,并研究其抗细胞凋亡的机制。
1 材料与方法
1.1 实验材料
人晶状体上皮细胞株SRA01/04(中山大学中山眼科中心刘奕志课题组赠送);三嵌段聚合物搭载藻蓝蛋白PPP-PC(暨南大学化学院陈填烽课题组研制);MTT(Beyotime 中国);RIPA 裂解液(Beyotime 中国);BCA 蛋白浓度测定试剂盒(Beyotime中国);AnnexinV-FITC/PI 凋亡试剂盒(Beyotime 中国);SDS-PAGE 凝胶配制试剂盒(Beyotime 中国);GAPDH 兔单克隆抗体(Proteintech 美国)等。
1.2 实验方法
1.2.1 三嵌段聚合物搭载藻蓝蛋白的构建和纯化 取聚乳酸-羟基乙酸[Poly(lactic-co-glycolic acid),PLGA]200 mg 置于烧瓶中,利用溶剂二氯甲烷(50 mL)使其溶解,磁力搅拌器搅拌。另取聚乙二醇(polyethylene glycol,PEG)100 mg、聚乙烯亚胺(polyethyleneimine,PEI)200 mg 及适量催化剂(EDC、NHS)混合,溶于50 mL 的甲醇中,超声使其溶解。将其混合物加入烧瓶中,磁力搅拌7~8 h。收集样品于旋转蒸发,得三嵌段聚合物(PEI-PLGA-PEG,PPP)。再取适量PPP 水溶,取藻蓝蛋白水溶液,两者混合。利用均质机进行均质负载。
1.2.2 人晶状体上皮细胞的培养 人晶状体上皮细胞株SRA01/04 培养于添加有100 mL/L 胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素的高糖培养基中,并在37 ℃、体积分数5% CO2培养箱中培养,常规传代。
1.2.3 PPP 代谢对SRA01/04 细胞的影响 种板:取对数生长期的SRA01/04 细胞进行消化、计数,制成细胞悬液,以7 × 104/mL 的细胞密度种板。细胞过夜贴壁后,用含不同浓度(0、0.625、1.25、2.5 和5 μg/mL)的PEI-PLGA-PEG 的培养基培养12 h;MTT 检测:每孔加入20 μL 甲基噻唑四唑(MTT,5 mg/mL),37 ℃培养箱中孵育5 h,然后将获得的甲赞颗粒溶解在100 μL DMSO 中,用酶联免疫吸附测定仪检测570 nm 吸光度(D570)。
1.2.4 建立AAPH 诱导SRA01/04 细胞氧化损伤模型 按1.2.3 方法细胞种板,细胞过夜贴壁后,更换为含不同浓度(0、1、2、4、8 和16 μmol/mL)AAPH的培养基培养24 h;MTT法检测570 nm吸光度(D570);IC50计算:用SPSS 23.0 软件制图分析,按如下算式计算,IC50是细胞存活率为50%时对应的AAPH 浓度;该浓度即为构建AAPH 诱导SRA01/04 细胞氧化损伤模型的作用浓度。细胞存活率(%)=[(ODDrug-ODBlank)/(ODControl-ODBlank)]×100%[ODDrug:实验孔(含AAPH的培养基和细胞);ODControl:对照孔(不含AAPH 的培养基和细胞);ODBlank:空白孔(不含AAPH 的培养基且不含细胞)]。
1.2.5 筛选PPP-PC 在AAPH 诱导SRA01/04 细胞氧化损伤最佳干预浓度 按1.2.3 方法细胞种板,用含不同浓度(0、0.625、1.25、2.5 和5 μg/mL)PPP-PC 的培养基培养细胞12 h;弃除上清,换成含8 μmol/mL AAPH 的培养基培养24 h,MTT 法检测570 nm 吸光度(D570)。
1.2.6 细胞活力和形态学观察 按1.2.3 方法细胞种板,实验分为3 组:正常对照组、AAPH 损伤组、PPP-PC+AAPH 处理组,培养过夜贴壁后进行相关干预,AAPH 损伤组:加入8 μmol/mL 的AAPH培养24 h;PPP-PC+AAPH 处理组:加入2.5μmol/L的PPP-PC培养12 h后,以8 μmol/mL的AAPH培养24 h;吸除上清,PBS 缓冲液洗涤1 次,加入195 μL的Annexin V-FITC 结合液,加入5 μL Annexin VFITC,10 μL 碘化丙啶(Propidium Idodide,PI)染色液,轻轻混匀,室温避光孵育10~20 min,倒置荧光显微镜下观察,Annexin V-FITC 为绿色荧光,PI 为红色荧光,观察细胞形态、凋亡情况,并摄像分析。
1.2.7 流式细胞仪检测细胞凋亡 同1.2.3 方法种板、实验分组及干预后,收集细胞:用胰酶消化贴壁细胞,收集漂浮在培养基中的细胞,PBS 洗涤一遍,1 000×g离心5 min;染色:加入195 μL 的Annexin V-FITC 结合液使细胞重悬,加入5 μL Annexin V-FITC 和10 μL PI,轻轻混匀,室温避光孵育10~20 min;用流式细胞仪检测并分析结果。
1.2.8 蛋白免疫印迹法检测凋亡相关蛋白表达 取适量蛋白裂解液裂解细胞,得细胞裂解液后离心取上清,用BCA 法测定蛋白浓度。蛋白样品加入5×SDS-PAGE 上清缓冲液混匀后95 ℃变性10 min,冷却后-20 ℃保存。SDS-PAGE 聚丙烯酰胺凝胶电泳:配胶-上样-电泳-转膜-封闭-免疫反应-ECL 显色-定量分析。
1.3 统计学分析
实验数据用SPSS 23.0 统计软件进行分析,计量资料用采用中位数M(P25~P75)描述,对实验数据进行正态性检验和方差齐性检验,数据符合方差分析条件时,采用方差分析,当数据不符合方差分析条件时,多组计量资料比较采用非参数Kruskal-WallisH检验进行,多重比较用Bonferroni法校正,P<0.05 为差异有统计学意义。
2 结果
2.1 低浓度PPP 对SRA01/04 细胞无明显影响
MTT 法检测不同浓度PPP 在SRA01/04 细胞代谢后的存活率。结果显示,不同PPP 浓度细胞组的存活率与空白对照组之间无统计学意义(P>0.05;表1)。低浓度PPP 对SRA01/04 细胞的存活率无明显影响,因此低浓度PPP 对SRA01/04细胞是相对安全的,其降解后的产物对细胞无明显损伤。

表1 PPP 对SRA01/04 细胞的安全浓度筛选Table 1 Safety concentration screening of PPP on SRA01/04 cells[M(P25~P75),μg/mL]
2.2 构建AAPH诱导SRA01/04细胞氧化损伤模型
采用游离自由基引发剂AAPH 体外诱导SRA01/04 细胞损伤来模拟白内障晶状体上皮细胞的氧化损伤,构建SRA01/04 细胞氧化损伤模型。分别用不同浓度(0、1、2、4、8 和16 μmol/mL)AAPH 诱导损伤SRA01/04 细胞24 h,MTT 法检测分析细胞存活率。结果显示,AAPH 呈浓度依赖性造成SRA01/04 细胞损伤细胞,降低细胞存活率(P<0.01;图1),经SPSS 23.0 软件计算,IC50为8.659 μmol/mL,因此本实验以浓度为8 μmol/mL的AAPH 诱导损伤SRA01/04 细胞构建细胞氧化损伤模型。
2.3 筛选PPP-PC 对AAPH 诱导SRA01/04 细胞氧化损伤的最佳作用浓度

图1 AAPH 浓度与SRA01/04 细胞存活率的关系Fig.1 Relationship between AAPH concentration and SRA 01/04 cells survival rate
MTT 法检测各组SRA01/04 细胞氧化损伤后存活率,结果显示,0.625 和1.25 μg/mL 的PPP-PC对SRA01/04 细胞存活率与阴性对照组相比无统计学意义(P>0.05;表2);PPP-PC 浓度为2.5 和5 μg/mL 时SRA01/04 细胞存活率明显提高(P<0.05;表2);而2.5 与5 μg/mL 两组间的细胞存活率无明显统计学意义(P>0.05;表2)。因此,本实验选取的PPP-PC 最佳作用浓度为2.5 μg/mL。
2.4 PPP-PC 减轻AAPH 对SRA01/04 细胞氧化损伤后形态及活性改变
Annexin V-FITC 细胞凋亡试剂盒是用FITC标记的重组人Annexin V 来检测细胞凋亡时出现在细胞膜表面的磷脂酰丝氨酸的一种细胞凋亡检测试剂盒,荧光显微镜下呈现绿色荧光。PI 可以染色坏死细胞或凋亡晚期丧失细胞膜完整性的细胞,呈现红色荧光。结果显示:Control 组为阴性对照,Annexin V-FITC 染色和碘化丙啶染色弱,SRA01/04 细胞处于正常状态,细胞形态正常,细胞间连接紧密(图2A、D);AAPH 组为阳性对照,SRA01/04 细胞用AAPH 处理24 h,死亡细胞不再贴壁,悬浮于培养基中,失去原固有形态,呈圆形,折光性明显增高。存余的贴壁细胞变得皱缩,轮廓增强,边缘僵硬,胞质内大量空泡,大量细胞凋亡,呈绿色荧光和红色荧光(图2B、E);PPP-PC+AAPH 组细胞形态及活力与Control 组相似,仅少量细胞凋亡,呈绿色荧光(图2C、F)。

表2 PPP-PC 对AAPH 诱导SRA01/04 细胞氧化损伤最佳作用浓度筛选Table 2 Screening the optimum concentration of PPPPC on SRA01/04 cells oxidative damage induced by AAPH

图2 PPP-PC 减轻SRA01/04 细胞氧化损伤后细胞活性及形态改变Fig.2 PPP-PC reduces cells activity and morphological changes of SRA01/04 cells after oxidative damage
2.5 PPP-PC 有效抑制AAPH 诱导的SRA01/04细胞凋亡
流式细胞仪检测Annexin V-FITC/PI 荧光染色,分析结果显示,AAPH 损伤组凋亡细胞比例为32.35%(30.17%~33.42%),与空白对照组3.58%(2.90%~3.81%)相比明显增高,组间差异有统计学意义(P<0.05;图3)。而PPP-PC+AAPH 处理组细胞凋亡比例降至11.70%(10.63%~12.17%),与AAPH 损伤组相比明显降低,组间差异有统计学意义(P<0.05;图3)。所以,PPP-PC 可显著抑制AAPH 所诱导的SRA01/04 细胞凋亡。

表3 PPP-PC 有效抑制AAPH 所致SRA01/04 细胞凋亡Table 3 PPP-PC effectively inhibit apoptosis of SRA01/04 cells induced by AAPH
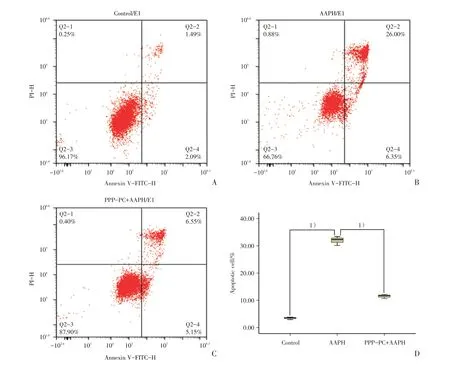
图3 PPP-PC 有效抑制AAPH 所致SRA01/04 细胞凋亡Fig.3 PPP-PC effectively inhibits apoptosis of SRA01/04 cells induced by AAPH
2.6 PPP-PC 影响AAPH 诱导SRA01/04 细胞损氧化伤后凋亡相关蛋白表达
蛋白免疫印迹法检测实验组凋亡相关蛋白表达水平的变化。结果显示,与空白对照组相比,AAPH 诱导SRA01/04 细胞损氧化伤后,能激活SRA01/04 细胞Bax 的表达,同时抑制Bcl-2 的表达,进而上调Bax/Bcl-2 比率,激活Caspase-3 引起细胞凋亡(图4)。当用PPP-PC 孵育细胞后,能提高细胞Bcl-2 的表达,并抑制Bax 表达,进而下调Bax/Bcl-2 比率,抑制Caspase-3 的激活(P<0.05;表4)。在AAPH 诱导的RA01/04 细胞氧化应激损伤中,PPP-PC 主要通过下调Bax/Bcl-2 的表达比例,抑制Caspase-3 的激活,发挥细胞保护作用。

表4 应用蛋白印迹法检测各组凋亡相关蛋白表达Table 4 Detecting the expression of apoptosis related protein by Western blotting in each groups
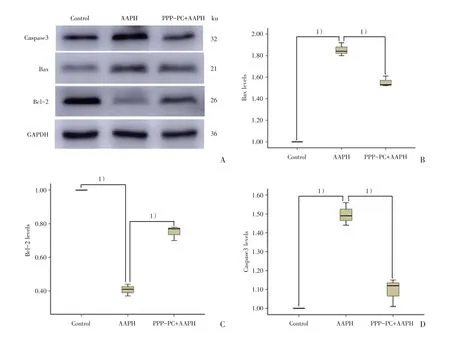
图4 应用蛋白印迹法检测各组凋亡相关蛋白表达Fig.4 Detecting the expression of apoptosis related protein by Western blotting in each groups
3 讨论
年龄相关性白内障的主要发病机制是氧化损伤引起晶状体上皮细胞凋亡[10]。氧是有氧代谢的关键组成部分,有氧代谢过程会产生自由基,例如活性氧(reactive oxygen species,ROS)[11]。人晶状体上皮细胞凋亡是白内障发生和发展的共同分子基础[4],因此,保护晶状体上皮细胞,减轻晶状体上皮细胞氧化应激的损害并抑制其凋亡,是防治白内障的主要靶点。许多研究者研究不同的抗氧化方法来保护晶状体上皮细胞,抑制细胞凋亡,进而达到防治白内障的目的[12]。Liu 等[13]发现使用PTD 融合蛋白技术将抗凋亡蛋白热休克蛋白27(HSP27)导入人晶状体上皮细胞可保护其免受UVB 诱导的细胞凋亡。Qi 等[14]研究发现枸杞多糖能保护人晶状体上皮细胞免受氧化应激诱导的细胞凋亡和衰老。而本研究中,我们第一次将具有抗氧化作用的纳米化三嵌段聚合物搭载藻蓝蛋白运用在眼科进行保护机制的探究,发挥纳米药物的高穿透性、高效性和低生物毒性,并发现三嵌段聚合物搭载藻蓝蛋白对AAPH 诱导人晶状体上皮细胞的氧化损伤具有保护作用。
AAPH是实验中常用的游离自由基引发剂[15-16]。我们通过AAPH 诱导SRA01/04 细胞氧化损伤,模拟白内障发生过程中晶状体上皮细胞的氧化损伤。结果证明AAPH 浓度依赖性的抑制SRA01/04细胞的增殖活力。AAPH 能显著抑制SRA01/04 细胞的增殖,改变细胞的形态,细胞膜出现皱缩,边缘僵硬,胞质内大量空泡,最终细胞破碎和凋亡。
PPP-PC 是纳米化的天然藻蓝蛋白,具有高效性、更高的穿透性和更低的生物毒性。藻蓝蛋白的抗氧化作用已被许多学者证实[10]。Gdara 等[17]发现藻蓝蛋白通过抗氧化电位有效地抗氧化应激产物,从而有效地保护肝移植物并保护其免受缺血再灌注损伤。Lim 等[18]报道藻蓝蛋白通过降低p-ERK,p-JNK,p-p38,Bax,Caspase-9 和Caspase-3 的表达来减弱顺铂诱导的肾毒性。Chan 等[9]研究发现三嵌段聚合物具有良好的生物相容性和生物可降解性,可作为新型药物递送系统,增强药物的细胞穿透能力,提高搭载药物的利用率。本研究通过成功构建三嵌段聚合物搭载藻蓝蛋白,并实验证明PPP 的生物安全性,筛选PPP 安全浓度范围,PPP 作为可降解材料,经细胞代谢后无明显毒性。与前期研究者对藻蓝蛋白抗氧化作用浓度结果相比,PPP-PC 所需的起效浓度明显降低[19]。我们在荧光显微镜下观察细胞形态并检测细胞活性,结果表明PPP-PC 对AAPH 诱导SRA01/04 细胞的氧化损伤有抑制作用,并能减少细胞膜皱缩及胞质空泡的产生,稳定细胞形态。流式细胞计数法检测细胞凋亡发现,PPP-PC 能抑制AAPH 诱导的SRA01/04 细胞氧化损伤后的细胞凋亡,有效保护细胞。
根据相关文献实验方法[20]蛋白印迹分析,AAPH 诱导SRA01/04 氧化损伤上调了Bax/Bcl-2比例。Bcl-2 蛋白家族调控细胞的凋亡,该家族既包含促凋亡成员,又包含促存活成员,可以平衡细胞生命与死亡之间的决定[21]。抗凋亡蛋白Bcl-2在各种细胞中广泛表达,不仅分布在线粒体的外膜中,而且分布在细胞膜、核膜和内质网中。Bax 通过调节线粒体通透性转换孔的开放改变线粒体膜通透性,引起线粒体膜电位的下降及细胞色素c的释放,细胞色素c 激活Caspase-9,引起细胞凋亡,而Bcl-2 可通过与Bax 的竞争性结合而抑制其活性[22]。Caspase-3 是执行细胞凋亡的关键蛋白,负责许多关键蛋白的水解。而PPP-PC 作用AAPH 诱导的SRA01/04 细胞氧化损伤后,抑制Bax/Bcl-2 比例的升高,从而抑制Caspase-3 的活性,减少细胞的凋亡,起到细胞保护作用。
本研究表明,三嵌段聚合物搭载藻蓝蛋白具有抗氧化作用,对氧化应激损伤的人晶状体上皮细胞具有保护作用,其作用机制是通过调控线粒体依赖的凋亡途径。但这是初步研究,具体的相互作用机制可能是很复杂。PPP-PC 对人晶状体上皮细胞的抗氧化作用效果还有待进一步体内实验进行验证。

