脑-肠轴参与β-细辛醚和丹皮酚治疗脑梗死的过程
肖敏,张琦,田博,范清雨
脑梗死是由于动脉阻塞或狭窄引起血流中断,进而发生脑组织坏死[1]。脑-肠轴是将胃肠道与中枢神经系统联系起来的神经内分泌网络,已证明其为多种脑血管病的潜在调节机制[2],但脑-肠轴在脑梗死病理过程中的作用及机制还甚少报道。胆囊收缩素(cholecystokinin,CCK)是从空肠中提取的胆囊收缩因子,为经典肠道激素肽之一[3]。研究表明,除在胃肠道外,CCK 还分布于内分泌细胞、神经元和上皮细胞,因此CCK 已被确定为脑-肠轴的主要成分,参与脑梗死的病理过程[4]。β-细辛醚是石菖蒲的主要成分,其可减轻缺血再灌注诱导的脑自噬[5]。丹皮酚是牡丹皮的主要成分之一,可通过抑制β分泌酶活性和细胞凋亡来保护记忆并减轻脑缺血性损伤[6]。本研究通过建立大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,来探讨β-细辛醚和丹皮酚对缺血再灌注后脑-肠轴的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 雄性SD 大鼠15 只,购自西安交通大学,许可证号为SYXK(陕)2015-002,体质量(250±30)g,自由饮食饮水。将所有动物随机分为3组:假手术组、模型组和治疗组,每组各5只。
1.1.2 主要试剂及材料 β-细辛醚和丹皮酚(购于美国Sigma-Aldrich 公司,纯度99%),Primer Script RT Master Mix kit(购于大连Takara 公司),SYBR Select Master Mix kit(购于上海碧云天公司),促肾上腺 皮质 激素(adreno-cortico-tropic-hormone,ACTH)ELISA 试剂盒(购于上海Novus Biologicals公司)。
1.2 方法
1.2.1 MCAO 模型的建立 采用Zea Longa[7]线栓法对模型组和治疗组大鼠建立MCAO 模型。待缺血2 h后缓慢退出尼龙线,使血流再灌注24 h。假手术组不造成缺血,其余同模型组。
1.2.2 β-细辛醚和丹皮酚的治疗 在建模前7 d,治疗组大鼠每天给予34 mg/kg β-细辛醚灌胃[8]及30 mg/kg 丹皮酚腹腔注射[9],每天各1 次,连续7 d。末次给药后2 h进行MCAO手术造模。假手术组和模型组在相同时间点依照各自的给药方式给予生理盐水。模型组大鼠在建模时1只死亡。采用神经功能评分及TTC染色评价是否造模成功。
1.2.3 神经功能评分 造模成功后6 h,采用Zea Longa[7]法对各组大鼠的神经功能进行评估。无神经功能缺陷为0分,左前爪不能完全伸展为1分,向左旋转为2分,在行走期间向左倾倒为3分,昏迷为4分,死亡为5分。评分1~4分表示造模成功。神经功能评估后,大鼠经麻醉处理,收集血液样本,提取血清,并立即分离脑组织和肠黏膜,用于后续试验。
1.2.4 TTC染色 脑组织进行轻度冰冻,然后沿冠状面用刀片切成5 块,每块厚约2 mm,将切片置于含2%TTC 的0.2 mol/L 的PBS 溶液中,37 ℃避光孵育30 min,PBS 洗3 次,最后在4%的多聚甲醛中浸泡过夜。拍照观察梗死灶的情况,梗死体积采用Image J软件统计分析。
1.2.5 实时定量PCR 采用TriZol试剂从各组大鼠的肠黏膜及脑梗死区中提取总RNA,用Primer Script RT Master Mix kit合成cDNA 第一链,之后采用SYBR Select Master Mix kit 进行实时定量PCR分析,所有操作严格按照说明书进行。GAPDH 为内参。采用2-△△Ct计算目的基因的相对表达量。引物序列:CCK:上游:5’-GCACTGCTAGCCCGATACAT-3’,下游:5’- CCGAAATCCATCCAGCCCAT-3’;GAPDH:上游:5’-AGTGCCAGCCTCGTCTCATA-3’,下游:5’-GATGGTGATGG GTTTCCCGT-3’。
1.2.6 ELISA 按照说明书采用ACTH ELISA试剂盒检测各组大鼠血清中ACTH的含量。
1.3 统计学处理
采用SPSS19.0软件行统计学分析,计量资料以(±s)表示,单因素方差分析及LSD多重比较进行组间差异分析,Pearson相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能评分和梗死体积的的对比
模型组和治疗组大鼠的神经功能评分和梗死体积均高于假手术组,治疗组低于模型组,差异有统计学意义(P<0.05),见图1、表1。

图1 各组脑切片TTC染色结果观察
表1 各组大鼠神经功能评分及梗死体积的对比(±s)
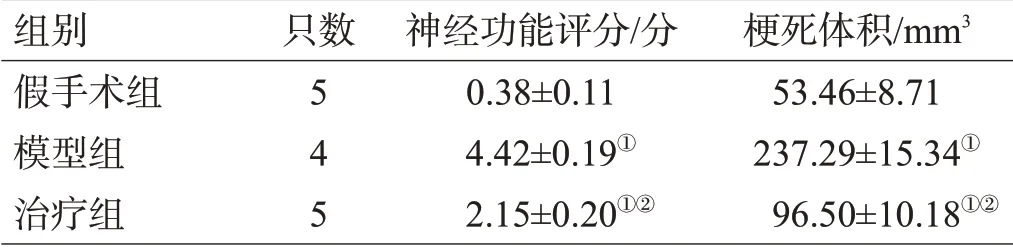
表1 各组大鼠神经功能评分及梗死体积的对比(±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组别假手术组模型组治疗组只数5 4 5神经功能评分/分0.38±0.11 4.42±0.19①2.15±0.20①②梗死体积/mm3 53.46±8.71 237.29±15.34①96.50±10.18①②
2.2 各组梗死区和肠黏膜中CCK mRNA表达的对比
模型组和治疗组大鼠梗死区和肠黏膜中CCK mRNA 的表达均高于假手术组,治疗组低于模型组,差异有统计学意义(P<0.05),见表2。
表2 各组大鼠CCK mRNA表达的对比(±s)

表2 各组大鼠CCK mRNA表达的对比(±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组别假手术组模型组治疗组只数5 4 5梗死区0.22±0.10 0.69±0.18①0.52±0.14①②肠黏膜0.64±0.21 1.37±0.29①1.08±0.25①②
2.3 各组血清中ACTH含量的对比
假手术组、模型组和治疗组大鼠血清ACTH 含量分别为(3.52±0.74)ng/mL、(6.22±1.10)ng/mL、(4.69±0.88)ng/mL,模型组和治疗组大鼠血清ACTH含量均高于假手术组,治疗组低于模型组,差异有统计学意义(P<0.05)。
2.4 ACTH与CCK mRNA表达的相关性分析
模型组中,血清ACTH 含量与梗死区及肠黏膜中CCK mRNA 表达均呈显著正相关(r=0.916,P=0.012;r=0.885,P=0.030)。
3 讨论
脑梗死的病理机制较复杂,啮齿类动物的MCAO模型由于操作简单,重复性和稳定性良好,已被广泛应用于脑梗死致病过程的研究[10]。本研究结果显示,MCAO术后大鼠的神经功能评分及梗死体积显著增加,提示大鼠出现神经功能障碍,经β-细辛醚和丹皮酚干预后,大鼠的神经功能评分及梗死面积显著降低,提示β-细辛醚和丹皮酚干预可修复受损的神经功能,但其修复机制还有待进一步探讨。
CCK为肠道激素之一,其除作为消化系统的重要调节因子外,还作为生长因子、神经递质、精子活力因子、抗炎因子和心脏标志物等参与多种器官的各种生理和病理过程。CCK 可诱导神经元和上皮细胞等合成及释放神经递质CCK-8和CCK-5,已有研究检测到CCK-8在脑出血和脑梗死患者中表达[11]。由此可见,CCK 不仅在人体多种器官中均有分布,而且还通过多种途径参与脑梗死的生理病理过程。本研究显示,MCAO术后大鼠脑梗死区及肠黏膜中CCK的表达显著降低,且经β-细辛醚和丹皮酚干预后,梗死区及肠黏膜中CCK的表达显著增加。由于中枢神经系统对胃肠道的调节主要是内、外刺激经中枢整合后由神经或神经内分泌系统下穿至肠道神经丛或直接作用于胃肠细胞[12],因此笔者推测脑-肠轴中CCK表达的降低可能与脑梗死发病有密切关系。
脑-肠轴通过分泌一些神经递质(如CCK),在中枢神经系统和肠神经系统以及胃肠道效应细胞之间进行传递,调节内脏感觉、分泌及运动,这类神经递质称为脑肠肽。脑肠肽不仅参与胃肠道的调节,还参与下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴、交感和副交感神经的激活过程,进而广泛参与神经内分泌调节。脑梗死作为一种应激因素作用于下丘脑,使HPA 轴功能亢进,进一步导致脑病理变化,加重病情[13]。ACTH 是由丘脑下部室旁核的促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)刺激分泌的,在HPA 轴参与脑梗死的调控中发挥重要作用。当大面积脑梗死时,颅内形成占位性病变效应导致垂体前叶受压、坏死,引发垂体分泌激素,ACTH 等大量流入血液[14]。本研究显示,模型组中血清ACTH的含量与脑肠轴CCK的表达呈正相关,这些结果提示脑梗死损伤导致梗死区及肠粘膜中CCK 的表达增加,进而导致HPA轴功能亢进,进一步加重病情。垂体分泌的ACTH大量流入血液即为HPA 轴功能亢进的标志。而β-细辛醚和丹皮酚干预可降低脑-肠轴CCK的表达,降低血清ACTH的含量,提示β-细辛醚和丹皮酚可通过抑制脑-肠轴中CCK 表达,抑制HPA 功能亢进,进而改善脑梗死。但β-细辛醚和丹皮酚对脑-肠轴中CCK表达的调控机制还不清楚,对下丘脑和肠黏膜中相关蛋白的作用机制也还不清楚,这将是本课题下一步要开展的项目。

