ZIF-8@Fe3O4磁性固相萃取结合高效液相色谱法测定果汁中3种苯甲酰脲杀虫剂
武 鑫,王翰云,安壮壮,李子凌,贾叶青,王曼曼,郝玉兰
(华北理工大学 公共卫生学院,河北 唐山 063210)
苯甲酰脲杀虫剂(Benzoylurea insecticides,BUs)是一类能抑制靶标害虫几丁质合成而导致其不育或死亡的昆虫生长调节剂,具有杀虫率高、杀虫谱宽等特点,被广泛用于农产品病虫害的防治[1]。然而,BUs会残留在农产品表面并转移至衍生农产品(如果汁)中,通过持续暴露和慢性毒性作用对人类健康产生危害[2]。美国环境保护署已将部分BUs归类为Ⅲ级或Ⅳ级的中等毒性物质[3]。因此,开发简单、快速的农产品中BUs残留的分析方法具有重要意义。
目前常用于BUs分析的样品前处理方法有分散液液微萃取(DLLME)[4]、固相微萃取(SPME)[5]和固相萃取(SPE)[6]。但DLLME和SPME通常萃取容量有限,且操作步骤较多;传统SPE萃取柱一次性使用,成本高。磁性固相萃取(MSPE)是一种以磁性或可磁化的功能性材料为吸附剂的固相萃取技术[7]。该技术将少量的吸附剂直接加入样品溶液中,可增加吸附剂与目标物之间的接触面积,有利于加快传质,降低萃取时间,提高方法的萃取效率,且仅需外部磁场即可实现吸附剂与样品基质的分离,操作简单、快速,已成功应用于环境、生物和食品等样品的净化和富集[8-11]。
MSPE吸附剂通常由磁性的Fe3O4和功能性吸附材料组成,吸附材料可根据待测物的性质选择、调控和修饰。因此,选择合适的吸附材料是决定萃取效率的关键。沸石咪唑酯骨架材料(Zeolitic imidazolate frameworks,ZIFs)是以二价过渡金属离子为配位点,咪唑或咪唑衍生物为有机配体自组装形成的一类具有沸石结构的纳米多孔材料[12]。其中ZIF-8因比表面积大和孔结构丰富而被广泛应用[13-14]。吴怡秋等[15]发展了离子液体修饰的ZIF-8作为吸附剂,结合高效液相色谱-质谱法分析环境水样中的微囊藻毒素;Wang等[16]构筑了ZIF-8复合氧化石墨烯对奶制品中性激素进行前处理,结合高效液相色谱-紫外检测进行测定,方法检出限为0.52~2.11 μg/L;Pang等[17]制备了ZIF-8掺杂整体柱在线净化,联用高效液相色谱-荧光检测测定水和蜂蜜中的氟喹诺酮类药物。
磁性ZIF-8(ZIF-8@Fe3O4)可以充分发挥ZIF-8的高吸附性能,同时结合MSPE快速简便的优势,高效地富集复杂样品中痕量目标物。本研究以ZIF-8@Fe3O4作为磁性固相萃取吸附剂用于果汁中氟幼脲、四螨嗪和氟啶脲3种BUs的前处理,结合高效液相色谱-二极管阵列检测,发展了一种简单、快速的果汁中BUs的分析方法。
1 实验部分
1.1 仪器与试剂
Agilent 1260高效液相色谱-二极管阵列检测器(HPLC-DAD,美国Agilent公司);D/MAX2500PC X射线衍射仪(XRD,日本理学株式会社);Shimadzu FTIR-8400S傅立叶变换红外光谱仪(FT-IR,日本岛津公司);Hitachi S-4800场发射扫描电子显微镜(SEM,日本日立公司)和LDJ9600-1振动样品磁强计(VSM,美国JDJ公司)。
除特别说明外,所有试剂均为分析纯。六水合硝酸锌(Zn(NO3)2·6H2O)、六水合三氯化铁(FeCl3·6H2O)、2-甲基咪唑和乙二醇购自上海阿拉丁生化科技股份有限公司;三水合乙酸钠(NaOAc·3H2O)、无水乙醇、盐酸购自天津市汇杭化工科技有限公司;甲醇(MeOH)、乙腈(ACN)、乙酸乙酯和丙酮为色谱纯,购自赛默飞世尔科技有限公司(美国)。超纯水购自杭州娃哈哈集团有限公司。
标准品:氟幼脲(PENF,纯度≥99.5%)、四螨嗪(CLOF,纯度≥99.5%)和氟啶脲(CHLO,纯度≥99%)均购自国家标准物质中心。使用甲醇配制成质量浓度均为1 mg/mL的标准储备液,于4 ℃下避光保存。使用时,将标准储备液稀释成100 μg/mL的标准工作液备用。
1.2 ZIF-8@Fe3O4的制备与表征
将3 g FeCl3·6H2O溶于30 mL乙二醇中,加入9 g NaOAc·3H2O,剧烈搅拌30 min后,转移至反应釜中,于200 ℃下反应8 h。将得到的Fe3O4经水和无水乙醇反复洗涤后,再加入100 mL盐酸溶液(0.1 mol/L)超声酸化15 min,用水洗涤至中性后,真空干燥,得到酸化的Fe3O4备用。
ZIF-8@Fe3O4的合成方法[18]如下:准确称量2.9 g Zn(NO3)2·6H2O溶于60 mL甲醇中,加入1 g酸化的Fe3O4,于70 ℃下水浴搅拌30 min后,加入60 mL 2-甲基咪唑(7.9 g)甲醇溶液,继续搅拌15 min。用水和甲醇反复洗涤5次,于60 ℃真空干燥2 h后得到表面生长1次ZIF-8的ZIF-8@Fe3O4。将所获得的ZIF-8@Fe3O4,依照上述实验条件重复生长2次和3次。将制备的ZIF-8@Fe3O4进行X射线衍射、傅立叶变换红外光谱等表征。
1.3 样品采集
果汁样品购自唐山市某超市,于4 ℃冷藏保存,使用前经0.22 μm滤膜过滤待用。
1.4 磁性固相萃取流程
准确称取40 mg ZIF-8@Fe3O4,加入10 mL过滤后的果汁样品,涡旋振荡20 min,通过施加外部磁场将吸附剂与果汁样品分离,弃去上清液。使用1 mL甲醇对目标物进行洗脱,充分振荡8 min后收集洗脱液,重复洗脱3次,合并洗脱液,氮吹浓缩至干,以0.2 mL甲醇复溶,进行液相色谱分析。
1.5 高效液相色谱分离条件
色谱柱为Agilent Eclipse XDB-C18(150 mm×4.6 mm,5 μm,美国Agilent公司);流动相为甲醇-水(81∶19,体积比);流速为1 mL/min;进样体积为10 μL;检测波长为260 nm;柱温为25 ℃。
2 结果与讨论
2.1 ZIF-8@Fe3O4的制备及表征
利用XRD对材料的晶体结构进行表征,结果显示,ZIF-8@Fe3O4同时具有位于(220)、(311)、(400)、(422)、(511)和(440)的Fe3O4典型衍射峰,及(011)、(002)、(022)和(222)处ZIF-8的特征峰(图1A)。通过FT-IR进一步鉴定材料的结构(图1B),ZIF-8@Fe3O4在1 430、1 300、754、681 cm-1处出现的吸收峰为咪唑环的平面弯曲和拉伸振动峰[19],在570 cm-1处的吸收峰为Fe-O键伸缩振动引起的特征峰。对ZIF-8@Fe3O4进行SEM表征(图1C),可明显观察到十二面体形状的ZIF-8和平均直径为300~400 nm的球形Fe3O4,且磁球附着在ZIF-8表面。以上结果表明ZIF-8@Fe3O4已成功制备。使用VSM分析ZIF-8@Fe3O4的磁强度(图1D),测得其磁饱和强度值为61.53 emu/g,表明ZIF-8@Fe3O4有较好的磁响应能力,作为磁性固相萃取吸附剂能够快速、有效地与样品溶液分离。
ZIF-8提供吸附作用位点,因此决定ZIF-8@Fe3O4的吸附性能。为获得最大吸附效率,考察了ZIF-8生长次数(1~3次)对3种BUs萃取效率的影响。结果表明,当ZIF-8生长1次时,3种BUs的吸附效率为97.9%~99.6%,生长2次和3次所得吸附剂对3种BUs的吸附效率为97.6%~98.8%,与ZIF-8生长1次时的结果相比无明显改变。故选择ZIF-8生长次数为1次的ZIF-8@Fe3O4作为吸附剂。
2.2 磁性固相萃取条件的优化
吸附和洗脱过程是磁性固相萃取的关键环节。实验考察了溶液pH值、吸附剂用量、吸附时间、洗脱溶剂种类及体积(单次洗脱体积×洗脱次数)对3种BUs萃取效率的影响。以10 mL BUs质量浓度均为200 ng/mL的水溶液进行优化实验,所有实验平行测定3次。
溶液的pH值会影响BUs的存在形式和吸附剂表面的吸附位点[20]。由于实际样品中果汁的pH值为4~6,因此考察了pH值在3~7范围内对BUs回收率的影响。由图2A可知,当pH值为6时,3种BUs的回收率最佳(96.3%~100%)。因此,实验选择溶液pH值为6。
合适的吸附剂用量能够提供充足的吸附位点并决定方法的萃取效率。固定吸附时间为20 min,考察吸附剂用量(20~60 mg)对3种BUs吸附效率的影响。由图2B可知,当吸附剂用量为20~40 mg时,随着吸附剂用量的增加,3种BUs的吸附效率增大。当吸附剂用量为40 mg时,3种BUs的吸附效率达到最大(98.1%~98.7%),继续增加吸附剂用量时,吸附效率不再增加,因此实验选择最佳吸附剂用量为40 mg。
充足的吸附时间能够使目标物和吸附剂充分接触,以保证最佳的萃取结果。固定吸附剂用量为40 mg,考察了吸附时间(5~25 min)对3种BUs吸附效率的影响。由图2C可知,在5~20 min范围内3种BUs的吸附效率随着时间的延长而增加,当吸附时间增加至25 min时,吸附效率无明显变化,故实验选择最佳吸附时间为20 min。




图1 ZIF-8@Fe3O4、ZIF-8和Fe3O4的X射线衍射图(A)、红外光谱图(B),以及ZIF-8@Fe3O4的扫描电子显微镜图(C)和磁滞曲线(D)Fig.1 X-ray diffraction(XRD) patterns(A) and FT-IR spectra(B) of ZIF-8@Fe3O4,ZIF-8 and Fe3O4,scanning electron microscopy(SEM) image(C) and magnetization curve(D) of ZIF-8@Fe3O4



图2 pH值(A)、吸附剂用量(B)和吸附时间(C)对3种BUs萃取效率的影响(n=3)Fig.2 Effect of pH value(A),sorbent amount(B) and extraction time(C) on extraction efficiencies of three BUs(n=3)
洗脱条件决定了方法的准确度。实验考察了洗脱溶剂种类(乙酸乙酯、丙酮、乙腈和甲醇)对3种BUs回收率的影响。在最优上样条件下,固定洗脱体积为4 mL(1 mL×4次),分别使用上述4种洗脱溶剂对3种目标物进行洗脱,由图3A可知,当洗脱溶剂为甲醇时,3种BUs的回收率最佳(89.3%~97.2%)。实验同时考察了甲醇体积(单次洗脱体积×洗脱次数)对目标物回收率的影响(见图3B)。结果表明,洗脱体积为4 mL(1 mL×4次)时,3种BUs的回收率最佳,继续增加洗脱溶剂用量会导致氮吹时间延长,为节省溶剂和时间,最终选择4 mL(1 mL×4次)甲醇为最优洗脱条件。

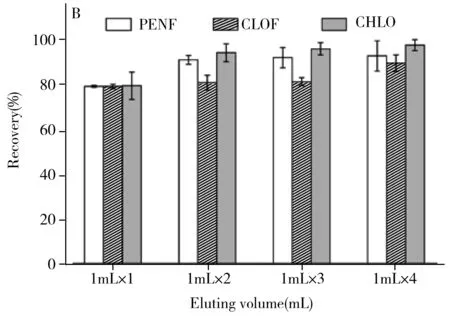
图3 洗脱溶剂种类(A)和洗脱体积(B)(单次洗脱体积×洗脱次数)对3种BUs回收率的影响(n=3)Fig.3 Effect of eluting solvent type(A) and eluting volume(B) (single eluting volume × eluting times) on recoveries of three BUs(n=3)
2.3 ZIF-8@Fe3O4对BUs的吸附性能
为进一步研究ZIF-8@Fe3O4对BUs的吸附机理,比较了3种BUs的脂水分配系数(logP)、氢键数量与方法富集因子(EF)之间的关系(见表1)。logP可反映目标物的疏水性,logP越大,表明目标物的极性越小,在水溶液中的溶解度越低。BUs中含有氢原子,ZIF-8的配体具有氢键结合位点,因此两者可形成氢键作用[21]。EF是磁性固相萃取前后的BUs浓度比,体现了目标物与吸附剂作用强弱。如表1所示,CLOF、PENF和CHLO的EF分别为43.4、47.7和48.1,表明3种BUs的EF随着logP的增大而增大,且含有2个氢键的PENF和CHLO的EF高于不含氢键的CLOF。因此,疏水作用和氢键作用可能是决定吸附剂与目标物之间相互作用的关键。

表1 3种BUs的结构式、脂水分配系数、氢原子数和富集倍数Table 1 Structures,logP,H bond donors and EFs of three BUs
2.4 方法验证
2.4.1 线性范围、检出限与定量下限在最优实验条件下,分别配制7个不同质量浓度的3种BUs标准溶液进行高效液相色谱分析,以目标物的质量浓度(x,ng/mL)为横坐标,峰面积(y)为纵坐标建立标准曲线。结果表明,PENF和CLOF在2.0~200 ng/mL、CHLO在3.5~350 ng/mL范围内呈良好的线性关系,相关系数(r)均为0.999。以信噪比S/N=3和S/N=10计算方法的检出限(LOD)和定量下限(LOQ)分别为0.6~1.0 ng/mL和2.0~3.5 ng/mL(表2)。

表2 方法的线性范围、回归方程、检出限、定量下限、回收率和相对标准偏差Table 2 Linear ranges,regression equations,limits of detection(LOD),limits of quantitation(LOQ),recoveries and relative standard deviations(RSD) of the present method

(续表2)
2.4.2 回收率与相对标准偏差对同一空白果汁样品进行低、中、高3个水平的加标回收实验(n=3),如表2所示,样品的加标回收率为82.7%~98.6%。以日内和日间(n=3)重复测定得到的色谱峰面积的相对标准偏差(RSD)计算精密度,日内和日间RSD分别为1.2%~6.1%和1.3%~9.0%,表明本方法具有良好的准确度和重现性。
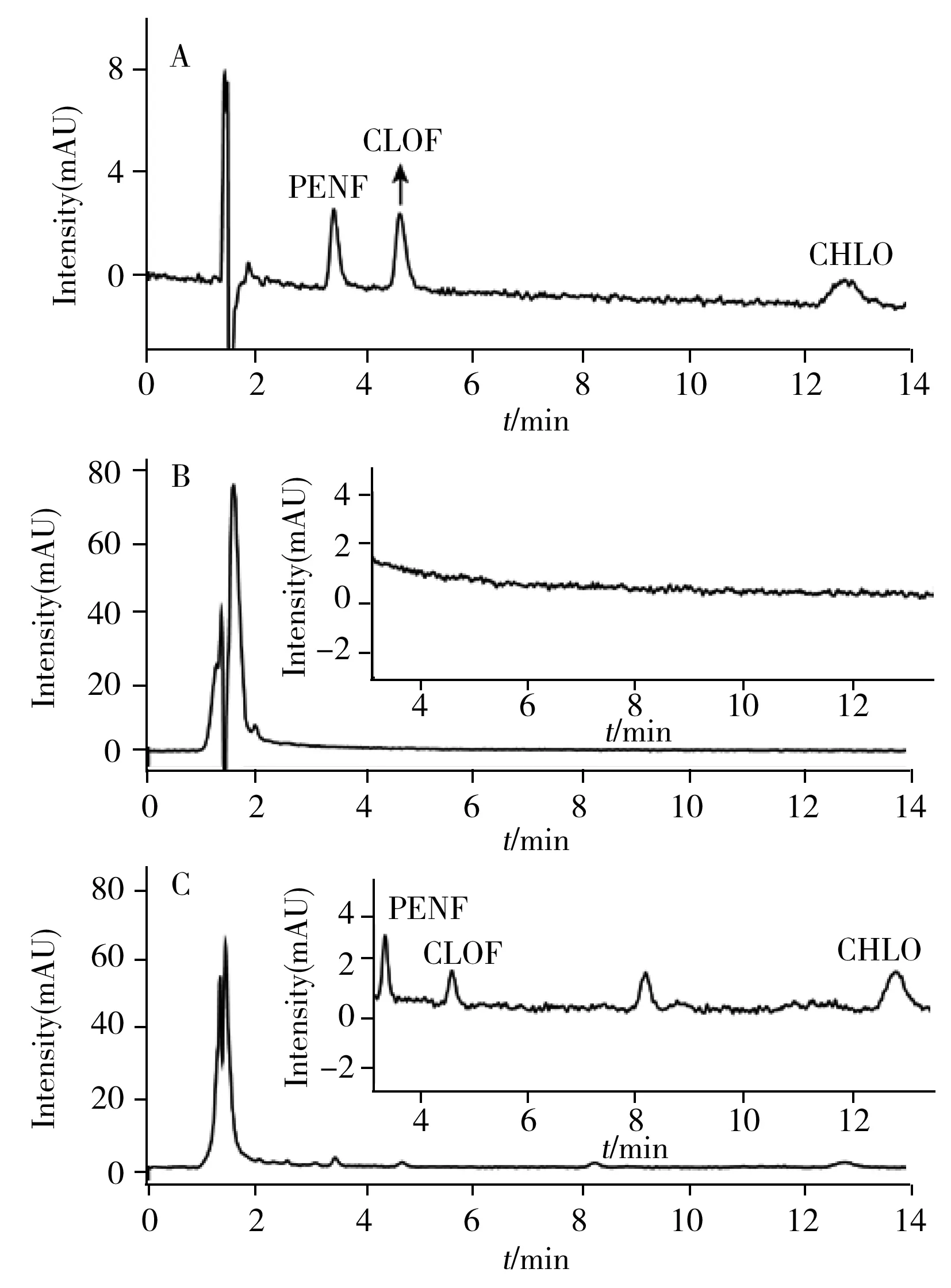
图4 BUs标准溶液(1 μg/mL)(A)、加标果汁样品直接进样(B)和经本方法处理后进样(C)的色谱图Fig.4 Chromatograms of the standard solution of BUs (1 μg/mL)(A),spiked fruit juice sample by direct analysis(B) and pretreated by the present method(C)spiked with 10 ng/mL of PENF and CLOF,20 ng/mL of CHLO
2.4.3 净化与富集效果为评价ZIF-8@Fe3O4对果汁中3种BUs的净化和富集效果,在最优实验条件下,将加标果汁样品(PENF和CLOF加标10 ng/mL,CHLO加标20 ng/mL)直接进样和经本方法净化富集后进样做对比分析。与BUs的标准溶液色谱图(图4A)相比,加标果汁样品直接进样分析时无分析物检出,且杂质峰明显(图4B)。经本方法萃取后,杂质峰信号显著降低,3种BUs成功检出,实现富集43.4~48.1倍(图4C)。结果表明,ZIF-8@Fe3O4能够对果汁中3种BUs有效净化和富集。
2.4.4 重复使用次数吸附剂的重复使用次数决定了前处理方法的成本。ZIF-8@Fe3O4反复萃取果汁样品中BUs的回收率结果显示,吸附剂重复吸附-洗脱10次,3种BUs回收率的RSD不大于8.8%,表明ZIF-8@Fe3O4具有良好的重复使用性。
2.5 实际样品分析
为进一步验证方法的可行性,将该方法用于橙汁、梨汁、葡萄汁、桃汁和柚子汁5份实际样品中BUs残留的分析。结果显示,5份果汁均未检出3种BUs。为说明方法的准确度,对5份果汁样品进行加标回收实验(PENF和CLOF加标10 ng/mL,CHLO加标20 ng/mL),得加标回收率为75.4%~98.9%,RSD不大于8.2%。表明本方法的准确度和精密度良好,可用于实际样品分析。
2.6 与文献方法对比
将本方法与文献方法进行对比[22-25],结果如表3所示,当使用的分析仪器为HPLC,本方法的灵敏度与其他方法相当或优于文献方法。当上样体积为10 mL时,本方法在较短时间内(20 min)可对3种BUs实现富集43.4~48.1倍,且结果准确可靠。另外,吸附剂可重复使用至少10次,节约了分析时间和成本。
3 结 论
本研究将ZIF-8@Fe3O4用作磁性固相萃取吸附剂,结合高效液相色谱-二极管阵列检测,发展了一种简单、快速分析果汁中3种BUs残留的新方法。该方法的准确度和精密度良好,基于ZIF-8@Fe3O4的疏水作用和氢键作用力,可有效对果汁中BUs进行富集净化,已成功用于果汁样品中BUs的分析。此外,吸附剂具有良好的重复使用性,可节约成本。

表3 本方法与其他方法的比较Table 3 Comparison of the present method with other methods for the analysis of BUs by HPLC
*floated organic drop microextraction

