Physagulin H通过阻断NF-κB和JNK/MAPKs信号通路抑制LPS诱导RAW 264.7细胞产生的炎症反应
王丽莹,李丹娜,宗明月,张庆然,陈丽霞,赵 烽
(1.烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台264005;2.沈阳药科大学中药学院,辽宁 沈阳 110016)
炎症是机体对于刺激的一种防御反应,过度炎症能进一步诱发多种相关疾病的发生,包括心血管疾病、癌症和自身免疫性疾病等[1].苦蘵(Physalisangulata)属于茄科酸浆属植物[2],现代药理学表明其有抗炎、抗肿瘤、免疫调节等活性.睡茄交酯类化合物是该植物的主要成分,文献表明睡茄交酯具有抗炎[3]、抗肿瘤[4]、免疫调节[5]和抗寄生虫活性[6]等作用.Physagulin H(图1)是一种从苦蘵中分离出来的典型的睡茄交酯类成分[3],在已发表的研究中显示physagulin H具有抑制短膜虫和锥虫的活性[7],但至今没有有关physagulin H的抗炎活性的报道.基于苦蘵的传统应用,本研究利用LPS诱导RAW 264.7细胞体外炎症模型,检测了physagulin H对LPS诱导巨噬细胞 RAW 264.7释放炎症介质NO、PGE2以及炎症因子TNF-α 的抑制作用,对iNOS、COX-2蛋白表达的影响以及对IκB-α蛋白降解的抑制作用,对MAPKs信号通路中ERK、JNK和p38蛋白磷酸化水平的影响,旨在探讨physagulin H的抗炎活性及其抗炎分子机制.
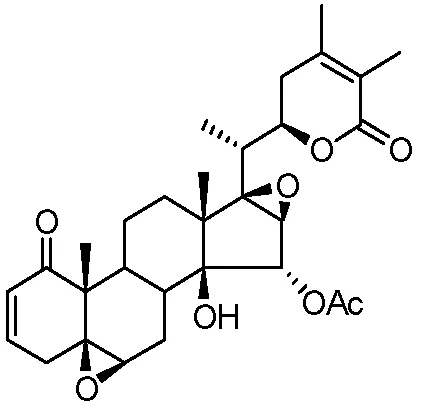
图1 Physagulin H结构式Fig.1 The structure of physagulin H
1 材料和方法
1.1 化学品和试剂
Physagulin H由沈阳药科大学提供(HPLC≥98%),在100%细胞培养级二甲基亚砜(DMSO)中制备50 mmol/L溶液,胎牛血清(FBS)和RPMI 1640培养基购自Invitrogen(Thermo Fisher Scientific,Inc.,USA);MTT、DMSO、LPS购自Sigma-Aldrich(St.Louis,MO,USA);细胞核蛋白/浆蛋白抽提试剂盒、一氧化氮测定试剂盒、小鼠TNF-α ELISA试剂盒购自烟台赛尔斯生物技术有限公司;小鼠PGE2ELISA试剂盒购自上海森雄科技有限公司;Anti-rabbit iNOS、COX-2 polyclonal antibody购自 Cayman公司;goat anti-rabbit p-ERK1/2、p-JNK、p-p38 polyclonal antibody购自Affinity公司;goat anti-rabbit IκB-α polyclonal antibody和β-actin抗体购自Santa Cruz Biotechnology,Inc;氢化可的松琥珀酸钠注射液 (HSS)为烟台东诚北方制药有限公司产品;CKX31 型倒置显微镜(菲律宾奥林巴士公司);3111 型恒温二氧化碳培养箱(美国 Thermo 公司);5810R台式高速大容量冷冻离心机(Eppendorf 公司);SYNERGY HT型酶标仪(美国,BIO-TEC 公司).
1.2 细胞培养
RAW 264.7细胞用含有10%热灭活的胎牛血清的RPMI 1640培养基在37 ℃下含量为95%的空气和5% CO2的培养箱中培养,每2 d常规更换培养基,胰酶消化传代.
1.3 分组及药物处理
将RAW 264.7细胞以1×106个/mL的密度在96孔板中培养.孵育1 h后,将96孔板中的细胞分为空白组、阳性对照组、LPS组、给药组,每个给药浓度设3个平行复孔.空白组每孔分别加入0.4 μL DMSO,LPS组和给药组每孔加入2 μL的LPS(终浓度为1 μg/mL),阳性对照组每孔加2 μL LPS和0.4 μL氢化可的松琥珀酸钠注射液(HSS,终浓度为100 μmol/L),给药组每孔加入0.4 μL physagulin H(终浓度为1.562 5,3.125,6.25和12.5 μmol/L).
1.4 MTT法评价药物的细胞毒性
将RAW 264.7细胞以1×106个/mL的密度在96孔板中培养,孵育1 h后加入0.4 μL physagulin H(终浓度为1.562 5,3.125,6.25,12.5,25,50和100 μmol/L),对照组加入等量的DMSO.继续孵育24 h后,加入8 μL MTT(终浓度为200 μg/mL),再孵育4 h,弃去上清,加入150 μL DMSO以溶解甲臜.以630 nm为参比波长,用酶标仪测定570 nm处的吸光度(A570).细胞存活率=(实验组A570/对照组A570)×100%.
1.5 Griess法测定NO浓度
按“1.3”的方法分组处理细胞,孵育24 h,吸取100 μL/孔细胞上清液于酶标板中,同时加入预先配制的Griess试剂(由A、B等量混合,100 μL/孔),摇床上低速振摇10 min,540 nm处测量吸光度,使用从亚硝酸钠获得的标准曲线计算细胞培养上清液中亚硝酸盐的浓度.
1.6 ELISA法测定PGE2和TNF-α浓度
按“1.3”的方法分组处理细胞,孵育24 h和6 h后吸取100 μL/孔上清液,分别按照小鼠PGE2ELISA试剂盒和小鼠TNF-α ELISA试剂盒说明书,检测PGE2和TNF-α的水平.
1.7 Western Blot法检测iNOS,COX-2,IκB-α,p-ERK,p-JNK和p-p38蛋白水平
1.7.1 蛋白提取及定量 将RAW 264.7细胞以1×106个/mL的密度接种3 mL于60×15 mm培养皿中,培养1 h待细胞贴壁后,将其分为空白组、LPS组和给药组.空白组加入6 μL的DMSO,LPS组加入30 μL的LPS(终浓度为1 μg/mL),给药组加入30 μL的LPS和6 μL的physagulin H(终浓度分别为1.562 5、3.125、6.25和12.5 μmol/L),继续培养24 h后提取总蛋白用于检测iNOS和COX-2的水平.
同上分组给药并LPS刺激10 min后提取总蛋白用于检测IκB-α的水平,LPS刺激15 min后提取总蛋白用于检测p-JNK的水平,LPS刺激1 h后提取总蛋白用于检测p-ERK和p-p38的水平.收集细胞,按照细胞核蛋白/浆蛋白抽提试剂盒说明书操作提取各蛋白,按BCA定量试剂盒说明书进行定量.恒定蛋白上样的质量为30 μg,加入5倍体积的loading buffer,使各组样品蛋白浓度一致,100 ℃,5 min煮沸变性.
1.7.2 蛋白质印迹分析 根据 SDS-PAGE 凝胶配制试剂盒说明书配制相应的分离胶与浓缩胶:iNOS(分子质量:130 kU),COX-2 (分子质量:72 kU)使用8%分离胶,5%的浓缩胶;p-JNK(分子质量:46,54 kU),p-ERK(分子质量:42,44 kU),p-p38(分子质量:43 kU)使用10%的分离胶,5%的浓缩胶;IκB-α(分子质量:36 kU),使用12%的分离胶,5%的浓缩胶.取 30 μg 总蛋白样品进行电泳,转膜,膜与5%的脱脂奶粉置于脱色摇床室温下封闭4 h.用TBS-T洗涤3次,每次10 min,将膜在相应的一抗溶液(iNOS,COX-2,p-ERK1/2,p-JNK,p-p38,IκB-α,β-actin)中于4 ℃孵育过夜.TBS-T洗膜3次,每次10 min,加入二抗37 ℃温育1 h.洗膜3次并加入 ECL 发光显色液,放入暗盒中,压片,显影定影,收集图像并使用软件Image J分析条带的灰度值,用目的蛋白的灰度值/β-actin的灰度值(%)或磷酸化蛋白的灰度值/非磷酸化蛋白的灰度值(%)来量化目的蛋白的表达情况.
1.8 统计分析
2 实验结果
2.1 Physagulin H对RAW 264.7细胞存活的影响
当细胞存活率<50%时,显示强毒性;细胞存活率在50%~70%时,显示中等毒性;细胞存活率在70%~90%时,显示弱毒性;细胞存活率>90%时,无明显毒性.如图2所示,在physagulin H低于12.5 μmol/L的浓度处理下,细胞存活率均大于90%,故physagulin H在低于12.5 μmol/L浓度时对RAW 264.7细胞的增殖没有明显细胞毒性.
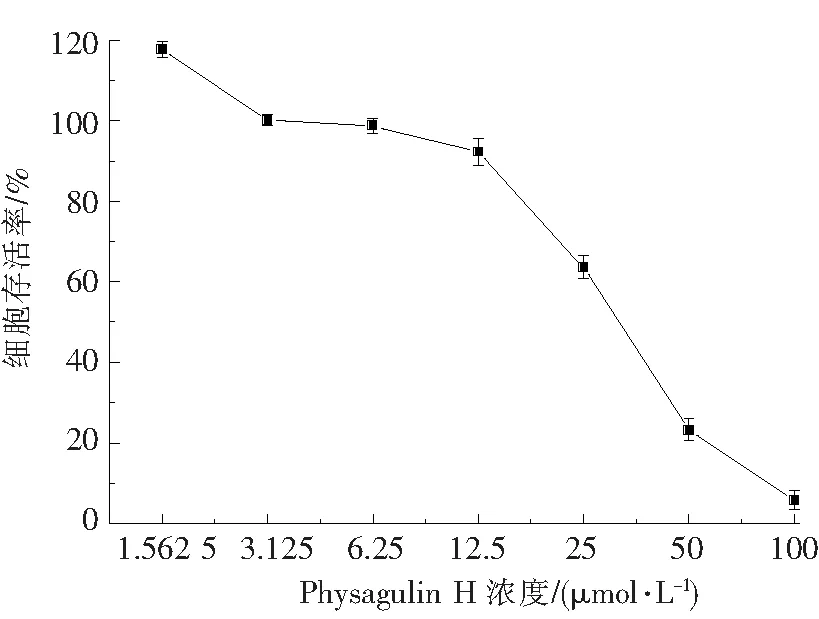
图2 Physagulin H对RAW 264.7细胞增殖的影响Fig.2 Effect of physagulin H on the proliferation of RAW 264.7 cells
2.2 Physagulin H对LPS诱导的NO,PGE2和TNF-α 释放的影响
如图3所示,physagulin H在1.562 5~12.5 μmol/L范围内显著抑制LPS诱导的NO和PGE2的过量产生并呈剂量依赖关系(**P<0.01)(图3(a),(b)).同时,在浓度为3.125 μmol/L时,physagulin H对NO的抑制率与阳性药物相当.这些结果表明,与阳性药物HSS相比,physagulin H对NO过量产生可能具有更好的抑制作用.TNF-α实验结果表明,physagulin H在3.125~12.5 μmol/L范围内对LPS诱导的TNF-α的产生具有显著的抑制活性和良好的剂量依赖关系(**P<0.01)(图3(c)).
2.3 Physagulin H对iNOS和COX-2蛋白表达的影响
如图4所示,空白组RAW 264.7细胞中仅有少量iNOS和COX-2表达.经LPS处理24 h后,iNOS和COX-2蛋白的表达显著增加(##P<0.01),而physagulin H对iNOS和COX-2蛋白的高表达具有显著抑制作用(**P<0.01).
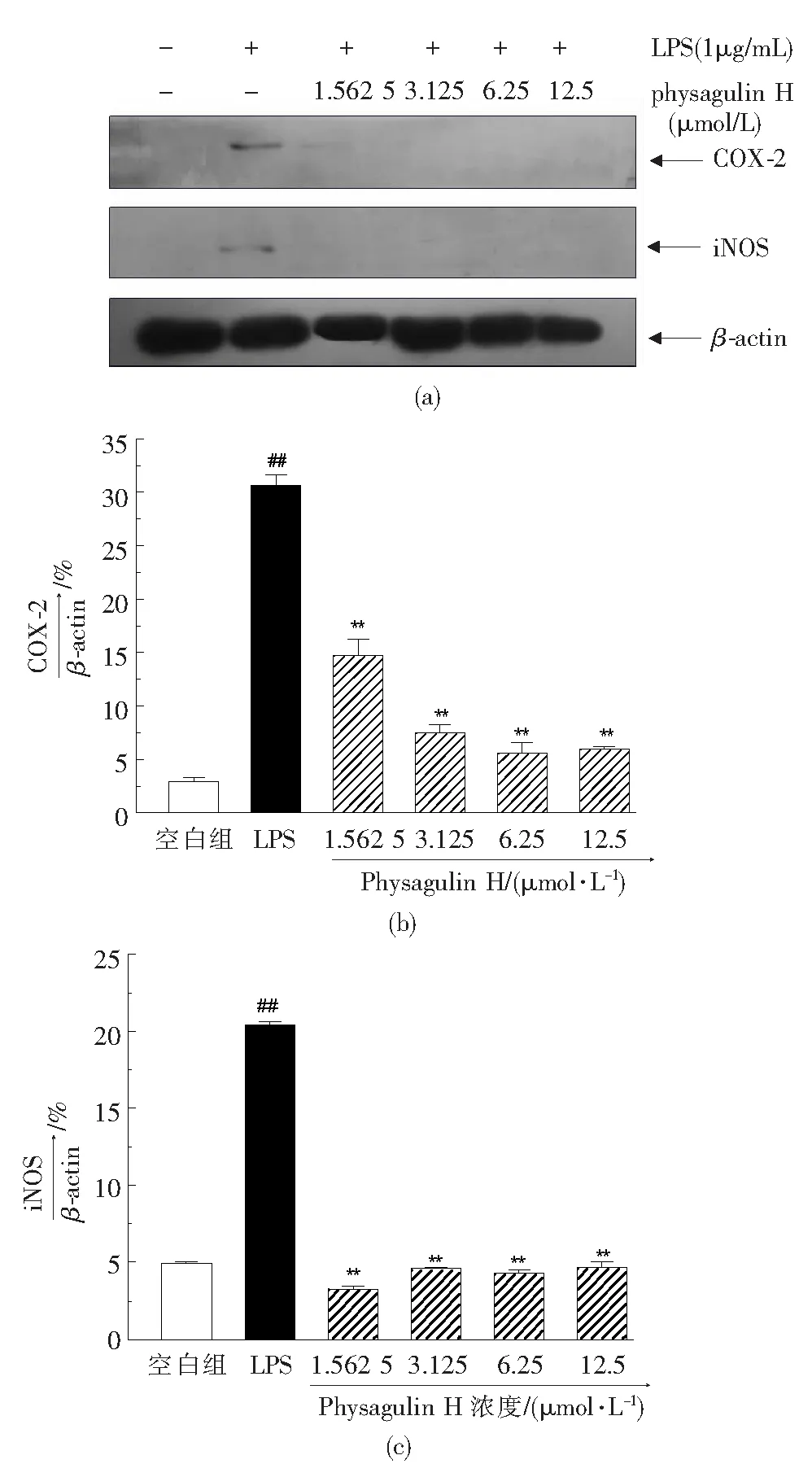
与空白组相比,##P<0.01;与LPS组相比,**P<0.01.图4 Physagulin H对LPS诱导的RAW 264.7细胞iNOS和COX-2蛋白高表达的影响Fig.4 Effect of physagulin H on the high expression of iNOS and COX-2 proteins in LPS-activated RAW 264.7 cells
2.4 Physagulin H对IκB-α蛋白表达的影响
如图5所示,空白组中IκB-α蛋白表达量正常,经LPS刺激后蛋白发生降解表达量显著下降(##P<0.01),而physagulin H在不同浓度下对IκB-α蛋白的降解均具有显著抑制作用(**P<0.01).

与空白组相比,##P<0.01;与LPS组相比,**P<0.01.图5 Physagulin H对LPS诱导的RAW 264.7细胞IκB-α蛋白降解的影响Fig.5 Effect of physagulin H on the degradation of IκB-α protein in LPS-activated RAW 264.7 cells
2.5 Physagulin H对MAPKs信号通路激活的影响
如图6—图8所示,空白组细胞中MAPK蛋白主要以未磷酸化形式存在,LPS刺激后ERK、JNK、p38发生磷酸化产生大量p-ERK、p-JNK、p-p38蛋白(##P<0.01);与LPS组相比,physagulin H在3.125~12.5 μmol/L浓度范围内对LPS诱导RAW 264.7细胞的JNK蛋白磷酸化有抑制作用(*P<0.05,**P<0.01),而对ERK和p38蛋白磷酸化均无显著抑制作用.
3 讨 论
Physagulin H是苦蘵中的主要活性成分之一,已有研究表明physagulin H具有抗寄生虫的活性[7],但其抗炎活性却鲜有报道.本研究采用LPS诱导的RAW 264.7细胞体外炎症模型探讨了physagulin H的抗炎活性及其发挥抗炎作用的分子机制.
巨噬细胞在抗炎过程中扮演着重要的角色,而LPS是一种炎症激活剂,经LPS刺激后,RAW 264.7细胞可引发炎症介质以及炎症因子如NO,PGE2,TNF-α等的分泌[8-9].NO是一种由iNOS产生的重要炎症介质,PGE2的产生主要受COX-2的调节[10].炎症发生时TNF-α大量表达,进一步作用于其相应的受体,促进NF-κB的持续激活[11].NF-κB和MAPK信号传导通路被认为是调节炎症反应和过程的2条经典通路,这2条信号通路的激活将引起炎症因子的释放,从而调节氧化应激反应并加速炎症反应[12].当细胞静息时,NF-κB和抑制蛋白IκB-α结合成无活性形式游离在胞浆中,NF-κB蛋白序列上的核定位信号被IκB-α掩盖.当细胞受到刺激时,IκB激酶被激活,从而导致IκB蛋白磷酸化和泛素化,引起IκB-α蛋白发生降解,NF-κB二聚体p65和p50得到释放,释放的p65转位到细胞核,与细胞核中目的基因结合,促进目的基因的转录和表达,产生炎症反应[13].MAPKs包括细胞外信号调节激酶(ERKs)和2种应激激活蛋白激酶(SAPKs)家族,c-jun N末端激酶(JNK)和p38[14].大量文献表明,LPS是MAPKs途径中ERK,JNK和p38信号通路的重要激活剂,其进一步促进炎性因子的产生和炎性蛋白的表达[15].调控以上炎症信号通路并抑制炎症因子的过量产生已成为抗炎药物的重要机制.
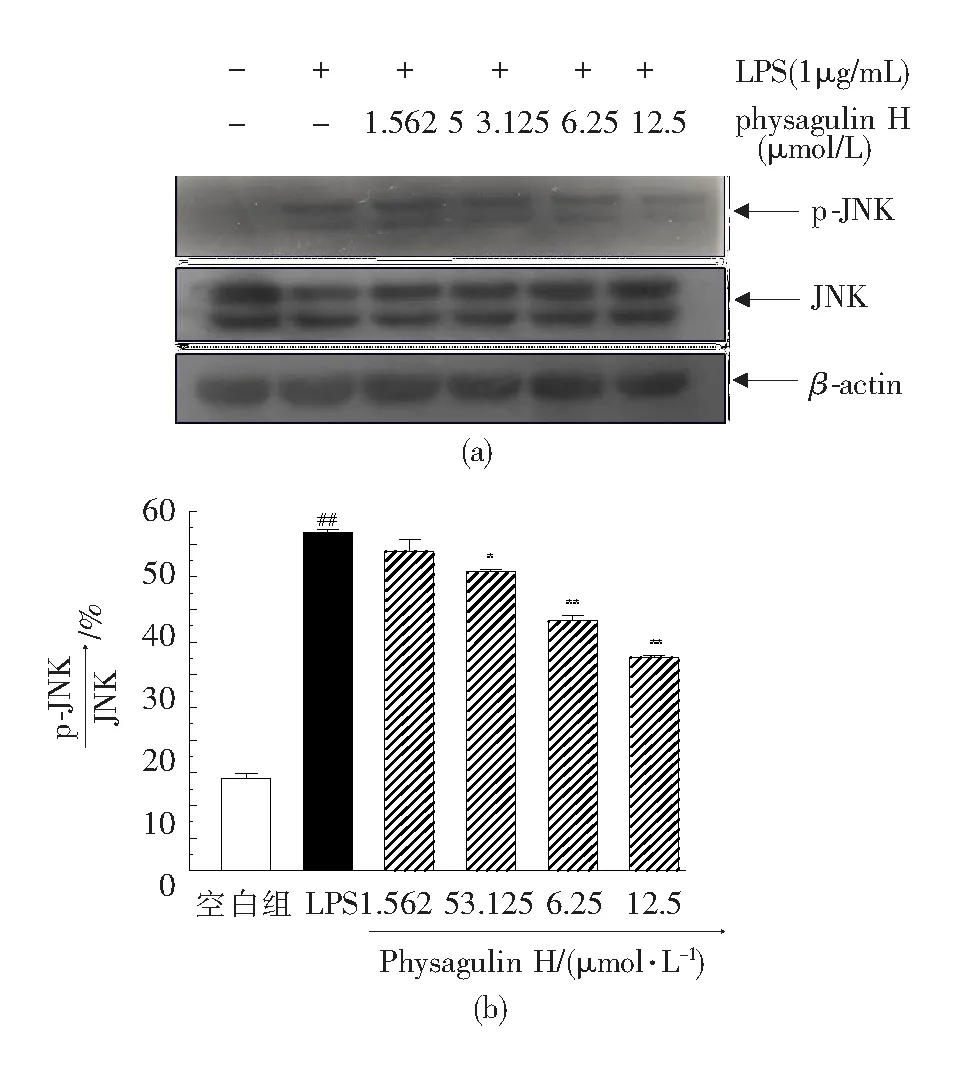
与空白组相比,##P<0.01;与LPS组相比,*P<0.05,**P<0.01.图6 Physgulin H对LPS诱导的RAW 264.7细胞中MAPKs通路JNK蛋白磷酸化的影响Fig.6 Effect of physagulin H on the phosphorylation of JNK protein of the MAPKs pathway in LPS-activated RAW 264.7 cells

与空白组相比,##P<0.01;与LPS组相比,*P<0.05,**P<0.01.图7 Physgulin H对LPS诱导的RAW 264.7细胞中MAPKs通路ERK蛋白磷酸化的影响Fig.7 Effect of physagulin H on the phosphorylation of ERK protein of the MAPKs pathway in LPS-activated RAW 264.7 cells

与空白组相比,##P<0.01;与LPS组相比,*P<0.05,**P<0.01.图8 Physgulin H对LPS诱导的RAW 264.7细胞中MAPKs通路p38蛋白磷酸化的影响Fig.8 Effect of physagulin H on the phosphorylation of p38 protein of the MAPKs pathway in LPS-activated RAW 264.7 cells
本研究结果表明,physagulin H可抑制NO,PGE2和TNF-α的释放,同时,physagulin H还下调iNOS和COX-2蛋白的表达,这些发现表明,physagulin H可以通过抑制iNOS和COX-2的产生发挥抗炎作用.进一步研究表明,physagulin H对IκB-α的降解具有显著抑制作用,而physagulin H仅对MAPK信号通路中JNK 蛋白磷酸化有抑制作用.表明physagulin H可能通过抑制JNK/MAPKs信号通路的激活,抑制炎症蛋白的表达,进而影响炎症因子的释放.综上所述,physagulin H是通过阻断LPS诱导的小鼠巨噬细胞中JNK/MAPKs和NF-κB信号传导途径的激活而发挥抗炎作用.结果表明,physagulin H在治疗炎性疾病方面是一个有价值的天然化合物,这为指导苦蘵及其相关制剂在临床上的应用提供了理论依据.本研究从体外实验观察了physagulin H的抗炎活性,要进一步确证physagulin H的抗炎作用及分子靶点,还需要进行体内实验等更深入的研究.

