革兰阴性菌孔蛋白结构、功能和应用的研究进展
汪德会,李 攀,李能章,彭远义
(西南大学 动物科技学院,重庆 400715)
革兰阴性菌(Gram-negative bacteria)的外膜是一种由蛋白质、脂多糖、磷脂等多种物质组成的复合结构,约占细胞壁干重的80%,是革兰阴性菌抵抗外来有毒化合物的第一道防线。孔蛋白(Porins)是外膜蛋白(OMPs)家族中的一类典型膜通道蛋白,1979 年Nakae 第一次描述了它的特征并将其命名为孔蛋白。孔蛋白的结构在荚膜红细菌(Rhodobacter capsulatus)中首次得到了精准解析[1],这类蛋白质参与了多种营养物质和有毒小分子(糖、药物、小肽、化学物质)的运输。此外,孔蛋白可诱导宿主产生免疫应答、参与细菌的耐药和补体活化等,并可作为新型疫苗候选靶标和免疫佐剂[2-3]。本文从孔蛋白的分子结构、在细菌感染和耐药中的作用以及作为疫苗佐剂研究等予以综述,为了解细菌的耐药机制以及研发新的疫苗提供参考。
1 孔蛋白的分子结构
孔蛋白贯穿于细菌外膜的磷脂双分子层,在其外表面形成一富含水的通道,通常仅允许小于0.6 ku 的亲水性小分子通过。革兰阴性菌孔蛋白有单体和三聚体两种结构。
经典的孔蛋白是由三个单体聚合而成的三聚体结构,单体之间由L2 环(Loop)连接,每个单体由300~420 个氨基酸构成,其N 端有由21 个氨基酸组成的信号肽序列,其C 端有一个苯丙氨酸残基,该残基是孔蛋白正确导入外膜并在其中折叠的重要前提[4]。经典孔蛋白分为非特异孔蛋白(General or Non-specific porins)(如OmpF、PhoE 和OprP)和底物特 异 孔 蛋 白(Substrate specific porins)(如LamB 和ScrY)两类,这两类蛋白的单体分别由16 和18 条反平行的肽链折叠成一个β桶(β barrel)状结构,孔径的最大横径在30 Å~35 Å之间,最大高度约为50 Å[5-6]。每个单体链在周质内侧以7 或8 条短环连接,在细胞外侧则以不规则的9 或7 条长环连接,最长的L3 环并不在胞外侧暴露而是在桶内通道高度的一半处折叠形成收缩区,在该收缩区内,L3 环中的酸性残基(Asp-113、Glu-117)和与之相对筒体壁中的一簇碱性残基(Lys-16、Arg-42、Arg-82、Arg-132)形成了较强的横向静电场,对孔隙的渗透性起着决定性的作用[7](图1)。L3 环含有一个序列基序—PEFGG,在大肠杆菌孔蛋白(OmpF)中高度保守,该基序构成了L3 环中最柔性的区域,使L3 环在孔径内有局部运动的可能性。底物特异孔蛋白与非特异孔蛋白不同的是,长环L1 也能在桶内折叠,与L3 环共同决定孔径的大小,并且外环通常聚合形成一个保护伞,起着保护孔径和限制大分子物质进入孔隙的作用,这可能与底物特异性结合相关[8]。
单聚体孔蛋白与三聚体孔蛋白的单体结构类似,一般由8、12 或14 条肽链β折叠而成,因其孔隙内缺少像三聚体孔蛋白L3 环类似的收缩区结构,使得其孔径比经典的孔蛋白单体大;其孔径一般为椭圆状,单侧在链S6~S10 处稍扁[7]。大肠杆菌单聚体孔蛋白(OmpG)构型受pH 值的影响,在中性pH下, L6 和L7 环投射到细胞外介质中,使孔洞打开,而在低pH 下,其在孔道内折叠并阻塞孔道[9](图2)。
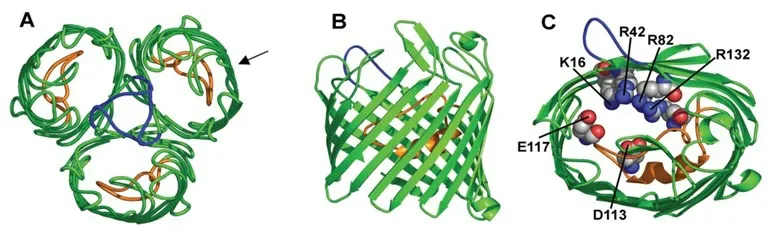
图1 大肠杆菌三聚体孔蛋白OmpF 的结构[8]
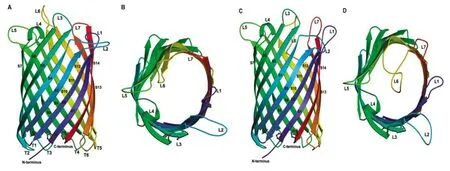
图2 大肠杆菌单体孔蛋白OmpG 的结构,A、B 和C、D 分别为孔径开放和关闭状态[9]
2 孔蛋白在细菌感染中的作用
2.1 孔蛋白介导的信号通路转导及免疫反应
孔蛋白是细菌外膜重要的组成成分,在细菌感染宿主的过程中,孔蛋白可黏附侵入不同类型的组织细胞,刺激宿主细胞产生一系列促炎因子、抗炎因子和趋化因子,并诱导下游效应细胞的成熟与分化,从而增强细胞表面MHC 分子以及共刺激分子(Co-stimulatory molecules)的表达,在天然免疫和获得性免疫中起着重要的作用。
孔蛋白的特异受体目前尚不明确,但其作为病原相关分子模式(Pathogen associated molecular patterns,PAMPs)能 被Toll 样 受 体(Toll-like receptor,TLR)或其它模式识别受体(Pattern-recognition receptors,PRRs)所识别而发挥作用[3](图3)。TLR 广泛表达于多种组织和细胞,其中TLR2 是TLR 家族中功能较多、识别谱最广的受体之一,在天然免疫中起着重要的作用。大量研究表明,许多革兰氏阴性菌孔蛋白均能被TLR2 或其它受体分子识别,使免疫细胞活化,诱导炎症反应。例如,脑膜炎奈瑟氏菌(Neisseria meningitidis)孔蛋白PorB 能被TLR2 识别,通过髓样分化因子88(MyD88)依赖途径、丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)和核转录因子kappa B(Nuclear factor κB,NF-κB)通路诱导抗原递呈细胞(Antigen presenting cell,APC)的活化、增强MHC Ⅱ和CD86分子的表达、并诱导B细胞增殖和树突状细胞(DCs)的成熟,可在天然免疫与获得性免疫中起着桥梁的作用[10-11]。研究显示,PorB 可直接与TLR2 结合,在TLR6 敲除小鼠内诱导B 细胞分泌高水平的IL-6,而在TLR1 敲除小鼠内使B 细胞分泌IL-6 的能力明显减弱,表明PorB 诱导细胞的活化需要TLR2/TLR1(而不是TLR2/TLR6)异源二聚体进一步来发挥其生物学效应[12]。此外,痢疾杆 菌(Shigella dysenteriae)MOMP、流 感 嗜 血 杆 菌(Haemophilus influenzae)Hib 以及具核梭杆菌(Fusobacterium nucleatum)FomA 等孔蛋白也能被TLR2 识别,诱导相应免疫细胞的活化,促使发生一系列免疫反应[13-15]。
孔蛋白除了能被TLR2 识别之外,也能通过其它信号途径或方式诱导免疫反应。鼠伤寒沙门氏菌(Salmonella enterica serovar typhimurium)34 ku 和36 ku孔蛋白能在不同的组织细胞中通过相似或不同的信号通路诱导炎症因子、共刺激分子的表达。其中,这两种蛋白在小鼠巨噬细胞(RAW 264.7)中通过P38 和JNK MAPK 通路诱导一氧化氮分子(NO)的分泌[16],在人白血病单核细胞(U937)中可通过Raf-1-MEK1-MEK2-MAPK 通路活化NF-κB 和AP-1,以及诱导蛋白酪氨酸激酶(NT-PTK)、蛋白激酶A(PKA)和蛋白激酶C(PKC)磷酸化并促使TNF-α 、IL-1β 、IL-6 和IL-10 的分泌[17-18]。此外,这两种蛋白在小鼠脾细胞模型中活化CD4+T 细胞并促进IFN-γ和IL-4的分泌,在人外周淋巴细胞(Human PBMCs)中可诱导CD80 和CD86 的表达[19]。流感嗜血杆菌孔蛋白P2中的L5、L6 和L7 环也能激活JNK 和P38 MAPK 通路促进IL-6 和TNF-α的分泌,表明孔蛋白细胞的外侧环可发挥生物学活性作用[20]。
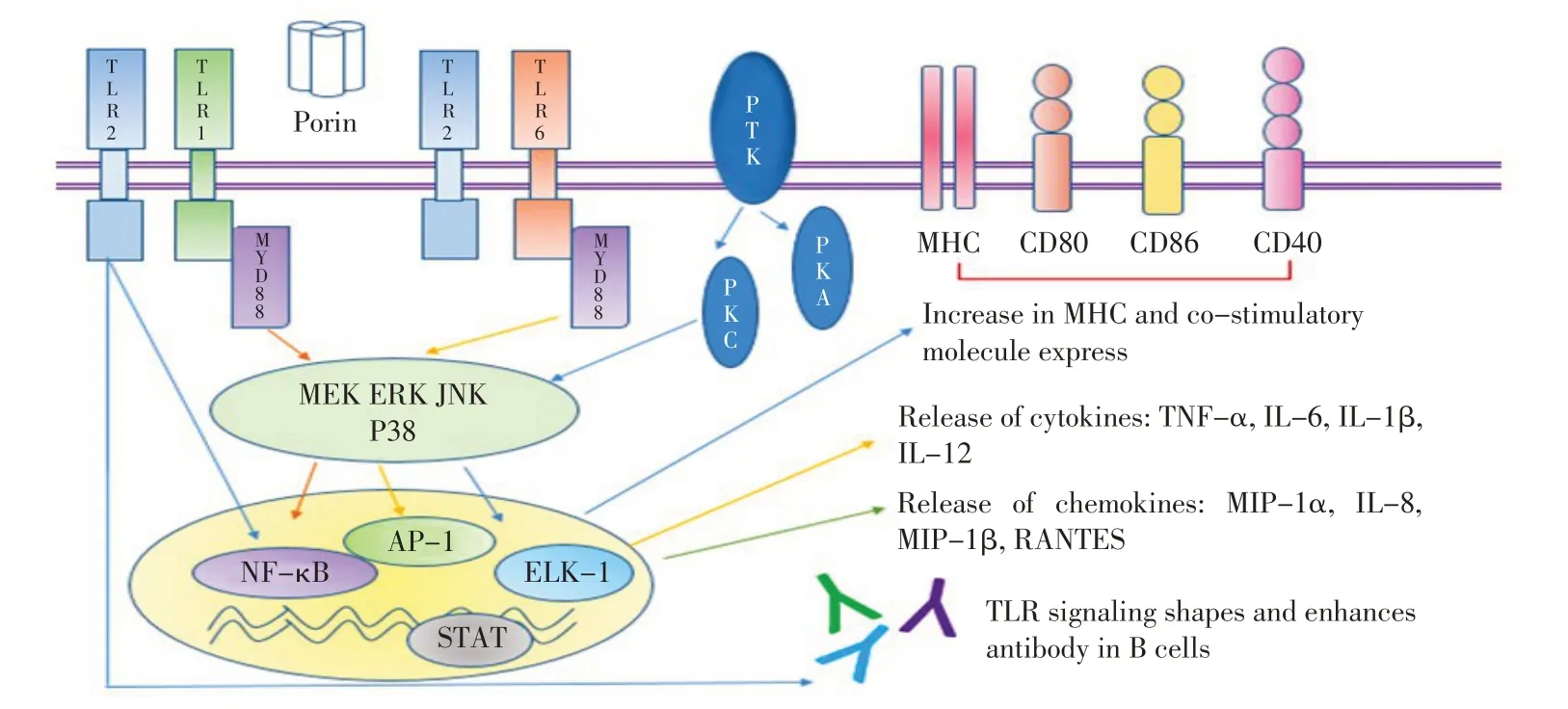
图3 革兰阴性菌孔蛋白介导的信号转导及免疫反应[3]
2.2 孔蛋白参与补体的激活
补体系统(Complement system)是存在于人和动物血液、组织液和细胞膜表面的一种复杂的限制性蛋白水解系统,是机体固有免疫防御体系的重要组成部分,可参与病原微生物的防御和免疫调节。研究表明部分革兰阴性菌孔蛋白可与补体C1q 结合,通过经典途径激活补体。嗜水气单胞菌(Aeromonas hydrophila)孔蛋白II 能与C1q 结合,并以非抗体依赖方式激活补体经典途径,然后酶解C4 并降低血清总溶血活性[21]。肺炎克雷伯氏菌(K.pneumoniae)孔蛋白OmpK36 通过与C1q 结合激活体内经典补体途径,并使C3、C5-9(MAC)成分在孔蛋白中沉积[22]。淋球菌孔蛋白Por1B 通过酰胺键和酯键选择性结合补体结合蛋白C4b 和C3b,促使C5 转化酶的形成[23]。Mishra M 等研究显示体外重组表达的铜绿假单胞菌孔蛋白OprF 可与补体C3b 结合,同时增加补体介导的杀菌效应[24]。
3 孔蛋白在细菌耐药中的作用
革兰阴性菌目前占耐药细菌的主导部分,随着抗菌药物的使用增多,其耐药复杂性也随之增加,给临床用药以及细菌疾病的防治带来了巨大的挑战。孔蛋白是细菌外膜屏障的重要成分,一个细胞拥有孔蛋白的数量和类型将决定其渗透性,从而决定细菌对抗生素的敏感或耐药性。目前认为,孔蛋白表达量的变化、基因突变(点突变、缺失突变、插入元件)等均会引起细菌外膜通透性降低而引起细菌耐药[25-26]。
3.1 孔蛋白基因突变与细菌耐药
大量研究表明,孔蛋白的缺失可导致细菌耐药。Hao 等从临床分离了18 株耐碳青霉烯酶(Carbapenems)的产气肠杆菌(Enterobacter aerogenes),其中14 株有耐碳青霉烯酶基因(blaKPC-2)的存在,对这14 株耐药菌株进行SDS-PAGE 分析,发现有两株(A4 和A23)缺失孔蛋白Omp35,两株(A18 和A19)孔蛋白Omp36 的表达下降;而对这4 株孔蛋白缺陷菌株的功能恢复后发现其对碳青霉烯类药物的最小抑菌浓度(MIC)降低了2~4 倍,表明孔蛋白Omp35和Omp36 缺失或表达减少会引起产气肠杆菌对碳青霉烯酶药物的耐药[27]。另外,Zhen 等从214 株产KPC 的肺炎克雷伯菌(KPC producing Klebsiella pneumonia,KPC-KP)中筛选出了24 株耐头孢他啶(Ceftazidime)菌株,根据最小抑菌浓度将其分为高、中、低三组,用ELISA 和RT-PCR 技术检测发现高MIC 组菌株的头孢他啶水解酶活性以及耐药基因(blaKPC)的转录水平均明显高于其它两组,同时SDS-PAGE 结果显示MIC>1 mg/mL 的所有菌株孔蛋白OmpK35 均缺失,而在敏感菌株中孔蛋白OmpK35和OmpK36 均存在;测序分析显示,由于孔蛋白基因存在移码致使转录提前终止(n=15)以及孔蛋白负调控基因micF 和ompR 的过表达导致OmpK35 缺失,表明孔蛋白缺失并伴有抗菌药物的水解酶表达增加时,可加重细菌的耐药[28]。
此外,孔蛋白基因点突变和插入元件(IS)也能引起细菌耐药。Emmanuelle Dé等首次描述肠杆菌(Enterobacteriaceae)孔蛋白L3 环中第112 位氨基酸由G 突变为D 可改变该蛋白的功能从而导致该菌对β-内酰胺类药物的耐药[29]。同样地,淋病奈瑟菌孔蛋白PIB L3 环基因突变同时伴随mtrR 突变导致外排泵(Efflux pump)过表达时可导致该菌对青霉素和四环素耐药[30]。Diene S M 等从一名没有接受碳青霉烯类药物治疗的囊性纤维化(CF)患者身上分离了6 株铜绿假单胞菌(Pseudomonas aeruginosa),其中有5 株对亚胺培南(Imipenem)耐药,1 株敏感。在这6 株菌中均未检测到碳青霉烯酶耐药基因以及碳青霉烯酶活性,PCR 和测序显示耐药菌株(n=5)孔蛋白基因porD 中均存在插入序列ISPa46,而敏感菌株(n=1)存在的插入序列ISPa46 并未插入到porD 基因中,表明其耐药原因与碳青霉烯酶无关,而是孔蛋白oprD基因中插入ISPa46 发生转位导致耐药[31]。临床中耐药细菌可能同时存在耐药基因和孔蛋白基因突变,这些耐药因素的叠加作用致使耐药情况更加复杂化。
3.2 孔蛋白表达水平与细菌耐药
细菌可以在不利于其生存的环境通过调控自身基因的表达来抵抗外来因素的威胁。研究显示,细菌孔蛋白的表达减少可导致细菌耐药。Lee J Y 等从357 株肠杆菌中筛选了31 株耐亚胺培南菌株,通过多位点序列(MLST)和ERIC-PCR 分析显示这些菌株的遗传关系较远,并且在大多数耐药菌株(n=29)中均不存在亚胺培南耐药基因,同时其孔蛋白ompD和ompK35 基因的表达水平均下降;表明亚胺培南抗性似乎在大多数亚胺培南耐药菌株中均是独立发生的,而孔蛋白表达减少是导致亚胺培南敏感性降低的主要原因[32]。此外,非药物特异孔蛋白表达增加时会影响细菌外膜通透性,从而导致细菌对某一类药物敏感或耐药。Anuwat A 等研究显示伯克霍尔假单胞菌(Burkholderia pseudomallei,Bps)表达孔蛋白BpsOmp38 的菌株比对照菌株的抗菌敏感性更低,同时脂质体肿胀试验显示,Bps 耐药的药物(头孢西丁、头孢吡肟和多瑞培南)并不能通过BpsOmp38 通道,Bps 敏感的药物头孢他啶和美罗培南却与此相反;此外,编码BpsOmp38 基因的氨基酸Tyr119 被Ala119 取代时有利于Bps 对抗菌药物的吸收,而被Phe119 取代时则可抑制Bps 对抗菌药物的吸收;表明BpsOmp38 是一个特异性孔蛋白并与膜通透性相关,而残基Tyr119 的替代影响了BpsOmp38 通道对中性糖和抗菌药物的吸收[33]。
4 孔蛋白作为疫苗候选靶标和免疫佐剂
孔蛋白作为一类膜通道蛋白暴露于革兰阴性菌表面,具有高度的免疫原性,可作为疫苗候选靶标及活性佐剂。Yadav 等将40 ku 嗜水气单胞菌孔蛋白OmpF 腹腔免疫小鼠,在49 d 后还能检测到很高的免疫球蛋白IgG 滴度,同时发现该蛋白的抗血清能同时与不同亲水性的气单胞菌反应;此外,该蛋白在体外能够促进小鼠淋巴细胞的增殖和T 细胞分泌IL-4 和IFN-γ[34]。而将同菌株孔蛋白Omp48 免疫鲮鱼,该蛋白可对鲮鱼针对同一菌株和迟缓型爱德华菌(Edwardsiella tarda)提供60%~70%的抗感染能力,表明OmpF 和Omp48 有作为疫苗抗原的潜质[35]。Li等研究显示,副溶血弧菌(Vibrio parahaemolyticus)的孔蛋白VP1061 和VP2850 对鱼和小鼠针对溶藻弧菌(V.alginolyticus)、嗜水气单胞菌(A.hydrophila)和荧光假单胞菌(Pseudomonas fluorescens)的感染具有交叉抵抗能力,而有望成为新型多价疫苗[36]。Tan 等将B型多杀性巴氏杆菌(Pasteurella multocida,Pm)孔蛋白OmpH 分别皮下和腹腔注射免疫小鼠,该蛋白可对小鼠针对同型Pm 菌株分别提供80%和100%的抗感能力;而本实验室将A 型Pm OmpH 与PM0979 融合表达免疫小鼠,该融合蛋白可对小鼠针对A 型和B 型Pm 分别提供70%和30%的抗感染能力[37-38]。另外,奈瑟菌属孔蛋白PorB 作为TLR2 的激动剂已成为佐剂的研究热点,其诱导APCs 的活化以及下游效应分子的表达必须依赖完整的MyD88 信号分子[11]。其中Liu 等用Nlac PorB 作为佐剂并以卵清蛋白(OVA)作为标准抗原免疫小鼠,与单独免疫卵清蛋白相比,可诱导小鼠产生高滴度、OVA 特异的IgG 和IgM,与用Nme-PorB 和铝胶佐剂免疫小鼠产生的抗体滴度相同,并可促进炎性因子IL-4、 IL-10、IL-12 和INF-γ的分泌,以及诱导Th1 和Th2 型免疫反应[39]。最近研究显示,PorB 可诱导小鼠分泌与Th2/Th1 型反应相关的OVA 特异性抗体IgG1、IgG2b、IgG2c 和IgG3 以 及效应分子MIG、MCP-1、IP-10、MIP-1、CXCL1 和IL-2,同时促进T 细胞分泌IL-4、IL-5、IL-13 和IFN-γ;PorB 佐剂疫苗还能促进抗原特异性的CD4+T 和CD8+T 细胞的增殖,同时能降低小鼠在单增李斯特菌低剂量感染时的定殖,提高在高剂量感染时的存活率[40]。表明以TLR2配体为主的奈瑟菌孔蛋白PorB 具有广泛的佐剂和抗原活性,可用于疫苗佐剂研发。
5 小结与展望
孔蛋白有单聚体和三聚体两种结构,其可通过激活补体、作为PAMPs 识别TLR2、通过膜通透性变化等参与细菌的致病过程,同时其本身可作为疫苗候选靶标和佐剂(表1)。孔蛋白L3 环在胞内折叠形成收缩区,以限制大分子物质进入胞内,并且L3环基因突变可导致细菌耐药[29],深入探究L3 环的结构和功能有助于了解细菌的耐药机制,同时为临床研发小分子量、靶向细胞外的一类药物以减少耐药细菌的产生提供参考。然而,细菌的耐药除与细胞膜通透性有关外,还与耐药基因、细菌水解酶的多少以及用药情况息息相关,这为临床用药带来了极大的挑战[2]。佐剂是疫苗的重要组成部分,安全有效的佐剂能够提高疫苗的免疫效果,TLR激动剂已广泛用于人和动物的疫苗生产,例如疟疾、HIV、结核、癌症等许多疑难疾病的疫苗也加入了这些佐剂[41]。研究孔蛋白的TLR2 激动剂效应可为临床疫苗研发的多样性提供新的可能。因此,深入研究孔蛋白的分子结构以及与宿主的相互作用,有利于了解细菌的耐药和致病机制,同时为开发针对细菌病的新型疫苗奠定基础。

表1 革兰阴性菌孔蛋白结构及功能应用

