新型抗菌自修复自粘接树脂水门汀的制备及性能研究
胡格 张新艳 赵家鑫 周传健 吴峻岭
1.山东大学口腔医学院口腔修复学教研所,山东省口腔组织再生重点实验室,山东省口腔生物材料与组织再生工程实验室,济南 250012;2.山东大学材料科学与工程学院高分子材料研究所,济南 250061
自粘接树脂水门汀可以直接与牙本质产生有效结合,高效、方便的特点使其在临床上备受青睐,被广泛地应用到桩核、嵌体、冠、桥等间接修复体的粘接[1]。尽管其性能不断改进,树脂-牙本质粘接界面仍然是薄弱环节[2],在复杂的口腔环境中会出现界面继发龋、微裂纹等,最终导致粘接失效。因此,研发具有抗菌及自我修复微裂纹性能的新型树脂水门汀势在必行。
对于抗菌而言,本课题组前期创新制备了表面接枝长链烷基季铵盐的纳米二氧化硅抗菌无机填料[3],并开展了应用于复合树脂[3]、树脂粘接剂[4]等一系列的研究。对于预防微裂纹而言,本课题组前期研究[5]首次成功合成了含牙科单体三乙二醇二甲基丙烯酸酯的微胶囊,并将一定量的微胶囊加入自行合成的自粘接树脂水门汀中,使其具有自我“感知”并修复微裂纹的功能[6]。
上述研究[3-6]为研发兼具抗菌及自修复双重功能的自粘接树脂水门汀奠定了坚实的基础,对于具有自修复功能的自粘接树脂水门汀而言,作为后续研究,抗菌填料的加入对其粘接强度及抗菌性能等方面的影响是接下来需要重点关注的。因此,本课题在前期工作的基础上,拟将新型抗菌填料添加到具有一定量微胶囊的自粘接树脂水门汀中,并探讨其相关性能,为其进一步的临床应用提供实验依据。
1 材料和方法
1.1 实验材料及设备
纯度99.99%,平均粒径20 nm的M5型纳米二氧化硅(Cabot公司,美国),二甲基十八烷基[3-(三甲氧基硅基)丙基]氯化铵(广州爱谱化工有限公司),γ-甲基丙烯酰氧丙基三甲氧基硅烷(methacryloxy propyl trimethoxyl silane,MPS)(成都晨邦化工有限公司),双酚-A-二甲基丙烯酸缩水甘油酯(bisphenol glycidyl dimethacrylate,Bis-GMA)、三乙二醇二甲基丙烯酸酯(triethylene glycol dimethacrylate,TEGDMA)、甲基丙烯酰氧乙基偏苯三酸酐酯(4-methacryloyloxyethyl trimellitic anhydride,4-META)、N,N-二羟乙基对甲苯胺(N,N-dihydroxyethyl-ptoluidine,DHEPT)、苯基双(2,4,6-三甲基苯甲酰基)氧化膦(phenyl bis(2,4,6-trimethylbenzoyl) phosphine oxide,BAPO)、过氧苯甲酰(benzoyl peroxide,BPO)、乙烯马来酸酐共聚物(ethylene-maleic anhydride,EMA)、尿素、氯化铵、间苯二酚及37%甲醛水溶液(Sigma-Aldrich公司,美国),主体成分是铝硅酸钡颗粒并经过表面偶联处理,平均粒径2 µm的无机填料(Dentsply公司,美国)。
长50 mm、直径7.8 mm的磁力搅拌子及水浴加热装置(Fisher公司,美国),Triad2000型光固化灯(Dentsply公司,美国),5500R型万能力学测试机(Cary公司,美国),TE2000-S型光学显微镜(Nikon公司,日本),Quanta 200型扫描电子显微镜(scanning electron microscope,SEM)(FEI公司,荷兰)。
1.2 含碘代长链烷基季铵盐的新型纳米抗菌无机填料的制备及表面偶联化处理[3]
1.2.1 十八烷基二甲基(γ-三甲氧基硅基丙基)碘化铵的制备 将十八烷基二甲基(γ-三甲氧基硅基丙基)氯化铵、碘化钾按照摩尔比1∶1.1加入装有温度计、磁力搅拌棒、冷凝装置、氮气密封的四口烧瓶中,以无水乙醇作为溶剂,加热至回流1~2 h,真空抽滤,滤饼用无水乙醇洗涤,滤液减压浓缩,脱除溶剂得到淡黄色粘稠的碘代长链烷基季铵盐液体。
1.2.2 新型纳米抗菌无机填料的制备 填料制备按照每0.05 mol的季铵盐和3 g纳米二氧化硅的比例,将十八烷基二甲基(γ-三甲氧基硅基丙基)碘化铵与纳米二氧化硅及无水乙醇加入装有温度计、磁力搅拌棒、冷凝装置的四口烧瓶中,氮气置换,并在氮气保护下加热搅拌回流反应6 h。反应结束后过滤,滤饼用滤纸包好,放入索氏抽提器中,用无水乙醇萃取24 h,取出烘干,得到碘代季铵盐修饰纳米二氧化硅颗粒。
1.2.3 新型纳米抗菌无机填料的表面偶联处理 将0.2 g γ-MPS和10 g抗菌填料加入三口瓶中,再加入50 mL无水乙醇及1 mL蒸馏水,滴加冰乙酸调节pH值至3.0左右,磁力搅拌2 h,过滤,滤饼用无水乙醇反复滤洗,滤饼60 ℃干燥,得到表面偶联化处理的纳米抗菌无机填料。
1.3 微胶囊的合成
采用原位聚合法合成本研究所用的微胶囊,简要过程如下[6]:取30 mL TEGDMA,并加入质量百分比为1%的还原剂DHEPT,混匀备用。室温下,将50 mL蒸馏水和13 mL 2.5%EMA水溶液(表面活性剂)加入平底烧瓶中,烧瓶悬置于水浴加热装置中,磁力搅拌(300 r·min-1)作用下,加入1.25 g尿素、0.125 g间苯二酚及0.125 g氯化铵(催化剂),调节反应体系pH=3.5。之后,将搅拌速度提高至900 r·min-1,缓慢加入30 mL的TEGDMA-DHEPT油相液体,继续磁力搅拌10 min,形成稳定的水包油型乳化溶液。
然后逐滴加入3.15 g 37%的甲醛水溶液,烧瓶用锡箔纸封口,将水浴的温度缓慢上升至55 ℃,磁力搅拌(900 r·min-1)下继续反应4 h,反应结束后,将含有微胶囊的悬浮液缓慢冷却至室温,蒸馏水滤洗,滤饼通风橱内干燥24 h,得到白色微胶囊。取适量微胶囊,蒸馏水分散后光学显微镜测量平均粒径(测量200例);另取适量微胶囊,SEM观测微观形貌。
1.4 新型抗菌自修复自粘接树脂水门汀的制备
本课题组前期成功制备了自修复自粘接树脂水门汀[6],其基本组分为:40%树脂基质(Bis-GMA和TEGDMA按照质量比1∶1构成)+50% 2 µm常规无机填料+5% 4-META(酸性功能单体);微胶囊则以质量百分比7.5%添加;同时加入1%的光敏剂BAPO、1%的氧化剂BPO及0.5%的还原剂DHEPT(均为质量百分比),形成双固化引发体系(过量的BPO还与囊液中的还原剂DHEPT组成氧化-还原反应体系,引发释放出的自修复单体TEGDMA固化)。在避光的条件下,将上述各组份混合均匀,手工调拌,生成母体糊状自修复自粘接树脂水门汀,并分为A(含有光敏剂、氧化剂)、B(含有还原剂)两部分。
在自修复自粘接树脂水门汀的基础上,为探讨不同比例的新型纳米抗菌无机填料对其影响,在保证50%无机填料总量不变的前提下,按照总质量的0(50%常规无机填料)、2.5%(2.5%抗菌填料+47.5%常规无机填料)、5.0%(5%抗菌填料+45%常规无机填料)、7.5%(7.5%抗菌填料+42.5%常规无机填料)和10.0%(10%抗菌填料+40%常规无机填料)的比例添加,分成5组,分装后备用,以上均为质量百分比。
1.5 粘接强度的测试
采用剪切法进行牙本质-树脂粘接强度的测试。
选择新鲜拔除的人(前)磨牙30颗,要求无龋、无裂纹及缺损。自凝塑料固定牙根于包埋磨具中,高速涡轮机+金刚砂车针在喷水降温下,自釉牙骨质交界处上方2 mm处切除冠部牙体组织,充分暴露牙本质。再采用400、600、800目的水砂纸逐级打磨牙本质各10 s,超声清洗5 min,得到标准的牙本质粘接面。然后将预制直径为3 mm圆孔的双面胶带纸粘于牙本质粘接面上,并确保牙本质粘接面未受污染且避免过度干燥(保持适度潮湿),然后固定内径4 mm、高2 mm的预制铜环于带圆孔的双面胶上,使铜环的中心与圆孔的中心一致,铜圈外周用凡士林封闭。取等量A、B两组分树脂水门汀手工混匀,然后沿铜环内壁缓慢充填自粘接树脂水门汀至铜环等高,光照固化40 s,1 h后将试件贮存于37 ℃蒸馏水中24 h后待测(每组6个试件)。将试件通过自制夹具固定于万能材料试验机上,加载头与粘接面平行,下降速度0.5 mm·min-1,加载点位于铜环上距粘接界面0.5 mm处,直至粘接失败,计算粘接强度[6-7]。
1.6 力学性能的测试
1.6.1 采用三点弯曲法测试试件的弯曲力学性能 取特制的内腔尺寸为2 mm×2 mm×25 mm的可分卸金属磨具,充填上述调和后的树脂水门汀(A、B双组分),充满后上下覆盖聚脂薄膜带后再覆盖载玻片,压实,光照固化40 s,1 h后取出试件,用细砂纸轻轻打磨掉飞边,置于37 ℃蒸馏水浸泡24 h待测(每组10个试件)。
将待测复合树脂试件置于万能力学测试机加载平台上,加载条件为:加载速度1 mm·min-1,跨距10 mm,直至树脂试件碎裂。计算试件的弯曲强度(S)和弹性模量(E)[4]。
1.6.2 采用单刃V形切口梁法测试试件的断裂韧度同样方法制备2 mm×2 mm×25 mm的长条形树脂试件。于树脂试件底部用ST300-10P型刀片(DORCO公司,韩国)锯开深约500 μm的平行于加载方向的裂痕,而后更换新的刀片并粘取粒径3 μm的金刚砂抛光膏继续将裂痕小心切削至深700~800 μm,宽约20 μm,金相显微镜下分别测量试件裂痕两侧的深度,取其均值作为裂痕的最终深度。置于37 ℃蒸馏水浸泡24 h待测(每组6个试件)。将待测复合树脂试件置于万能测试机加载平台上,加载头精确对准裂痕,加载条件为:加载速度0.5 mm·min-1,跨距10 mm,直至树脂试件断裂,计算试件的断裂韧度(KIC-virgin)[6]。
1.7 自修复效率的检测
为更好地模拟临床上口腔内树脂水门汀粘接固化后发生微裂纹的实际情况,将上述折裂为2段的树脂试件片迅速准确复位至相对应的可分卸金属磨具中,并确保两断端结合紧密,上下覆盖载玻片,夹子夹紧,试件置于37 ℃的潮湿恒温箱中,自修复24 h[5]。然后小心取出自修复后的树脂试件,光学显微镜下再次测量裂痕的长度,确保与自修复前的裂痕长度一致,而后同样的方法测试断裂韧度,得到自修复后的断裂韧度KIC-healed。自修复效率(η)的计算公式为[6]:η=KIC-healed/KIC-virgin。
1.8 抗菌性能的测试
取96孔板的上盖,将树脂水门汀充满盖内的圆形凹槽,上覆条状聚脂薄膜带,轻轻压平,光固化后小心分离,生成厚度为1 mm、直径为8 mm的圆盘状树脂片,每组6个试件,环氧乙烷消毒后备用。根据研究[4]的方法,继续采用封闭式的体外人牙菌斑生物膜培养模型作为研究对象,进行抗菌性能的检测。
该模型基于24孔板,通过48 h的连续厌氧培养后,在树脂水门汀试件表面获得成熟稳定的体外人牙菌斑生物膜。而后进行人牙菌斑生物膜菌落形成单位(colony-forming unit,CFU)计数、乳酸脱氢酶法检测人牙菌斑生物膜乳酸产量等测试[4]。
1.9 统计学分析
选用SPSS 19.0统计学软件对测试结果进行单因素方差分析,并选用SNK法进行两两比较,检验水准设定为α=0.05。
2 结果
2.1 光学显微镜及SEM观测结果
经光学显微镜观测测量,微胶囊粒径略有不同,平均粒径为(24±11)μm 。SEM照片见图1,微胶囊呈圆球形,囊壁表面粗糙,附着有很多细小颗粒。
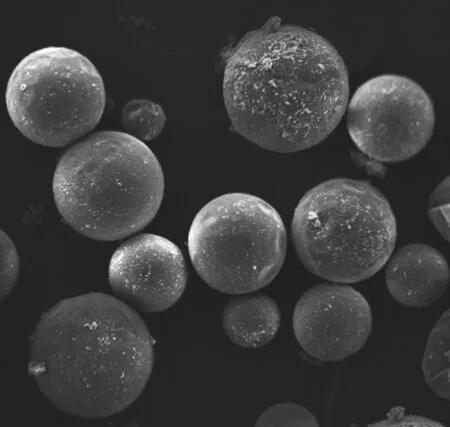
图1 微胶囊SEM照片 × 1 000Fig 1 SEM photo of microcapsules × 1 000
2.2 粘接强度测试结果
各组试件粘接强度测试结果如表1所示。添加质量百分比为5.0%的抗菌无机填料对粘接强度没有影响(P>0.1);而当抗菌填料质量百分比超过7.5%时,粘接强度下降明显(P<0.05)。
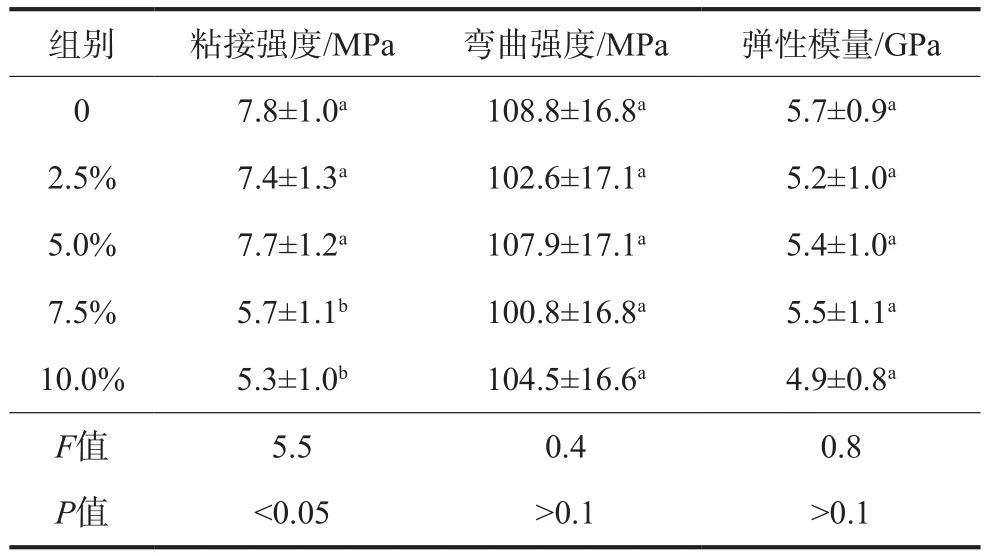
表1 粘接强度、弯曲强度及弹性模量测试结果Tab 1 Results of bonding strength, flexural strength and elastic modulus
2.3 力学性能测试结果
1)各组试件的弯曲强度以及弹性模量的测试结果如表1所示。各组之间三点弯曲强度以及弹性模量无明显的差别,这说明,加入一定量的抗菌无机填料对树脂水门汀的基本弯曲等力学性能没有影响(P>0.1)。
2)各组试件原始断裂韧度及自修复后断裂韧度如表2所示。与基本弯曲力学性能测试结果类似,向树脂水门汀中加入抗菌无机填料不会降低其断裂韧度(P>0.1)。
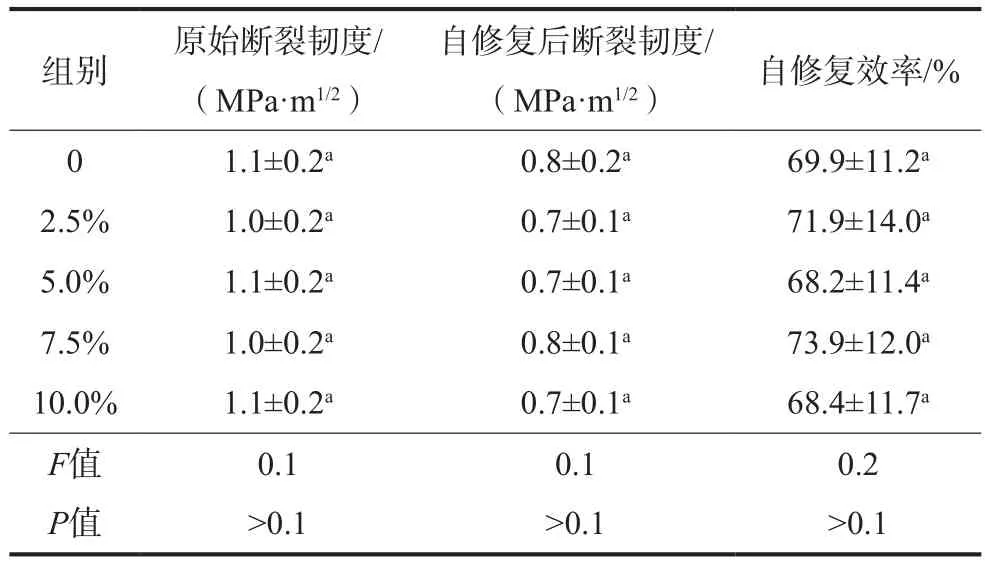
表2 断裂韧度及自修复效率测试结果Tab 2 The results of fracture toughness and self-healing efficiency
2.4 自修复效率测试
结果如表2所示,不同组别的自修复效率没有差别(P>0.1),证实抗菌填料的加入没有影响新型树脂水门汀的自修复性能。
2.5 抗菌性能测试结果
各组试件的CFU计数和乳酸代谢测试结果见表3。与对照组相比,添加2.5%的抗菌无机填料就能使菌斑生物膜中的细菌数量呈数量级减少(P<0.05),说明新型树脂水门汀有较强的抗菌性。当抗菌填料质量分数为2.5%及以上时,各实验组的乳酸产生量约为对照组的1%,表明新型抗菌自修复树脂水门汀可以显著抑制人牙菌斑生物膜中的乳酸产生量(P<0.05)。
3 讨论
自修复材料是一类能够模仿生命系统自修复特性,具有感知和激励双重功能的材料,材料一旦产生缺陷,在无外界作用的条件下能够自我修复。利用微胶囊技术是制备自修复智能复合材料的主要途径之一[8]。该方法的原理是,当材料受到外界影响而损伤时,基体内部首先出现微裂纹,微裂纹的扩展会刺破基质内部预先埋置的微胶囊,囊内的单体在毛细管的作用下流出并填充到微裂纹区域,单体在微裂纹区域与预先分散在基体中的催化剂接触,发生固化反应,从而阻断裂纹扩展,修复基体损伤,达到自修复的效果。2001年White等[9]首次合成了以脲醛树脂包裹自修复单体双环戊二烯的微胶囊,添加到预置Grubb’s催化剂的环氧树脂中,得到了75%的自修复效率。随后有学者[10]将此微胶囊与Grubb’s催化剂共同添加到牙科复合树脂材料中并获得了57%的自修复效果。但是,自修复单体双环戊二烯的毒性、Grubb’s催化剂的生物安全性等却限制了其在牙科领域的进一步应用[5]。基于此,在本课题组的前期研究[5]中,首次合成了以脲醛树脂为囊壁材料,TEGDMA为自修复单体的微胶囊,并使用口腔领域常见的BPO和DHEPT组成氧化-还原引发体系,来实现牙用高分子材料自修复特性,研究结果表明,微胶囊平均粒径70 μm,具有良好的热稳定性,易于储存,不具细胞毒性;并赋予了牙用树脂[5]、复合树脂材料[11]及树脂粘接剂[12]优越的自修复性能。与全酸蚀或自酸蚀类树脂充填或粘接材料不同,自粘接树脂水门汀由于含有磷酸酯等酸性功能单体,可以对牙本质产生轻度酸蚀,并直接与牙本质发生化学结合,所以不需对牙面进行任何处理而直接实现粘接[1]。通常,固定修复的间接修复体组织面与基牙的间隙不超过50 μm[13],所以有必要将微胶囊粒径降低至合适的范围。基于此,前期研究[6]及本研究选择使用的微胶囊平均粒径在24 μm左右,能够适应粘接间隙的要求。自修复材料的自修复能力经常用自修复效率来评价,而自修复效率则是指材料自修复后其断裂韧度回复的多少[5]。本研究使用的自修复树脂水门汀微胶囊的含量为7.5%,当抗菌无机填料的含量从0~10%变化时,自修复效率没有改变,维持在68%~74%(表2),与前期研究[6]报道的结果一致,说明抗菌无机填料的加入没有影响微胶囊的自修复效果,可以实现与微胶囊在树脂基质中的共混,也证实了本研究设计的自粘接树脂水门汀具有良好的自修复特性。
因为现有绝大多数的牙科树脂均不具有抗菌性,加之与其他牙科常用材料相比,树脂类材料更容易吸附细菌,经常会发生治疗后继发龋、牙髓炎性反应等并发症。所以,国内外学者开展了大量对树脂材料抗菌改性的工作。大家采用最多的方法是合成接枝季铵盐抗菌基团的各类甲基丙烯酸基抗菌单体,然后添加到树脂中,在使用时,与树脂单体共聚合形成非溶出性的抗菌材料,达到赋予树脂抗菌性的目的[14]。例如,日本学者Imazato等[15]首次将季铵盐分子接枝到甲基丙烯酸酯单体上,并且很好地实现了与树脂基质单体的共聚合,生成非溶出性抗菌树脂。Zhang等[16]将合成的甲基丙烯酸十六烷基二甲铵季铵盐抗菌单体加入树脂加强型玻璃离子水门汀中,对体外培养的人牙菌斑生物膜代谢产生了超强的抑制作用。季铵盐主要通过与细胞膜的相互作用并破坏其完整性来发挥抗菌活性。其中,对于单链季铵盐的抗菌机制可以描述为:吸附到菌体表面,疏水基插入类脂层中,改变细胞壁/膜的通透性,胞内物质泄漏/酶或蛋白质变性,最后菌体死亡等[3]。而且其抗菌活性取决于烷基链的长度,当4~18碳链长时具有抗菌活性,且随着烷基链的增长,抗菌活性越强[17]。受到季铵盐抗菌单体及长链季铵盐抗菌的启发,本课题组另辟蹊径,首次采用抗菌效果良好的碘代长链烷基季铵盐处理纳米二氧化硅颗粒,以期合成新型纳米抗菌无机填料。由于纳米二氧化硅填料表面富含羟基,所以可以与季铵盐中的烷氧基反应,形成牢固的共价键结合,达到表面接枝季铵盐的目的。同时,本研究通过反应体系的设定与控制,使二氧化硅表面余留出部分羟基,与水解后的硅烷偶联剂(γ-MPS)的亲无机物基团反应,从而达到表面偶联处理的目的[3]。最终,在纳米二氧化硅的表面既存在具有抗菌活性的长链季铵盐,又有不饱和的碳碳双键,使填料可与树脂基质共交联固化,形成非溶出性抗菌材料。为此,本课题组也开展了一系列应用于牙科树脂的研究,结果显示:经偶联处理后的一定量的纳米抗菌无机填料很好地实现了与复合树脂[3]及树脂粘接剂[4]的共混,显示了良好的抗菌性能,为应用于牙科领域奠定了基础。而在本研究中,加入质量百分比2.5%及以上含量的抗菌填料就能对体外培养的人牙菌斑生物膜代谢产生明显的抑制,菌落计数及乳酸代谢呈数量级下降,这也与本研究的前期报道结果一致[4],所以偶联后的抗菌填料可以与树脂基质产生牢固的化学结合,形成非溶出性抗菌树脂水门汀,持续地发挥抗菌作用。
如何在不改变母体材料基本特性的前提下,确定合适的改性材料添加量和最佳组分配比,是开展类似研究要关注的问题。前期研究[6]证实,微胶囊添加含量达到7.5%时可以使自修复树脂水门汀获得良好的自修复效能。在此基础上,本研究继续探讨了不同含量的纳米抗菌无机填料对树脂水门汀基本力学性能和粘接强度的影响。结果表明,在本实验方案设计中,当抗菌填料含量达到10%时,树脂水门汀的弯曲强度、弹性模量及断裂韧度等基本力学性能没有变化(P>0.1)。而前期研究[4]证实,10%质量百分比的纳米抗菌填料由于“团聚”会导致树脂粘接剂力学性能明显下降(P<0.1),这与本实验的测试结果不一致。推测原因,除了纳米抗菌填料以外,本实验合成的新型树脂水门汀还含有一定质量分数的常规无机填料,对树脂水门汀的宏观力学性能起到很大的决定作用,在一定程度上抵消了纳米填料团聚的负影响,因而表现为材料的弯曲强度和断裂韧度等变化不明显。所以就力学性能而言,是否可以引入更多含量的抗菌填料,尚待后续深入探索。而对于牙本质粘接强度来说,当抗菌填料的质量分数达到7.5%时,与对照组相比,粘接强度明显下降(P<0.05),这与含抗菌填料的树脂粘接剂粘接强度的研究结果一致[4]。分析原因,可能与过量抗菌填料(≥7.5%质量百分比)的加入使得水门汀稠度增加或者纳米级抗菌填料“团聚”于树脂水门汀-牙本质粘接界面[4],成为影响粘接强度的负因素,这还需要进一步的研究证实。从粘接强度、力学性能、自修复效果及抗菌性能等测试结果综合来看,在本实验条件下,质量百分比为5.0%的抗菌填料添加量是最佳的。
制备具有抗菌、自修复等多功能的树脂类粘接材料并提高粘接的耐久性是牙科高分子材料研究的一个新方向。本文在前期研究的基础上,将自行合成的纳米抗菌无机填料添加到自修复自粘接树脂水门汀中,并进行了一系列的测试,得出了有益的结论,为此类研究开辟了新的思路。但是,本文只是进行了初步的探索,后续的研究应该集中在实际口腔环境下的近(远)期抗菌、自修复效果的探讨等方面。
利益冲突声明:作者声明本文无利益冲突。

