液相色谱-串联质谱法测定牛排产品中大豆蛋白含量
李莹莹,张颖颖,任 南,李石磊,赵文涛,田寒友,王守伟
(中国肉类食品综合研究中心,北京 100068)
牛排起源于西方国家,是历史悠久的西式菜肴。近年来我国人民生活水平提高,牛排产品市场快速增长,据行业统计,目前规模以上牛排生产企业已达200余家,牛排的产量也快速增长。目前市售的预包装牛排以牛肉为主料,同时添加淀粉、大豆蛋白等改善牛肉风味。不同工艺的牛排价格差异显著,等级也不同,目前牛排等级划分主要依据蛋白含量。大豆蛋白成本低,加入一定量的大豆蛋白,可以提高蛋白含量,但有些商贩虽然加入了大豆蛋白,但在标签上却未作标注或标注不实,也属于一种欺诈行为。目前缺少大豆蛋白定量的准确方法,在牛排定级上也存在一定的困难,因此,有必要建立适用于牛排产品中大豆蛋白含量测定的方法。
传统的蛋白分析方法主要为凯式定氮法。在待测对象中,当大豆蛋白和其他动物蛋白或者植物蛋白成分混合在一起时,需要对不同蛋白成分进行区分[1]。岳巧云等[2]采用实时聚合酶链式以应(real-time polymerase chain reaction,real-time PCR)法,以大豆内源基因为参照基因,按比例混合奶粉和含大豆蛋白的配方营养粉进行测定,可以判断奶粉中是否掺入了豆粉。许任伟[3]设计了大豆蛋白的特异性引物和探针,构建了real-time PCR鉴别牛肉制品掺假大豆方法。但PCR技术也存在一定问题,如DNA易受复杂基质干扰[4]、加工过程易降解[5]等。以特异的肽段作为生物标志物的质谱技术[6-7]在物种定性定量分析展现了强大的技术优越性。该技术以特征肽段为研究对象,肽段的基础氨基酸序列在加工过程中比DNA更为稳定,使其在深加工制品的处理和定量测定方面具有不可比拟的优势[8-9]。质谱多重以应监测(multiple reaction monitoring,MRM)是针对靶标分子的一种质谱分析技术,注重有限目标的蛋白质定量测定,在蛋白质分析检测应用领域极有发展潜力[10]。国外实验室目前主要针对熟肉制品,包括猪[11]、牛[12]、鸡[13]、马[14]、火鸡[15]等不同的动物物种开展研究工作,而植物蛋白相对研究较少。其中,Josephine等[16]对3 种不同的小麦开展了特异性多肽的筛选,并构建液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)的鉴别方法,可以实现1%添加的鉴别。Alexander等[17]使用Nano LC-MS/MS和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳对大豆蛋白进行筛选,最终选择大豆球蛋白G4亚基A4作为鉴定的标记蛋白。Hoffmann等[18]构建高效液相色谱-串联质谱区分肉制品中羽扇豆、豌豆和大豆成分的方法,并利用同位素内标法测定其多肽和所属蛋白的含量。该研究领域由于蛋白类型繁多,涉及蛋白家族,各种亚基,以及不同多肽质谱响应差异显著,开展定量分析难度比较大[19],研究较少。目前,采用同位素内标法对肉制品中过敏蛋白进行定量测定[20],以及非标记定量方法定量肉制品中的成分[21],但鲜见大豆蛋白定量分析相关研究报告。
本研究采用高灵敏度、高扫描速度的高分辨质谱系统鉴定大豆蛋白,通过比较和分析寻找其特异性多肽,通过Unitprot数据库进一步筛查确认,以及LC-MS/MS系统验证,筛选大豆蛋白特异性强、稳定性好的多肽,并确证可用于定量分析的多肽,拟建立一套用于大豆蛋白定性定量分析的LC-MS/MS方法,以期实现对于牛排产品中大豆蛋白含量的测定。
1 材料与方法
1.1 材料与试剂
牛排 市购;大豆分离蛋白(1#)、豌豆蛋白、玉米蛋白、花生蛋白、小麦蛋白 北京美添前景科技有限公司;大豆分离蛋白(2#、3#)、大豆浓缩蛋白(4#、5#) 山东万得福实业集团有限公司;生鲜牛肉来自屠宰场。
胰蛋白酶(测序级)、二硫苏糖醇(生化级)美国Promega公司;碘乙酰胺、三氟乙酸(均为生化级) 美国Sigma公司;甲酸、乙酸、乙腈(均为色谱纯) 德国CNW科技公司;HLB固相萃取柱(60 mg,3 mL) 美国Waters公司;尿素、硫脲、盐酸、碳酸氢铵均为国产分析纯。
牛肉-大豆蛋白的混合体系:参照牛排通用的生产工艺[22],构建牛肉-大豆蛋白的混合体系,大豆蛋白含量根据实验内容适当调整,其他成分按照牛肉(10 g)、水(3.5 g)、淀粉(0.15 g)、三聚磷酸盐(0.04 g)、盐(0.2 g)比例混合备用。
1.2 仪器与设备
Vanquish UPLC-Q Exactive HF-X液相色谱-高分辨质谱(配有电喷雾离子源及TraceFinder 4.1数据处理系统以及Proteome Discoverer2.8软件)、TSQ ultra EMR LC-MS联用仪(配有电喷雾离子源、TraceFinder 4.1数据处理系统) 美国Thermo Fisher公司;ZWY-110X30往返式水浴恒温摇床 上海智诚分析仪器制造有限公司;JXFSTPRP-II液氮冷冻研磨仪 上海净信发展有限公司;20PR-520离心机 日本Hitachi公司。
1.3 方法
1.3.1 样品前处理
称取0.5 g样品(精确至0.001 g),放置5 mL离心管中,加入2.5 mL缓冲盐提取液(pH 8.0,0.05 mol/L Tris-HCl、6 mol/L尿素溶液、2 mol/L硫脲溶液),打开液氮,冷冻研磨(60 Hz,45 s)2 次后,15 000 r/min离心15 min。
取100 μL上清液,放置5 mL离心管,加入50 mmol/L二硫苏糖醇溶液30 μL,56 ℃振荡以应1 h,降至室温后加入100 mmol/L碘乙酰胺溶液33 μL,暗处以应30 min;向上述以应体系中加入50 mmol/L NH4HCO3100 μL,然后加入20 μg胰蛋白酶,37 ℃以应过夜。放置室温后,加入0.4%三氟乙酸溶液终止以应,准备上样。依次用3 mL乙腈、50%乙腈溶液、0.5%乙酸溶液活化HLB固相萃取柱,全部溶液上样,再依次用3 mL水,0.5%乙酸溶液淋洗,最后用2 mL乙腈-0.5%乙酸(6∶4,V/V)洗脱,过0.22 μm滤膜,待测[23]。
1.3.2 液相色谱-高分辨质谱分析
LC条件:Hypersil GOLD C18色谱柱(2.1 mm×100 mm,1.9 μm);流动相:A为0.1%甲酸-水,B相为0.1%甲酸-乙腈;洗脱程序:0~2 min,5% B;2~10 min,5%~40% B;10~16 min,40%~80% B;16~18 min,80%~5% B;流速0.2 mL/min;柱温40 ℃;进样量10 μL。
MS条件:喷雾电压3.4 kV;毛细管温度320 ℃;离子源雾化温度350 ℃;鞘气压力40 arb;辅气压力15 arb;离子化模式:正模式;扫描模式:Full MS-dd-MS2;全扫描分辨率120 000 FWHM;质量扫描范围m/z 350~1 500;自动增益值为3×106,最大离子注入时间20 ms,二级质谱扫描分辨率为15 000 FWHM,topN为20(前20强),自动增益值为1×105,最大离子注入时间为100 ms,碰撞能量为27 V[24]。
数据分析:用蛋白质组学处理软件Proteome Discoverer(PD 2.8)对高分辨质谱采集的数据进行非标记定量分析,检索数据库为Uniprot对应物种的数据全库,搜索流程按图1进行,最多漏切位点设为2,每个多肽最大平均修饰为3,母离子质量偏差为10×10-6,多肽最小长度为6,其他参数为默认值。
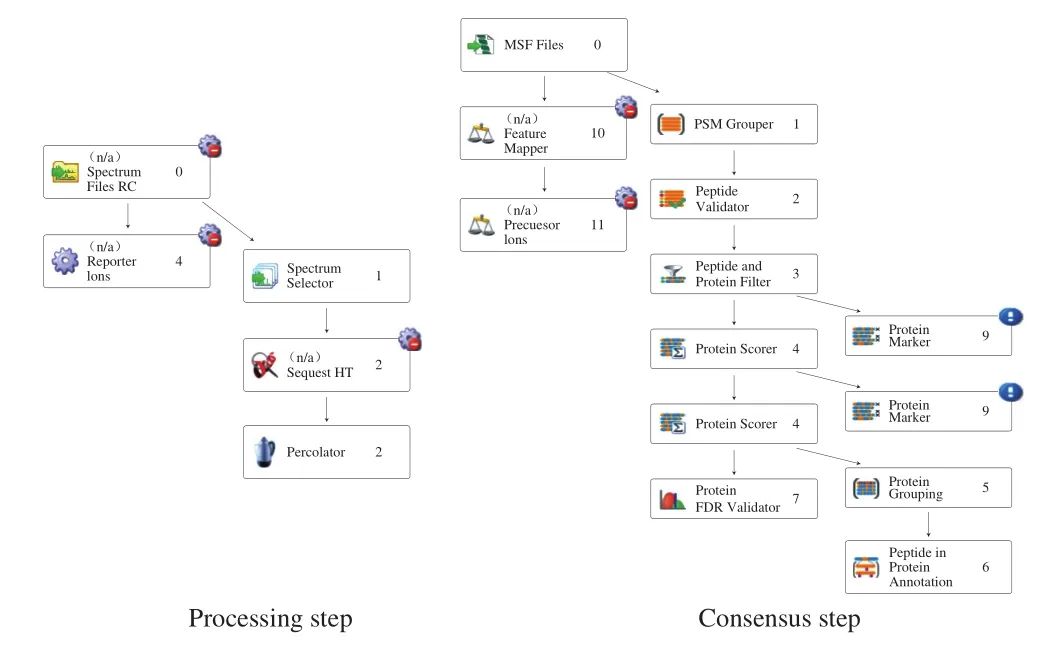
图1 PD软件分析流程图Fig. 1 Workflow of PD analysis
1.3.3 LC-MS/MS分析
LC条件:Hypersil GOLD C18色谱柱(2.1 mm×100 mm,1.9 μm);流动相:A相为0.1%甲酸-水,B相为0.1%甲酸-乙腈;洗脱程序:0~2 min,5% B;2~10 min,5%~40% B;10~16 min,40%~80% B;16~18 min,80%~5% B;流速0.2 mL/min;柱温40 ℃;进样量10 μL。
MS条件:喷雾电压3 000 V;离子源雾化温度350 ℃;离子传输管温度300 ℃;鞘气压力45 arb;辅气压力15 arb;碰撞气压强1.5 mTorr;离子化模式:正模式;采集方式:MRM。
数据分析:通过PD软件找出大豆物种的专属性多肽链,将多肽序列列表导入到skyline软件,获得每个多肽链的母离子和子离子碎片信息,并将离子信息导入LCMS/MS中,开展MRM扫描,通过对比每组离子对的保留时间、响应强度等信息,对特异性离子对进行筛查,以确定定性离子信息。
1.3.4 标准曲线的制作
称取0.1 g(精确至0.000 1g)大豆分离蛋白(1#)按照1.3.1节前处理方法,第1步离心后,分别取20、50、100、150、200 μL,质量浓度以大豆蛋白质量计,对应的质量分别为0.020 0、0.050 0、0.100、0.150、0.200 g,进行后续的实验操作,待测溶液进LC-MS/MS分析。以大豆蛋白的质量作横坐标,筛选的大豆蛋白多肽峰面积作纵坐标,计算回归方程。
1.3.5 检测结果计算
待测样品的称样量(g)为m,将待测样品各个多肽的峰面积代入对应大豆蛋白多肽的回归方程,得到相应大豆蛋白的质量(g)为mi,待测样品中大豆蛋白质量分数X按下式计算:

2 结果与分析
2.1 前处理的优化
2.1.1 提取溶剂的选择
不同提取溶剂提取出的蛋白种类和数量不同,需优化提取溶剂以最大化地提取蛋白。3 种常见蛋白的提取溶剂分别为0.05 mol/L Tris-HCl缓冲溶液、缓冲溶液2(0.05 mol/L Tris-HCl、6 mol/L尿素溶液)、缓冲溶液3(0.05 mol/L Tris-HCl、6 mol/L尿素溶液、2 mol/L硫脲溶液)。考察3 种溶剂对大豆蛋白中大豆专属多肽的提取效果,由图2可知,缓冲液2、3能够将大豆蛋白的12 条多肽全部提取出来,而缓冲液1对多肽3、4、6、7、11等提取效率比较低。对比缓冲液2、3可以发现,缓冲液3提取的多肽响应值大部分都高于缓冲液2,因此,Tris-HCl+尿素+硫脲组合的提取溶剂为最佳选择。
高浓度的尿素能有效地使蛋白质变性,尤其破坏非共价键结合的蛋白质,可以提高蛋白质的可溶性[25];而加入硫脲,两者联合发挥协同作用,更增强了溶解疏水蛋白质的能力[26-27];此外,蛋白质变性后,打开多肽链成为无规构象,也便于后续溶剂接近基团进行以应。蛋白提取是在液氮条件下进行高速振荡,既破坏组织细胞,释放蛋白,又可尽量减少细胞内的酶解以应[28]。

图2 不同提取溶剂对多肽的提取对比Fig. 2 Comparative analysis of peptide extraction with different extraction solvents
2.1.2 酶解条件
传统胰蛋白酶解时间一般为12~16 h(过夜),酶解时间过长影响实验效率,酶解时间不足导致获得多肽不充分[29]。考虑到待测样品中既有动物蛋白也有植物蛋白,蛋白含量较高,酶解后得到的多肽浓度需足够,同时考虑到酶解后多肽的重复性对于定量分析很重要,因此有必要考察酶解时间和多肽含量的关系。分别考察酶解2、4、6、8 h及过夜(16 h)的条件下,目标多肽的测定情况,结果显示,不同酶解时间均能检测到目标多肽,但各多肽的含量有一定差异。短时间酶解后多肽的重复性比长时间酶解的重复性差,过夜酶解的重复性最好。因此为了确保酶解充分,选择过夜酶解。
2.2 大豆蛋白定性多肽的筛选
特异多肽的筛选是构建质谱方法的关键所在,也是构建大豆蛋白定性方法的前提。常用的植物蛋白主要包括大豆蛋白(1#~5#)、豌豆蛋白、玉米蛋白、花生蛋白和小麦蛋白,利用高分辨质谱准确的定性鉴别能力,将这些常见的植物蛋白按照1.3.1节前处理方法进行处理,每个样品平行3 次,按照1.3.2节检测条件进行上机分析。将得到的高分辨质谱扫描数据导入PD2.8软件,针对Unitprot对应物种蛋白搜库,可寻找到大豆蛋白特有的多肽列表,将多肽信息导入LC-MS/MS进行分析,确认母离子、子离子信息,构建MRM分析方法,并进一步开展多肽的验证。
大豆蛋白含量丰富,数据库资源也比其他植物蛋白信息充分,筛选到的多肽达3 000多条。通过PD软件分析,并搜索Unitprot数据库确认,发现大约6%多肽是大豆特异性多肽。将这些多肽序列导入到skyline软件,可转化成离子对信息,再将离子对信息导入到LC-MS/MS,参照1.3.3节方法分析。
MRM是针对靶标分子的一种质谱分析技术,该技术采用三重四极杆质谱仪,检测靶标分子的母离子和子离子的质谱响应信号,从而获取较灵敏和高重复性的定性和定量信息,具有灵敏、准确和特异等特点[30]。各个多肽的氨基酸组成不同,序列长度、等电点不同,导致在LC-MS/MS上的保留时间、离子化和质谱响应等都有明显差异,因此需要开展适用于LC-MS/MS上特异性多肽的挑选,需要满足以下条件[31]:每个多肽母离子下子离子不少于3 个;母离子和子离子响应较高。按照此条件,共挑选出大豆定性多肽12 个,多肽信息见表1。以挑选出的多肽ESYFVDAQPK为例,相对分子质量为1 183.28,带2 个正电荷,母离子m/z592.3,挑选出4 个子离子,分别为m/z558.3、244.2、657.4、804.4,见图3A~D。

表1 筛选出的大豆定性多肽列表Table 1 List of peptides selected for qualitative analysis of soybean protein


图3 ESYFVDAQPK多肽提取离子流图Fig. 3 Extracted ion current chromatogram of peptide ESYFVDAQPK
2.3 大豆蛋白定量多肽的筛选
肉制品中添加的大豆蛋白越多,大豆蛋白含量越高,意味着大豆多肽含量越高。但考虑到多肽种类繁多,酶解过程复杂,影响因素较多,并不是所有特异性多肽的含量与蛋白含量呈正相关,因此需要开展定量多肽的筛选。定量多肽需要具备两大特征,第1是可以构建较好的线性关系(相关系数不应低于0.99),第2是能够满足方法构建需要的回收率。
2.3.1 标准曲线
目前没有大豆蛋白定性定量的标准物质,选择肉制品加工常用的大豆分离蛋白(纯度在92%以上)作为标准物质,称取0.100 9 g大豆分离蛋白1#按照1.3.4节方法,以大豆蛋白的质量作横坐标,表1筛选的12 条多肽的峰面积作纵坐标,分别构建相应的线性曲线,排除线性关系系数小于0.99的多肽,见表2。以大豆多肽LITLAIPVNKPGR为例,以大豆蛋白质量计分别为0.020 1、0.050 2、0.101、0.151、0.201 g,峰面积分别为359 551、946 798、1 879 419、2 904 559、3 811 630,其构建的线性方程为y=1.906×107x-2.485×104。筛选的8 条多肽主要来源于pyruvate kinase、α-subunit ofβ-conglycinin、glycinin、kunitz trypsin inhibitor、3S albumin、2S albumin大豆的主要蛋白。其中α-subunit ofβ-conglycinin、glycinin、3S albumin、2S albumin蛋白与Alexander等[17]筛选的大豆蛋白的结果相符。
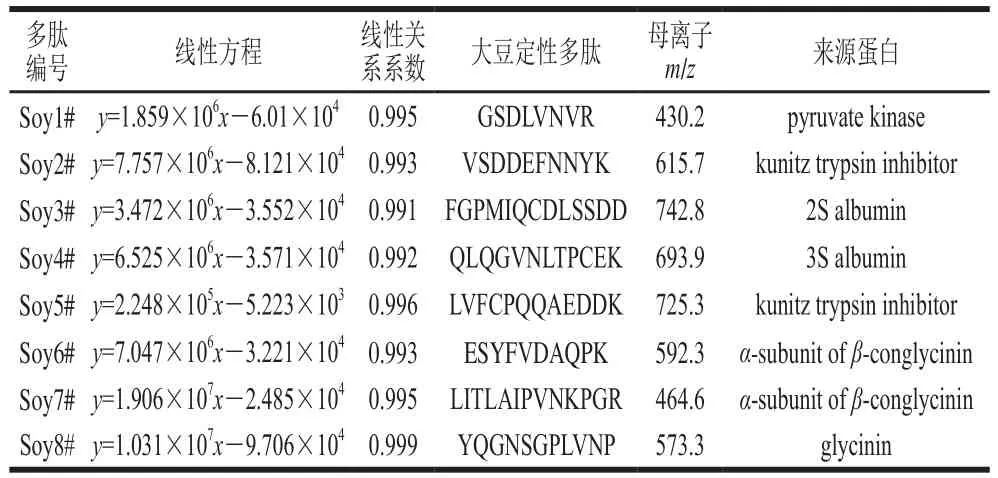
表2 线性关系系数大于0.99的多肽列表Table 2 List of peptides with linearity correlation coefficients greater than 0.99
2.3.2 回收率结果
参照混合不同含量的大豆蛋白,将混合后的样品按照前处理方法,选择表3中的8 条多肽进行LC-MS/MS测定,采用标准曲线定量计算加标回收率。
表1中的8 个多肽,部分多肽回收率太高,超过140%,有些回收率太低,低于60%,soy1#、soy2#、soy5#多肽计算的回收率为81.7%~115.8%,精密度小于13%,见表3,证明该3 个多肽用作定量具有较高的准确度和稳定性,使用该方法能够较可靠地测定牛排样品中大豆蛋白含量。
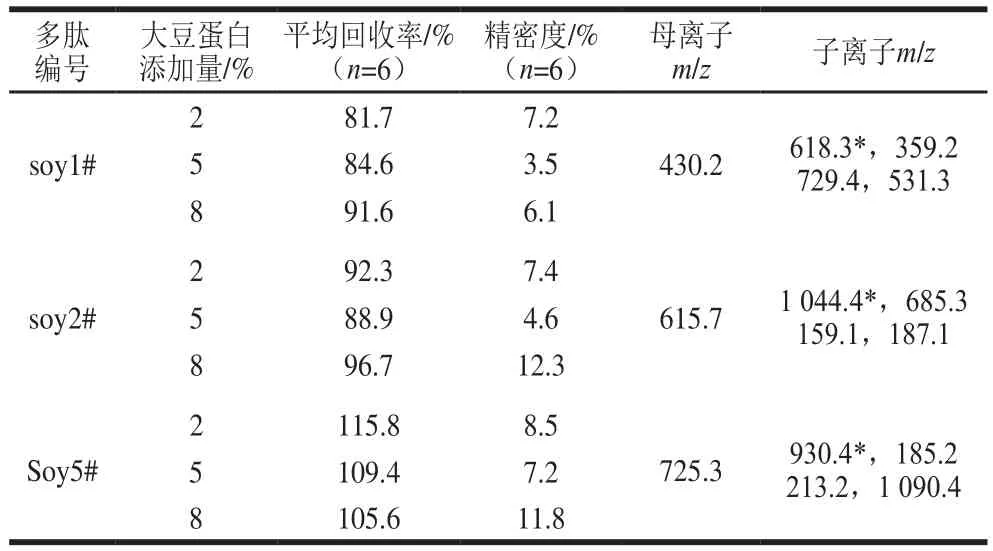
表3 3 个定量多肽的回收率和精密度Table 3 Recoveries and precision of the three peptides
综合以上结果,最终确认用于大豆蛋白定量的多肽为GSDLVNVR、VSDDEFNNYK、LVFCPQQAEDDK。
2.3.3 LC-MS/MS方法检出限结果
为了测定方法的灵敏度,将大豆蛋白按质量分数0.15%添加到牛肉-大豆蛋白混合体系,进行样品处理及数据分析,结果显示大豆蛋白用于定量的3 条多肽均有检出,以3 倍和10 倍信噪比确定方法的检出限和定量限,最终确定大豆蛋白3 条定量多肽的检出限为0.15%,定量限为0.5%。
2.4 真实性样品的测定

表4 市售牛排中大豆蛋白含量测定结果Table 4 Determination of soybean protein content in commercial steak based on the three peptides
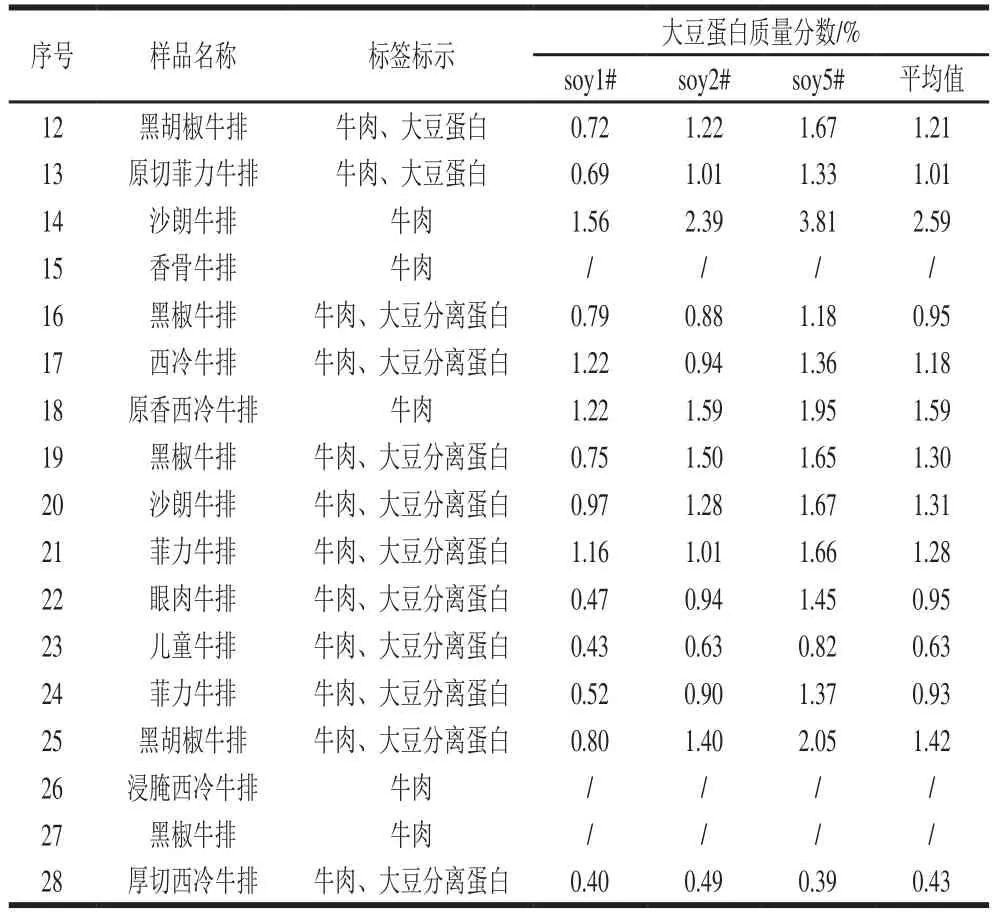
续表4
为了进一步验证该方法的适用性,市购牛排28 件并进行检测,见表4。结果显示,绝大多数市售牛排都做了合理标示,大豆蛋白检测结果也在合理范围。但7、8、9、14、18号牛排的配料表中仅标识了牛肉,但实际测定出大豆特异性多肽,证明确实加入了大豆蛋白,尤其14号沙郎牛排,大豆蛋白含量超过2%。
3 结 论
本研究针对牛排产品构建基于LC-MS/MS对大豆蛋白准确定性及定量的分析方法,共筛选出大豆蛋白的特征定量多肽3 条,并经过方法学验证,检出限为0.15%,定量限为0.5%,平均加标回收率为81.7%~115.8%,精密度小于13%。采用本方法准确度高、干扰少,具有较高的灵敏度和回收率。建议研制相应大豆蛋白的标准物质,用于定性及定量分析,可拓展该方法的广泛应用,基于此原理可同时进行其他肉类食品的大豆蛋白含量及其他植物蛋白的鉴别。该研究为掺假检测提供了思路,可以同其他技术相互补充,在食品真伪鉴别领域具有广阔的市场应用前景。

