人脐带间充质干细胞来源的外泌体促进小鼠成骨前体细胞增殖与分化
王 丽,段翠密,原芳芳,王 燕,郭希民,郭红延
骨折或者骨缺损愈合需要较漫长的钙化和改建过程,给患者带来巨大痛苦,降低患者生活质量,加速骨折愈合成为中外学者关注的焦点问题。间充质干细胞(mesenchymal stem cells,MSC)来源的外泌体是一种纳米级囊泡样小体,直径为40~100 nm,并含有大量的细胞因子和生长因子,可通过转运特异性蛋白、脂质、mRNA和miRNA等生物活性物质,参与细胞及内环境之间的物质运输和信号传递[1]。近期有研究发现,骨髓来源的外泌体可以促进成骨细胞的增殖与分化[2],然而骨髓MSC的提取过程复杂,具有侵入性,感染概率高,不利于外泌体的大规模生产。因此,从产后废弃组织中提取干细胞成为首选[3],hucMSCs来源丰富、免疫原性低、无伦理道德争议、倍增时间短、扩增能力强,便于进行商品化生产。
在对hucMSC-exo的研究中发现其具备hucMSC的大部分优势且无致瘤[4]。目前,还没有关于hucMSC-Exos对成骨细胞生物学行为影响的报道。因此,本研究从细胞条件培养液中提取并鉴定hucMSC-exo,通过体外细胞实验观察hucMSC-exo对mOPCs增殖与分化的影响,以期为未来hucMSC-exo在骨修复领域的应用提供实验依据。
1 材料与方法
1.1 试剂和仪器 胎牛血清、α-MEM(Gibco,美国);BCA蛋白定量检测试剂盒(Thermo Fisher,美国);地塞米松、维生素C、β-磷酸甘油钠、油红干粉(Sigma,美国);成软骨诱导培养液(Cyagen,中国);碱性磷酸酶染色试剂盒(上海迈基,中国);CCK-8(同仁,日本);Anti-CD9抗体(Millipore,美国);Anti-CD63抗体(Affinity Biosciences,美国);超速离心机(Beckman Optima TM L-100XP,美国);电泳仪(Bio-Rad,美国);倒置显微镜(Nikon,日本)。
1.2 实验动物 健康新生24 h内C57BL/6乳鼠及3周龄C57BL/6小鼠(SPF级),购自北京维通利华实验动物技术有限公司,饲养于解放军军事医学科学院SPF动物实验室。
1.3 方法
1.3.1 mOPCs的分离培养 按照贴壁法分离培养原代mOPCs[5]。将健康新生24 h内的C57BL/6乳鼠浸泡于75%乙醇中,进行皮肤消毒,5 min后取出,脱颈处死,无菌条件下取出小鼠颅骨,去除其周围组织并尽可能地剪碎,加入0.25%的胰酶及0.1%的胶原酶消化20 min后,用等量的完全培养液终止消化,1000 r/min,离心5 min后,用含10%胎牛血清的α-MEM培养液吹散,将碎骨片铺于直径10 cm的培养皿中,于37℃、5%CO2条件下培养5~7 d,于第3天更换培养液,之后隔天更换培养液,全程避免骨片移位,待细胞融合达到70%~80%时传代,并进行传代稳定性观察。
1.3.2 hucMSCs的体外分离培养与鉴定 人脐带来源于解放军总医院妇产科,产妇及家属知情同意。按照Koh等[6]方法提取hucMSC,即无菌留取健康产妇剖宫产脐带,生理盐水洗净,用青霉素、链霉素双抗浸泡,去包膜、脐动脉、脐静脉,将华通氏胶剪碎,贴壁培养,待大部分细胞爬出,瓶底长满细胞,进行换液、传代,观察细胞生长状况。取第3代hucMSCs以1×105细胞/孔接种于含10%FBS的α-MEM培养液的6孔板中,待细胞融合至60%时,分别进行成骨、成脂及成软骨诱导。(1)hucMSCs的体外成骨分化及鉴定:细胞融合至60%时,改用成骨诱导培养液(含有10%FBS,0.1 μM地塞米松,10 mMβ-甘油磷酸酯和50 μg/ml抗坏血酸的α-MEM培养液),间隔3 d换液一次。14 d后,将细胞固定,冯·科萨染色观察。(2)hucMSCs的体外成脂分化及鉴定:细胞融合至60%时,改用成脂诱导培养液(含有1 μM地塞米松,0.5 mM 1-甲基-3-异丁基黄嘌呤,100 μM吲哚美辛和10 μM胰岛素的α-MEM培养液),14 d后,进行油红O染色评估。(3)hucMSCs的体外成软骨分化及鉴定:取处于对数生长期的4到9代hucMSCs,传代后取2×105个细胞在15 ml离心管内以800 r/min离心5 min,细胞会在离心管底部形成小球,轻柔地吸掉上清液,换用成软骨诱导培养液(以α-MEM为基础培养液,添加6.25 μg/ml胰岛素、6.25 μg/ml转铁蛋白、10 ng/ml转化生长因子β1、0.1 μmol/L地塞米松、50 μg/ml维生素C、5%胎牛血清)进行培养,间隔3 d换液1次,21 d后将细胞固定,石蜡包埋切片后进行HE染色以及免疫组化法测定软骨组织特异性Ⅱ型胶原。
1.3.3 hucMSC-exo的分离与鉴定 按照Zhang等[7]所述方法提取外泌体,即取3~8代融合至80%的hucMSCs,以不含血清的α-MEM培养液饥饿处理,48 h后收集上清,1000 r/min离心10 min,去除细胞和细胞碎片,收集上清并通过0.22 μm的滤膜过滤以去除大于220 nm的囊泡颗粒。于4 ℃环境下,34 288 r/min离心80 min收集外泌体并储存于-80℃,备用。使用BCA蛋白检测试剂盒(Thermo Fisher Scientific)测定外泌体蛋白含量。通过透射电子显微镜(TEM,HITACHI,H-7650)观察外泌体的形态。RIPA裂解液裂解hucMSC-exo通过Western blot鉴定外泌体特征性标志物CD9和CD63。
1.3.4 mOPCs增殖实验 细胞分组 对照组为mOPCs培养于5%FBS的α-MEM培养液;5 μg/ml hucMSC-exo实验组为mOPCs培养于含有5 μg/ml的外泌体、5%FBS的α-MEM培养液;10 μg/ml hucMSC-exo实验组为mOPCs培养于含有10 μg/ml的外泌体、5%FBS的α-MEM培养液。将P2代mOPCs以2×103个细胞/孔的密度接种于96孔板中,每组4个复孔,加入各组相对应的培养液,常规培养,间隔2 d换液,分别于1、3、5、7 d经CCK-8试剂盒测定450 nm处吸光度值,并绘制生长曲线。
1.3.5 碱性磷酸酶活性测定 将mOPCs以1×104个细胞/孔接种于24孔板,分组同上,每组3个复孔,加入对应培养液,常规培养7 d,弃上清,PBS洗涤3次,按照碱性磷酸酶检测试剂盒说明书进行染色,利用IMAGE J软件对染色结果进行半定量分析。
1.3.6 茜素红染色 将mOPCs以1×105个细胞/孔接种于12孔板,分组同上,每组3个复孔,加入各组相对应的培养液,常规培养21 d,各组细胞用4%多聚甲醛液固定10 min后,PBS洗涤3次,茜素红染色30 min,蒸馏水清洗,观察拍照。加入10%氯化十六烷基吡啶溶解1 h,吸取悬液,测562 nm处A值。

2 结 果
2.1 mOPCs的分离培养 原代培养mOPCs,骨片贴壁48 h后有大量细胞从骨片爬出,体积较小,胞体饱满,突起较短,细胞增殖较快,细胞汇合后传代培养(图1A)。传代后细胞以梭形为主,细胞呈半透明状,轮廓清晰,旋涡状生长(图1B和图1C)。

图1 mOPCs的分离培养(100×)
2.2 hucMSCs体外分离培养和鉴定 原代hucMSCs体外培养7 d,可见细胞贴壁呈梭形,半透明状,轮廓清晰,部分聚集成簇,呈旋涡状生长(图2A)。多向分化结果显示,hucMSCs体外成骨诱导培养14 d时,冯·科萨染色显示矿化结节形成(图2B)。成脂诱导培养28 d后,油红O染色见胞浆中出现圆形或椭圆形红色串珠状脂滴(图2C)。成软骨分化21 d后,HE染色可见组织团块内细胞分布较均匀,细胞外基质较为丰富(图2D),阿尔辛蓝染色可见淡蓝色的软骨基质成分(图2E),免疫组化染色显示细胞外基质中可见弥漫分布的Ⅱ型胶原(图2F)。

图2 hucMSCs分离培养与鉴定
A. hucMSCs原代培养;B. 冯·科萨染色;C. 油红O染色;D. HE染色;E. 阿尔辛蓝染色;F. Ⅱ型胶原染色
2.3 hucMSC-exo的分离与鉴定结果 透射电镜下可见外泌体呈椭圆形、圆形,膜结构完整,对3个样品的多个视野进行粒径分析显示,粒径大小为(80.0±32.5)nm(图3A)。Western blot的分析结果显示外泌体的特征性标志物CD9和CD63阳性表达(图3B),符合文献[8]报道的外泌体的生物学特性和鉴定标准,说明成功分离获得了hucMSC-exo。
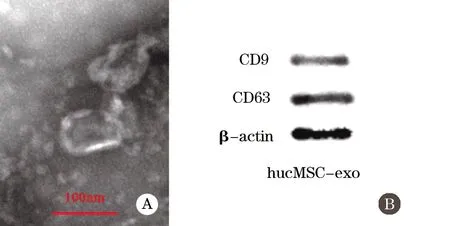
图3 hucMSCs-exo的鉴定
2.4 hucMSC-exo促进mOPCs增殖 CCK8结果显示实验组和对照组相比,在3、5、7 d时,添加hucMSC-exo(5 μg/ml,10 μg/ml)的实验组其mOPCs的增殖数量明显增加,且随着外泌体浓度的增高,增殖越明显,呈现剂量依赖性(图4)。
2.5 hucMSC-exo促进mOPCs的成骨分化 碱性磷酸酶活性染色结果显示,mOPCs培养7 d后,镜下观察可见添加hucMSC-exo实验组会有大量棕色硫化钴颗粒沉积于胞质中(图5),碱性磷酸酶活性显著高于空白对照组,且酶的此种活性效应随着外泌体浓度的增加而增大,表现出明显的剂量依赖性。IMAGE J软件半定量分析结果显示,5 μg/ml和10 μg/ml hucMSC-exo实验组与空白对照组比较,差异有统计学意义(P<0.001,表1)。
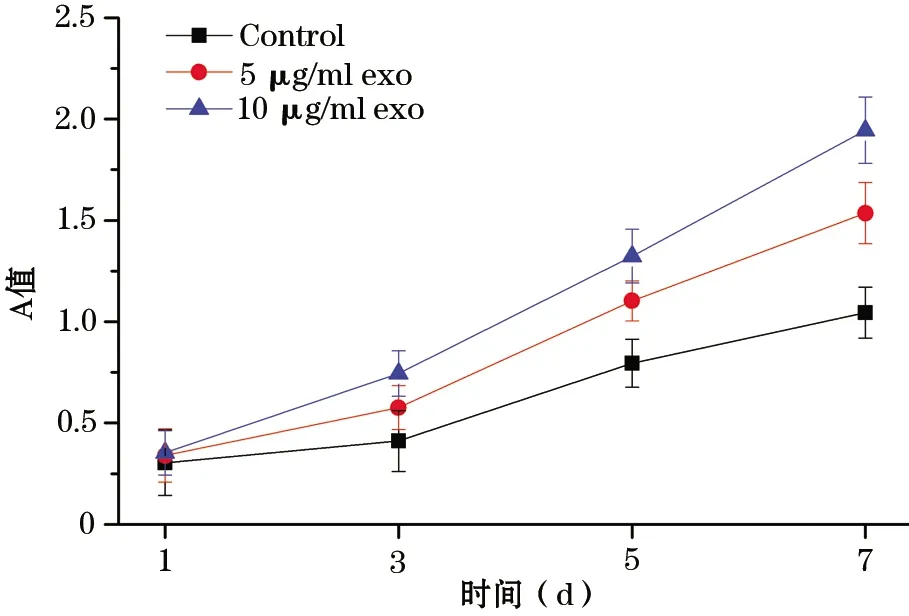
图4 hucMSC-exo对mOPCs增殖的影响

图5 hucMSC-exo刺激mOPCs后ALP染色(400×)

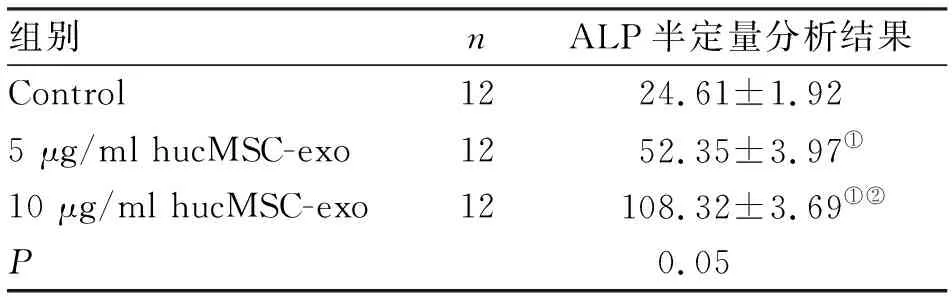
组别nALP半定量分析结果Control1224.61±1.925 μg/ml hucMSC-exo1252.35±3.97①10 μg/ml hucMSC-exo12108.32±3.69①②P0.05
注:与Control组相比,①P<0.05;与5 μg/ml hucMSC-exo组相比,②P<0.05
茜素红染色结果显示(图6),mOPCs培养21 d后,镜下观察可见添加hucMSC-exo实验组能够分泌出更多的矿化基质,有大量的钙化结节形成,空白对照组则形成较少,茜素红染色定量结果显示空白对照组A562为0.324,5 μg/ml和10 μg/ml的hucMSC-exo实验组A562分别为1.352和1.87,均高于对照组,且此种钙化结节的形成随着外泌体浓度的增加而增大,亦表现出明显的剂量依赖性。

图6 hucMSC-exo刺激mOPCs后茜素红染色结果(100×)
3 讨 论
据报道,MSC疗法可促进骨再生和骨折愈合[9, 10]。以往的研究证明,MSC疗法在损伤修复过程中可以触发细胞、细胞外基质以及信号分子之间的相互作用。但是,迄今为止尚未完全阐明这种作用的发生机制。在众多潜在的分子机制中,MSC释放的外泌体被认为是至关重要的,并引起了越来越多的关注[11, 12]。Narayanan等[13]发现人骨髓基质细胞来源的外泌体可触发未分化的人骨髓基质细胞成骨分化,Qin等[14]经体内体外实验研究证明BMSC衍生的外泌体可以通过增强成骨基因的表达来调控成骨细胞分化。与众多的MSC相比,hucMSCs来源于产后废弃组织,来源广泛,无伦理道德争议,分离方法简单、产量高、增殖快,易于大规模生产,Todeschi等[15]研究发现hucMSCs的骨修复作用与干细胞通过旁分泌作用调节靶细胞功能有关,但他们无法证实外源性干细胞与内源性祖细胞之间是否发生了细胞间串扰。我们目前的研究提供了第一个有力的证据,表明外源性干细胞可以通过产生外泌体与mOPCs进行对话,并对其生物学行为产生影响。
本实验通过低温超速离心法获得较纯的外泌体,电镜下呈杯托状,大小多集中在90 nm处,并且能表达CD9和CD63标志性表面蛋白,符合外泌体的生物学特性和鉴定标准[16]。将hucMSC-exo与mOPCs复合培养,进行细胞增殖实验,结果显示hucMSC-exo可以明显促进mOPCs的增殖,且此种增殖效应随着时间和剂量的增加而增加,表现出显著的时间依赖性和剂量依赖性。碱性磷酸酶活性水平是mOPCs早期成骨分化的重要评价指标[17],在hucMSC-exo刺激下培养7 d,mOPCs表现出更高的碱性磷酸酶活性。分化成熟的mOPCs会进一步产生矿化结节,是mOPCs成熟期成骨分化的重要指标之一,在hucMSC-exo刺激下mOPCs培养21 d,可见更多的钙结节形成,且随着剂量增大而增加,亦表现出明显的剂量依赖性。
综上所述,本实验从体外验证了hucMSC-exo可以促进mOPCs的增殖以及提高其成骨分化能力,提示在未来研究中可考虑直接使用hucMSC-exo进行骨损伤治疗,以期取代间充质干细胞,实现“无细胞再生医学”[18],但目前,对干细胞源外泌体的研究仍处于临床前期,有诸多问题阻碍其临床应用,有待深入阐明,例如,如何大量富集、纯化、标记外泌体,如何根据外泌体半衰期制定合适的给药途径及给药频次,如何提高治疗靶向性等[19, 20]。此外,hucMSC-exo中含有miRNA、mRNA、IncRNA及蛋白质等多种生物活性分子,其作用很可能与这些生物活性分子有关,但具体由哪一种或者由哪几种活性物质,以何种方式起作用尚不清楚,在未来研究中还需进一步阐明。

