成人斯蒂尔病继发肝损害的临床分析
尹玉峰,付梦真,何觅春,武 剑,郭雨凡
(苏州大学附属第一医院风湿免疫科,江苏 苏州 215006)
成人斯蒂尔病(adult onset Still's disease,AOSD)是一种相对少见的全身性自身炎性疾病,该疾病由Eric Bywaters于1971年首次描述[1],其病因及发病机制至今尚未完全明确。AOSD的发病率在1~34 人/百万人口,女性患病率相对较多,且发病年龄具有“双峰”特点,即高发年龄分别为15~25 岁和35~45 岁,极少数患者年龄大于60 岁。该病发病急骤,临床表现也具有极大的个体差异性,主要症状包括高热、皮疹、白细胞明显增多、关节炎,以及肝、脾、淋巴结肿大等。尽管AOSD具有自限倾向,因该疾病常多数反复发作,并且常由于继发感染、激素不良反应、严重肝功能损害、甚至噬血细胞综合征(HLH)等原因,导致部分患者的预后较差。文献报道显示,有43%~76%的AOSD患者伴有不同程度肝损害,其中主要为轻中度肝损害[2]。然而,仍有少数AOSD患者合并重度肝损害,这些患者如不及时诊断及治疗,常导致爆发性肝炎或肝衰竭,甚至危及生命。本研究拟对我科收治的57 例AOSD患者的住院资料进行肝损害以及治疗预后的相关分析以期辅益临床。
1 资料与方法
1.1 临床资料 收集我院2013年1月—2019年10月确诊为AOSD的57 例住院患者的病例资料。所有病例均符合1992年日本成人斯蒂尔病研究委员会提出的Yamaguchi分类标准[3]。所有诊断均除外肿瘤、感染及其它结缔组织病。纳入的患者中男性11 例(19.3%),女性46 例(80.7%);平均年龄(38.4±14.2)岁;病程定义为首次出现症状至首次就诊的时间,平均病程(13.2±26.3)个月。同时,选取63 例同期入住我科的类风湿关节炎(RA)患者作为对照,其中男性12 例(19.0%),女性51 例(81.0%),平均年龄(59.6±11.1)岁,平均病程(21.1±19.6)个月,所有RA患者均为初诊初治患者。上述指标在AOSD及RA两组患者之间差异无统计学意义(均P>0.05)。
1.2 AOSD肝损害标准 参考国内AOSD肝损害诊断标准[4-5],本研究中,对于确诊AOSD的患者,在除外病毒性、药物性、溶血性、酒精性肝损伤以及肝胆肿瘤等因素导致的肝脏损害的基础上,满足以下5 项实验室指标中2 项或2 项以上者,考虑患者存在继发性肝损害:(1)丙氨酸氨基转移酶(ALT)>40 U/L,(2)天门冬氨酸氨基转移酶(AST)>35 U/L,(3)碱性磷酸酶(ALP)>135 U/L,(4)γ-谷氨酰转肽酶(GGT)>45 IU/L,(5)总胆红素(TBIL)>22 μmol/L。分析时采用患者诊断AOSD时的最近一次肝功能检查结果。另外,如果患者ALT或AST大于5倍正常上限(分别为200 U/L及175 U/L),ALP大于1.5倍正常上限(203 U/L),TBIL大于2倍正常上限(44 μmol/L),或患者出现明显黄疸、肝性脑病,或凝血酶原时间在治疗过程中降低50%以上者,定义为重度肝损害。
1.3 观察指标 对所有纳入的57 例AOSD患者的一般情况、临床表现及体征、实验室检查,尤其是肝损害相关临床表现与治疗,分析总结AOSD导致肝损害的特点以及治疗预后。
1.4 统计学分析 计量资料以均数±标准差(±s)方式表示,计数资料采用例数及百分率形式表示。两组间计量资料的比较采用独立样本t检验,百分率的比较采用χ2检验或Fisher确切概率法,其他可能导致肝损害原因(主要包括非甾体抗炎药、免疫抑制剂、抗生素)与肝损害的相关性采用Logistic回归分析。应用SPSS 23.0统计学软件进行统计分析,设定P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料 所有纳入的57 例AOSD患者中,继发肝损害的患者25 例(43.9%),无肝损害的患者32 例(56.1%)。肝损害组女性患者19 例(76.0%),年龄19~68 岁,平均年龄(36.4±11.7)岁;病程1~72 个月,平均病程(10.5±22.3)个月,均有发热,发病时体温38℃~40℃,平均体温(39.3±0.6)℃,上述指标在肝损害组与无肝损害组之间差异无统计学意义(P>0.05)。肝损害组患者有关节痛18 例(72.0%),低于无肝损害组的30例(93.8%)(P=0.034)。其余皮疹、咽痛、淋巴结肿大、脾肿大、浆膜腔积液、白细胞、中性粒细胞计数、血沉、C反应蛋白及铁蛋白等在两组之间差异均无统计学意义(均P>0.05)(表1)
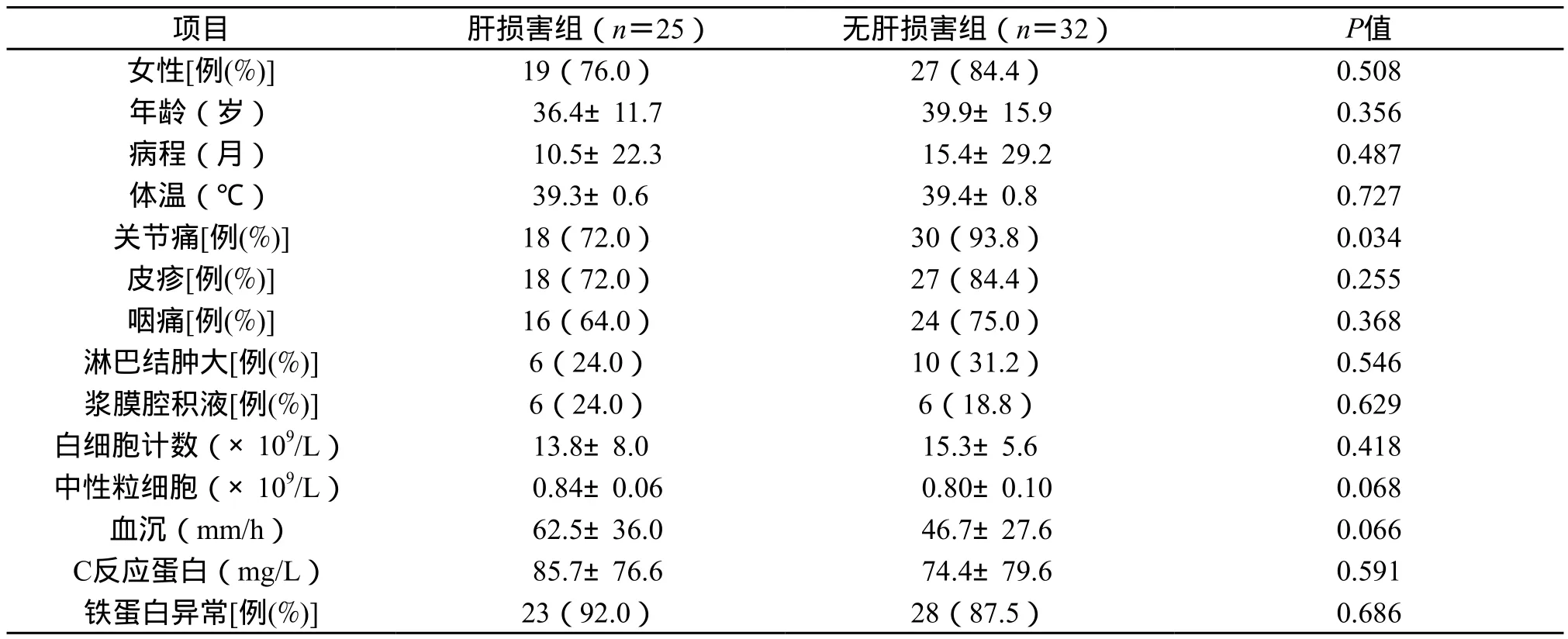
表1 AOSD患者肝损害与无肝损害患者比较Tab.1 The comparison of clinical features between AOSD with and without liver damage
另外,所有57 例患者中,使用非甾体抗炎药21例、免疫抑制剂43 例、抗生素12 例,Logistic回归分析结果提示,治疗药物的使用均与肝损害无明显相关性(P>0.05)。结合患者的临床经过,均支持肝损害主要与AOSD活动有关。
2.2 实验室检查 所有纳入的57 例AOSD患者中,肝功能检查提示ALT为(103.1±200.9)U/L,AST为(57.9±92.0)U/L,ALP为(95.7±50.9)U/L,GGT为(94.3±140.4)U/L,TBIL为(11.2±10.5)μmol/L。与同期入住我科的63 例RA患者比较,AOSD继发肝损害的发生率显著高于RA患者(43.9% vs 14.3%,P<0.05)。其中,所有纳入的AOSD患者中AST和ALP水平显著高于RA患者,而血清ALT、GGT和TBIL水平在两者之间差异并无统计学意义(P>0.05)。(表2)
表2 AOSD与RA肝功能比较(±s)Tab.2 Comparison of liver function between AOSD and RA
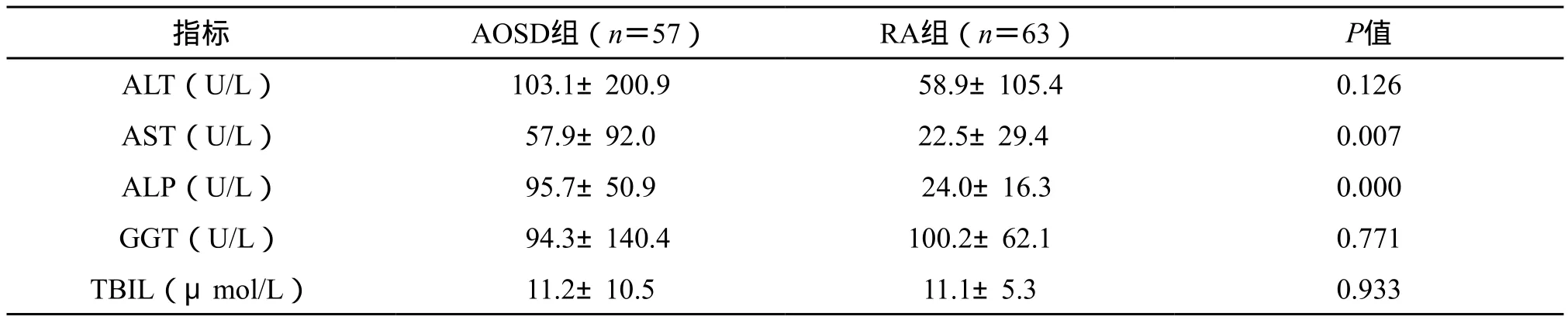
表2 AOSD与RA肝功能比较(±s)Tab.2 Comparison of liver function between AOSD and RA
指标 AOSD组(n=57) RA组(n=63) P值ALT(U/L) 103.1±200.9 58.9±105.4 0.126 AST(U/L) 57.9±92.0 22.5±29.4 0.007 ALP(U/L) 95.7±50.9 24.0±16.3 0.000 GGT(U/L) 94.3±140.4 100.2±62.1 0.771 TBIL(μmol/L) 11.2±10.5 11.1±5.3 0.933
2.3 肝损害临床表现 25 例肝损害患者中,轻、中度肝损害患者22 例(22/25,88.0%),出现肝损害相关临床症状5 例(其中黄疸2 例、呕吐1 例、纳差或腹痛2 例),腹部超声提示脾脏肿大患者8 例。重度肝损害患者3 例(3/25,12.0%),出现肝损害临床症状3 例(其中黄疸1 例、呕吐1 例、纳差或腹痛1 例),腹部超声提示脾脏肿大患者3 例。其余患者无明显皮肤黄染及消化道症状。
2.4 治疗与转归 25 例AOSD肝损害的患者在明确诊断后,均予以规范的糖皮质激素治疗,轻中度肝损害者予糖皮质激素0.5~1.0 mg/(kg·d),重度肝损害患者予糖皮质激素1.0~2.0 mg/(kg·d),所有患者均予口服或静脉保肝药治疗。22 例轻、中度肝损害患者,经过治疗后症状及肝功能指标均明显改善,顺利出院。3 例重度肝损患者中,2 例患者均以高热为首发症状(体温39.5 ℃以上)入院。其中2 例高热患者予激素治疗后症状一过性好转,后再次复发。相关检查提示2 例患者均存在脾脏肿大、高甘油三酯血症及低纤维蛋白原血症,肝酶较入院前明显增高,以及血清铁蛋白较前明显升高;其中1 例查血细胞减少(主要为血红蛋白及血小板计数)、血清可溶性CD25升高、血清NK细胞活性正常、骨髓活检提示检出噬血细胞,排除感染及药物等因素后,此2 例患者均符合2004年HLH诊断标准[6]。治疗上予甲强龙2 mg/(kg·d),静脉丙种球蛋白4 mg/(kg·d)及小剂量VP-16(100 mg)等积极治疗原发病,患者病情好转,铁蛋白、细胞因子及肝酶等较前明显减低。另1 例患者,予激素1.5 mg/(kg·d)治疗后病情好转,激素减量过程中再次出现高热,相关检查提示血小板减少,铁蛋白、AST及甘油三酯等明显增高等,诊断HLH可能。但患者拒绝行骨髓穿刺等有创检查。激素加量至4 mg/(kg·d)及静脉丙种球蛋白,患者体温明显减低,但铁蛋白及肝酶等无明显减低,患者自行出院,失访。
3 讨论
AOSD是一种自身炎症性疾病,以往称为“变态反应性亚败血症”。该病多见于青年人,目前被认为是一种介于风湿热和幼年型类风湿关节炎(JRA)之间的一种变性疾病,或认为是JRA的一种变异型。肝损害在AOSD患者中并不少见,主要表现为轻、中度氨基转移酶及ALP活性增高或肝脏肿大等。但仍有少数患者继发暴发性和致命性肝炎,以及HLH,甚至导致患者死亡[6]。因此,肝损害是AOSD危及生命的主要并发症之一,应给予足够的重视。
我们的结果提示,AOSD患者中肝损害的发生率较高(25/57,43.9%),尤其以轻、中度肝损害为主(20/25,80.0%),患者常常无典型的临床表现;而重度肝损害发生率相对较低(5/25,20.0%)。我们的这一结果高于Cagatay等[7]的发现(肝损害发生率36%),但低于Gerfaud等[8]及Chen等[9]研究结果(肝损害发生率54%~76%),重度肝损害与上述结果类似。此类肝损害患者多以肝细胞损害为主,胆汁淤积并不明显,这也与以往研究结果一致[8-9]。考虑到本研究中,少数患者外院已进行相应治疗,其肝酶较初次发病时可能有所减低。因此,实际上的肝损害的发生率可能高于上述结果。在肝损害的患者中,出现胃肠道症状患者较少,且腹部超声未见明显肝脏肿大患者,多数患者为常规检查时发现肝酶增高明显。另一方面,与同期入住我科的RA患者比较,AOSD患者肝损害发生率、肝酶水平(主要为ALT、AST和ALP等)等均显著高于RA患者。另外,我们的Logistic回归分析结果显示,其他可能导致肝损害原因(主要包括非甾体抗炎药、免疫抑制剂、抗生素等)与本研究的肝损害患者均无明显相关性,提示肝损害主要与AOSD活动有关。
AOSD的发病机制目前尚不十分明确,一般认为与遗传、病毒或细菌感染及自身免疫异常有关,这些免疫异常主要包括细胞因子介导的炎症反应和细胞凋亡的紊乱等[10]。在AOSD的发生发展过程中,天然免疫介导的炎症和巨噬细胞的过度活化被认为是最为重要的致病因素。过度活化的巨噬细胞内炎症小体过度激活,表达大量的IL-1、IL-18、IL-6及TNF-α等炎症因子,形成“炎症因子瀑布(cascade)”,是参与AOSD炎症反应的主要效应细胞[11]。另有最新的研究提示,低密度中性粒细胞(LDGs)以及中性粒细胞胞外诱捕网(NETs)的形成,在促进炎症反应和巨噬细胞过度活化的过程中也起到关键作用[12]。AOSD导致重度肝损害的机制亦尚不完全清楚。目前的研究认为,上述细胞因子的产生和巨噬细胞持续活化,可导致肝细胞的溶解性坏死,最终导致急性肝损害。此类患者的肝活检提示,肝脏组织中存在大量淋巴细胞、浆细胞和多形核细胞的浸润,导致干细胞的大量坏死,临床表现为进行性肝功能不全。我科前期研究也发现,中性粒细胞/淋巴细胞比值(NLR)在AOSD患者显著高于健康对照,且与患者血沉、CRP、铁蛋白等炎症指标以及ALP等肝损害指标呈正相关,这些结果均提示中性粒细胞在AOSD以及肝损害的发生发展中起到重要作用[13]。
在Yamaguchi分类标准等目前应用较多的AOSD常用诊断标准中均包括肝功能不全,提示肝损害是该病的典型临床表现之一。尽管与AOSD相关的肝功能障碍的严重程度通常较轻,肝组织活检亦没有特异性组织学表现。然而,在少数严重的病例中,肝组织活检常可见肝小叶中心区域的小块、亚大规模坏死[14]。因此,及时诊断及积极治疗常常是改善预后的关键。目前AOSD暂无固定的治疗方案,主要应用药物有糖皮质激素、免疫抑制剂及非甾体抗炎药等三种,对于常规治疗效果不佳的患者可予以IL-6受体拮抗剂等靶向药物治疗。另外,临床上需强调个体化治疗,在治疗原发病的基础上,积极缓解症状和预防并发症,并预防复发为主要治疗原则。但重度肝损害的患者,往往继发HLH等严重并发症。本研究纳入的3 例重度肝损害患者中,初期均不符合HLH诊断,其中2 例逐渐演变成HLH,予大剂量激素治疗无效,按照相关诊疗指南[15]应用VP16等药物治疗后缓解;另外1 例患者也考虑HLH可能,常规激素及静脉丙种球蛋白治疗效果不佳,但患者拒绝进行进一步检查以明确诊断,因此未能针对性调整药物,该患者预后较差。
综上所述,AOSD患者中肝损害的发生率较高,少数患者可继发重度肝损害。临床实践中,AOSD患者一旦出现重度肝损害的表现,特别是常规激素反应不佳者,应高度警惕HLH等严重并发症的可能,积极诊断及针对性治疗能极大地改善患者预后。

