A2M、A1PI、MMPs水平与肺部感染合并肺不张患者的相关性及临床意义*
王 攀,曹益瑞,王红玉,达 力
(成都市温江区人民医院重症医学科,四川成都 611130)
肺不张是肺组织塌陷导致的肺容量减少,可根据病例生理机制划分为阻塞或非阻塞型肺不张,也可根据肺容量划分,还可根据发生位置分为肺叶、节段或压段肺不张[1-2]。其中阻塞型肺不张为气道堵塞,非阻塞型肺不张是实质压迫导致表面活性物质功能障碍,可能由气道内(异物或黏液栓)、从壁(肿瘤,常见于鳞状细胞癌)或从外部(淋巴结、结节、顶骨和内脏胸膜之间失去接触等)压迫引起[2-3]。细菌、病毒、真菌等引起的肺部感染,引发患者痰量增多和痰液性状改变,严重或疏于治疗者可能因吸入性损伤引发误吸和气道内分泌物增加导致肺不张[4-5]。目前,关于患者体内α2-巨球蛋白(A2M)、α1-蛋白酶抑制物(A1PI)和血清基质金属蛋白酶(MMPs)等指标变化的研究较少,且少有阐述单纯肺部感染患者与合并肺不张患者之间上述指标差异的研究。故本研究分析了上述指标在肺部感染合并肺不张患者体内的水平变化,旨在为该病的临床诊断和治疗提供参考。
1 资料与方法
1.1一般资料 选取2018年1-12月于本院就诊的患者100例作为研究组,男63例,女37例,平均年龄(56.33±10.18)岁;选取同期本院就诊的肺部感染患者45例作为对照组,男26例,女19例,平均年龄(55.71±9.46)岁;体检健康者100例作为健康对照组,男61例,女39例,平均年龄(57.16±8.51)岁。各组人群性别构成和年龄比较,差异无统计学意义(P>0.05)。肺部感染诊断标准:临床表现、胸部X线片和气道内分泌物培养结果符合肺部感染诊断标准[6]。肺不张诊断标准[7-8]:(1)影像学可有气管向患侧移位(单侧肺不张)和(或)患侧肋间隙变窄;(2)胸部X线片可有局部组织密度均匀增高,肺叶体积缩小,组织均质毛玻璃状;(3)CT检查有体积缩小伴片状密度升高,叶间胸膜移位;(4)纤维支气管镜检查可有支气管黏膜增厚、充血或水肿,无组织坏死和结节样或息肉样或菜花样改变。研究组纳入标准:(1)诊断为肺部感染合并肺不张[6-8];(2)临床资料齐全;(3)年满18岁;(4)对治疗所用药物无过敏反应。对照组纳入标准:(1)胸部X线片或CT诊断为肺部感染;(2)年满18岁;(3)对治疗所用药物无过敏反应。健康对照组纳入标准:(1)年满18岁;(2)无肺部感染;(3)无肺不张。3组排除标准:(1)1个月内肺部感染合并肺不张治疗史;(2)有肺部手术史;(3)除肺部感染外,其他因素导致的肺不张(如外力压迫、肿瘤等);(4)肿瘤;(5)免疫系统功能障碍;(6)非自愿参与研究。本研究在本院伦理委员会监督下进行并取得全部参与人员及其家属同意。
1.2方法 于检测日早晨8:00前,抽取研究对象外周静脉血5 mL,4 ℃下2 000 r/min离心10 min,取上清后-20 ℃保存待测。血清A2M使用免疫比浊法检测,血清A1PI使用酶联免疫吸附测定检测,MMPs(包括MMP-1、MMP-2和MMP-9)使用化学发光法检测,全部操作按照试剂盒(购自美国RD公司)说明书操作。均先制作标准曲线,A2M检测:2 μL血样与试剂盒中250 μL试剂1混合,37 ℃水浴10 min后加入85 μL试剂2,同样条件下水浴,后读取吸光度(A)700值。A1PI检测:在血样中加入抗体,洗涤后加入特异性抗原试剂,再洗涤后加入特异性酶标抗体,洗涤后显色,读取A405值。MMPs检测:先提取血样中的总蛋白,检测其总蛋白后进行聚丙烯酰胺凝胶电泳,转膜后依次加入一抗和二抗,化学发光显影定影后凝胶图像分析。利用肺部感染评分[9]对研究组和对照组患者进行肺部疾病程度分级,其中评分≤6分者判定为轻度,>6~10分为中度,>10分为重度。上述全部操作由同一组熟练的操作人员完成。
研究组患者全部采取常规治疗,包括给予吸氧、吸痰和体位引流,同时根据患者情况给予抗感染药物,疗程1个月。

2 结 果
2.1研究组与对照组临床资料比较 2组肺部感染严重程度、肺部感染原因等资料比较,差异无统计学意义(P>0.05),见表1。
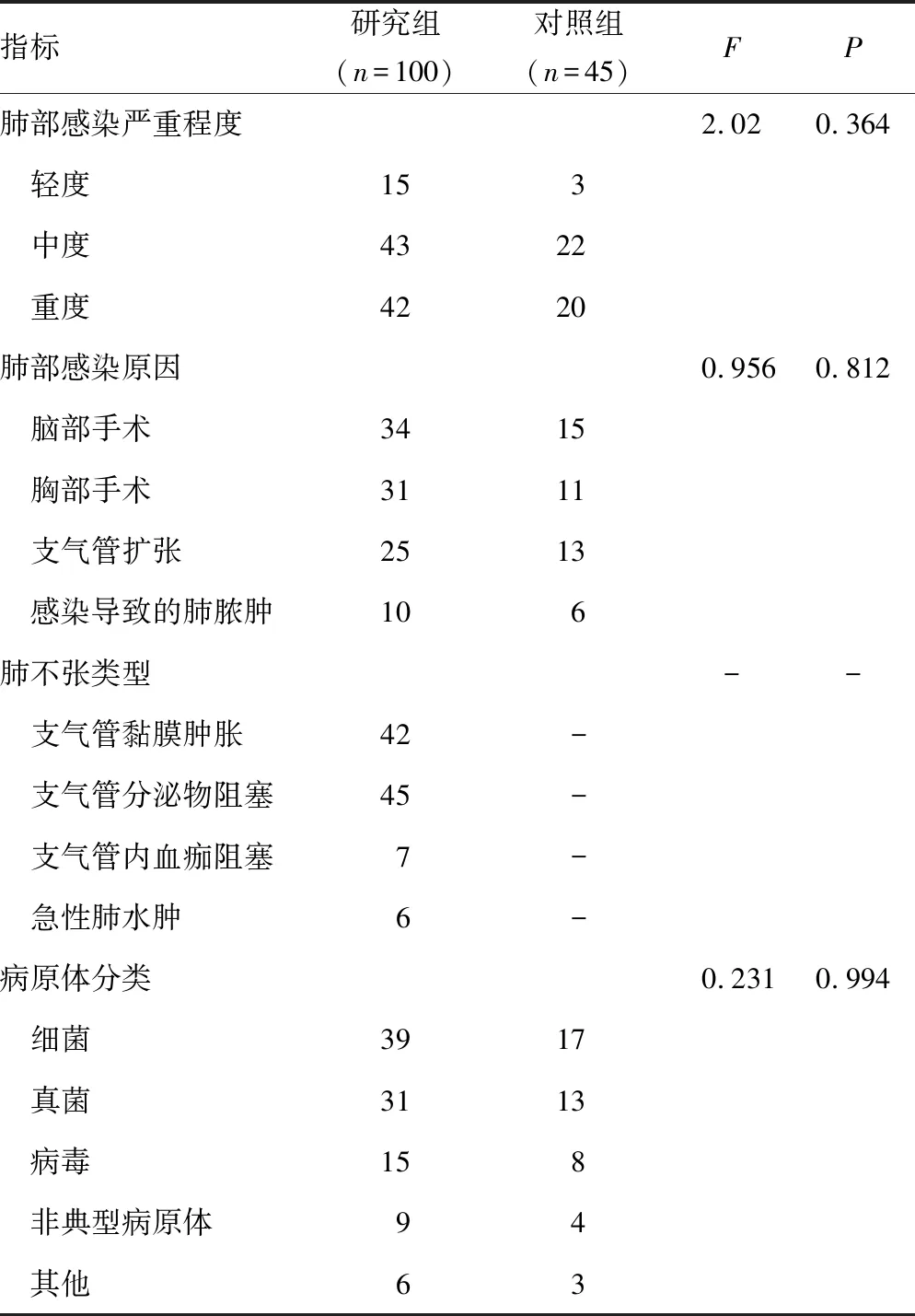
表1 研究组与对照组临床资料比较(n)
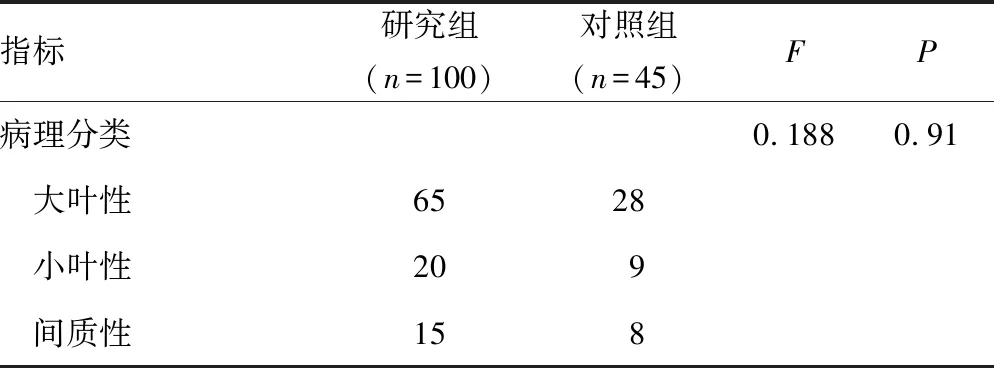
续表1 研究组与对照组临床资料比较(n)
注:-表示此项无数据。
2.23组A2M、A1PI和MMPs水平比较 研究组A2M、A1PI、MMP-1和MMP-2水平均明显高于对照组和健康对照组(P<0.05),其中对照组各指标水平均明显高于健康对照组(P<0.05),见表2。
2.3研究组和对照组不同疾病程度患者A2M、A1PI和MMPs水平比较 2组患者随着肺部疾病严重程度增加,A1PI和MMPs水平逐步升高(P<0.05),对照组各感染程度患者间A2M水平差异无统计学意义(P>0.05),而研究组差异有统计学意义(P<0.05),对照组各疾病程度患者各指标水平均明显低于同程度研究组(P<0.05),见表3。
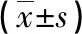
表2 3组A2M、A1PI和MMPs水平比较
注:与研究组相比,aP<0.05;与对照组相比,bP<0.05。
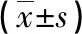
表3 研究组和对照组不同疾病程度患者A2M、A1PI和MMPs水平比较
注:与研究组轻度感染相比,aP<0.05;与研究组中度感染相比,bP<0.05;与研究组重度感染相比,cP<0.05;与对照组轻度感染相比,dP<0.05;与对照组中度感染相比,eP<0.05。
2.4治疗前、后研究组患者各指标水平比较 常规治疗后研究组各指标水平均明显下降(P<0.05),见表4。
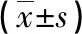
表4 治疗前、后研究组患者各指标水平比较
3 讨 论
近期报道显示,在支原体肺炎患者体内A2M和A1PI水平均明显升高,且可作为肺炎诊断的辅助指标[10]。因此,笔者推测,这二项指标在肺部感染患者中也表现异常。本研究结果验证了笔者的猜想,在研究组和对照组患者体内,A2M和A1PI水平相较于健康对照组的确异常增高,且合并肺不张患者(研究组)上述二项指标水平增高更明显。此外,研究表明A2M还能够通过吞噬细胞的上清道夫受体,与循环中活性形式的MMPs(MMP-2和MMP-9)结合并从中除去[11-12]。故笔者推测,A2M、MMP-1、MMP-2、MMP-9的水平变化具有同步性。检查肺部感染患者体内MMPs水平发现,MMP-1、MMP-2和MMP-9水平的确高于体检健康者,且与A2M变化趋势相同,在合并肺不张患者体内MMPs水平更高。LIU等[13]研究结果显示,A2M表达与MMPs相关联,且呈正相关,与本研究结果一致。将肺部感染患者根据病情进行划分,再次分析其体内上述各指标水平发现,轻度患者各指标水平明显低于中度和重度患者,而中度又明显低于重度患者,这说明随着疾病严重程度增加,各指标水平明显上升。同时,仅肺部感染各疾病程度患者体内上述各指标水平均低于合并肺不张患者,说明A2M、A1PI和MMPs可用来辅助区分体检健康者、仅肺部感染患者和肺部感染合并肺不张患者。此外,接受1个月治疗后,肺部感染合并肺不张患者各指标水平均趋于正常(未达到健康水平但均极低于治疗前)。这也能从侧面体现本文研究的三项指标可利用于表征肺部感染合并肺不张患者疾病情况。
在肺部感染过程中不免发生病理性变化,导致肺组织损伤,进而影响肺功能和(或)造成肺不张,在这一系列过程中,多种效应细胞和炎症因子均参与反应。A2M能够通过抑制纤溶酶和激肽释放酶以充当抗蛋白酶从而灭活多种蛋白酶,也可以作为载体蛋白发挥作用[14]。研究结果显示,在肺部感染患者体内,Toll样受体、白细胞介素等细胞因子的水平均异常增多[15],而A2M能够与多种细胞因子结合并影响其功能[10]。因而推测,在肺部感染患者体内A2M水平随着Toll样受体、白细胞介素等细胞因子和蛋白酶水平的升高而升高,以此在宿主抵御肺部感染中发挥重要作用;而这些效应细胞和炎症因子同时影响MMP的RNA表达,进而影响MMPs表达。另一方面,当机体发生病变而导致蛋白酶释放增加和病原体入侵机体释放外源性蛋白酶时,A2M会与之相结合并将其清除以达到组织免受损害的目的,而MMPs则因细胞外机制动态平衡的打破而与其抑制物水平失衡[16-17]。相对于单纯肺部感染患者,合并肺不张患者机体病变程度加剧,导致A2M水平升高并保护组织。在感染过程中,病毒基因编码需要蛋白酶作用以裂解发挥功能,而A1PI阻止这一过程发生从而使其不能发挥作用,故AIPI水平也反映疾病程度。
虽然本文探究了A2M、A1PI和MMPs在肺部感染合并肺不张患者体内表达情况,但由于部分患者临床资料缺失,没有分析A2M、A1PI等与动脉血气等指标之间的关系。下一步拟重新筛选患者资料,保留动脉血气数据完整的患者,分析A2M、A1PI等与肺功能参数、血氧饱和度等之间的关系,为临床初步判断这类患者肺功能受损程度提供依据。另外,上述疾病过程中的分子机制均根据既往文献报道推测而来,下一步需要建立模型验证。
4 结 论
综上所述,肺部感染合并肺不张患者血清A2M、A1PI和MMPs水平异常升高,随着病情加重,各指标水平显著增高,常规治疗后其水平趋于正常水平,可为临床肺部感染合并肺不张患者提供诊断依据。

