燕麦抗冻蛋白对面筋蛋白冻融稳定性的影响
张艳杰 张 垚 崔 悦 艾志录 毋修远
(河南农业大学食品科学技术学院1,郑州 450002) (农业农村部大宗粮食加工重点实验室; 河南省冷链食品工程技术研究中心2,郑州 450002) (江南大学食品学院3,无锡 214122)
随着世界食品工业的发展,冷冻食品逐渐成为潮流,冷冻技术具有便于贮藏、符合市场需求、能够标准化生产的优点,被广泛应用在食品保存中,其中冷冻面团也得到了迅速发展。冷冻面制品采用冷冻原理加工,降低了食品内部各种化学活动能量,不借助任何添加剂,抑制面食制品的老化,延长保质期[1],解决了面制品,如馒头、包子、面包等货架期短、易老化的问题,有着广阔的发展前景[2]。但是,冷冻面制品也存在许多问题,冻藏后面团酵母产气性的下降及面筋网络三维结构的破坏等会造成最终产品质量品质的降低,导致面制品,比如冷冻饺子、馄饨外皮有裂纹,面包体积缩小等问题,食用品质上表现为表皮脆化、失去弹性、口感变差等[3]。
小麦面筋蛋白是冷冻面制品中的重要影响因素,由决定面团延展性的醇溶蛋白和决定面团弹性的麦谷蛋白组成[4]。李雪红等[5]发现冻藏0~7 d小麦面筋蛋白的黏性、咀嚼度等变化较大,冻藏14~28 d弹性、回复性等变化较大;赵雷[6]发现随着冻藏时间的延长,小麦面筋蛋白的网络结构弱化、麦谷蛋白的热稳定性下降,其裂解温度的下降趋势与小麦面筋蛋白网络结构弱化的趋势一致;另外由于自由水含量的减少,引起浓缩反应,使蛋白质分子内和分子间二硫键交换反应增多[7]。Kennedy[8]研究发现冻融循环后的麦谷蛋白发生了解聚,导致了面筋结构的弱化。汪星星[9]研究发现,添加食品胶(CMC、黄原胶、K-卡拉胶)能够有效抑制小麦面筋蛋白的解聚及二级结构的变化。Ribotta等[10]研究发现冻藏过程中面团品质的下降,可能是谷蛋白由于冰晶的重结晶而发生了解聚行为。
抗冻蛋白(AFPs)又称热滞蛋白或冰结构蛋白,是一类具有提高生物抗冻能力的蛋白质类化合物的总称[11],具有非依数降低冰点、抑制重结晶、降低过冷却点、修饰冰晶形态等性质[12]。植物抗冻蛋白主要存在于寒冷、高海拔地区的植物体内[13]。Griffith等[14]首次提出并从冬黑麦质体外提取到了植物AFPs;费云标等[15]从冬季沙冬青叶片中分离出并纯化了抗冻糖蛋白;张峰等[16]采用浸出离心法从女贞叶中提取到了一种类似于沙冬青和黑麦的抗冻蛋白。
燕麦为禾本科植物,与小麦的生长期大致相同,是我国主要的高寒作物之一,但适应性与抗寒性更强。作者前期从冷诱导的燕麦籽粒中经过一系列的分离纯化步骤,得到电泳纯的燕麦抗冻蛋白(AsAFPs),热滞活性为1.24 ℃,通过MALDI-TOF-MS/MS法进行序列鉴定,并对其氨基酸组成、等电点及相对分子质量、二级结构及表面溶剂可及性等进行了预测和分析。结果表明:AsAFP的氨基酸序列为VSSVISSSLF EKMLLHRGFY TYDAFIAAAK SFPAFATTGS TDVRKREVAA FLAQTSHETT GGWPTAPDGP YELGSTSDYF GRGPIQISYN YNYGAAGKAI GVDLLRNPDL VTSDNTVEFK TALWFWMTPQ SPKPSSHDVI TGRWSPSSTD KAAGRVPGYG VLTNIIDGGV ECGKGQESHV ADRIGYYKDN LDCYNQKPFA,与Endochitinase具有最大匹配度;AsAFP具有高亲水性氨基酸残基比例;其理论等电点为6.08,相对分子质量为21 728.18;二级结构中含有大量的无规则结构,富含α-螺旋结构,且具有较高的表面溶剂可及性[17],与大麦籽粒抗冻蛋白特征相似[11]。植物AFPs由于其天然的来源,较其他食品添加剂有更大的优势,在冷冻食品的储藏、运输及解冻过程中抑制冰晶重结晶,对改善冷冻面制品的品质具有重要作用。因此,研究植物AFPs在冷冻面制品体系中的作用,探索其应用规律非常必要。本实验对燕麦抗冻蛋白(AsAFPs)对冻融循环后小麦面筋蛋白的持水率、持油性、乳化性和乳化稳定性、二级结构以及水分分布的影响进行研究,对深刻理解AsAFPs的作用机制提供参考。
1 材料与方法
1.1 主要实验材料
燕麦:市售;谷朊粉(小麦面筋蛋白);金龙鱼调和油。
1.2 主要试剂
磷酸氢二钠、磷酸二氢钠、乙二胺四乙酸、硝酸银、硫酸铵,均为分析纯。
1.3 主要仪器与设备
JJ-1型增力电动搅拌器;高速离心机;冷冻干燥机;高速分散器;高速粉碎机;傅里叶红外光谱仪;核磁共振仪;酸度计。
1.4 方法
1.4.1 燕麦抗冻蛋白(AsAFP)的提取
参照张艳杰[12]的方法,从燕麦籽粒中提取燕麦抗冻蛋白。挑选完整、健康的燕麦种子,将其储存到-18 ℃(至少4周)进行冷诱导。冷诱导后的燕麦籽粒浸泡在3倍体积预冷的PBS(50 mmol/L,pH7.4)中,搅拌一定时间,将燕麦籽粒与浸泡提取液固液分离。浸泡液在4 ℃,10 000 r/min条件下,离心30 min。50%~100%饱和度的硫酸铵沉淀上清液,盐析液在相同条件下离心,沉淀采用截留分子量为1 k的透析膜对PBS(5 mmol/L,pH 7.4)缓冲液透析至无SO42-检出,浓缩冻干,即为AsAFP粗蛋白。冻干粉复溶于5 mmol/L PBS(pH 7.4)中,上阴离子交换柱(Q Fast-Flow Ion Exchange Column)进行分离,根据洗脱曲线收集不同洗脱峰,脱盐冻干后检测各组分的THA活性。活性最高的组分复溶于5 mmol/L PBS(pH 7.4)中,继续使用阴离子交换柱(DEAE-Sepharose Fast-Flow column)进行梯度洗脱,分离后的组分按上述相同的方法脱盐冻干,检测各个组分的THA活性。活性最高的组分复溶于5 mmol/L PBS(pH 7.4)中,上凝胶色谱柱(Superdex 75 Gel-Filtration Column)进行分离。根据洗脱曲线收集不同洗脱峰,脱盐冻干后进行各个组分的THA活性测定,活性最强的组分即为AsAFP。
1.4.2 小麦面筋蛋白的冻融循环设计
将小麦面筋蛋白与水按照1∶1.5的比例进行混合,作为对照组;将AsAFPs、小麦面筋蛋白、水按照0.005∶1∶1.5的比例进行混合,作为AsAFPs组[18]。将制备好的湿面筋蛋白用保鲜膜包裹后放入冷冻盒并做好标记,然后将其放入-30 ℃冰箱中,1 h后迅速转移到-18 ℃中冻藏,2 d后取出小麦面筋蛋白放入4 ℃冰箱中解冻2 h,此为一次冻融循环。取出部分小麦面筋蛋白作为一次冻融样品,其余继续放入-18 ℃冻藏室进行冻藏。重复操作,共进行5次冻融循环。
1.4.3 干小麦面筋蛋白粉的制备
取出部分冻融循环后的小麦面筋蛋白进行冷冻干燥,2 d后取出,粉碎,过筛(100目),即得干小麦面筋蛋白粉。将其放入自封袋并做好标记后,放入干燥器中保存备用[19]。
1.4.4 小麦面筋蛋白功能性质的测定1.4.4.1 小麦面筋蛋白持水率的测定
冻融循环前,取出部分湿小麦面筋蛋白称重,记作m1;冻融循环后再次称重,记作m2[20]。然后用式(1)计算小麦面筋蛋白的持水率:
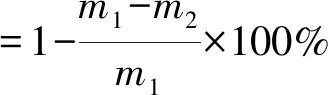
1.4.4.2 小麦面筋蛋白持油性的测定
参照柳小军[21]的方法进行测定。
1.4.4.3 小麦面筋蛋白乳化性和乳化稳定性的测定
参照柳小军[21]的方法进行测定。
1.4.4.4 小麦面筋蛋白二级结构的测定
干小麦面筋蛋白粉的二级结构采用傅里叶红外测定仪测定。测定参数:扫描范围400~4 000 cm-1;扫描32次,分辨率4 cm-1。结果利用Omnic 8.2和Peakfit 4.12软件对酰胺Ⅰ吸收峰(1 600~1 700 cm-1)进行处理,计算各子峰面积的占比[22]。
1.4.4.5 小麦面筋蛋白水分分布状态的测定
冻融循环后的小麦面筋蛋白在4 ℃冰箱中解冻2 h后,采用核磁共振仪测定其弛豫时间T2。测定参数:90 °脉冲时间P90=14 μs,180°脉冲时间 P180=35 μs,采样点数TD=67 022,主频 SW=200 kHz,模拟增益 RG1=20,模拟增益RG2=3,累加次数 NS=8,回波个数 NECH=1 000,回波时间 TE=0.335 ms[12]。
1.5 数据分析
用Excel 2010、SPSS 16.0对数据进行统计分析。
2 结果与分析
2.1 AsAFPs对冻融小麦面筋蛋白持水率和持油性的影响
由图1可知,随着冻融循环次数的增加,小麦面筋蛋白的持水率由92.8%下降到87.8%,这可能是因为在冻藏初期,水分子形成的冰核不稳定,易发生分散迁移[23],而随着冻藏时间的延长,冰晶逐渐增大,进一步破坏了面筋网络结构,导致水分部分散失,降低了持水能力[21];另外,在解冻和重新冻藏期间,水分停留的位置会发生新的变化,冰晶也会在新的位置形成,从而加剧了对小麦面筋蛋白的破坏,导致持水率的降低[21]。AsAFPs组小麦面筋蛋白的持水率下降程度低于对照组,说明AsAFPs对冻融循环中小麦面筋蛋白水分的流失有一定的减缓作用,这可能是因为AsAFPs能够降低冰晶对面筋网络结构的破坏,从而维持它的持水能力。谢新华等[22]的研究表明,添加1% γ-PGA时,小麦面筋蛋白持水率较对照提高了29%;李渊等[24]的研究表明,大麦β-葡聚糖(BBG)的添加量为1%时,小麦面筋蛋白持水率(1.64±0.03) g/g,显著高于对照组的(1.52±0.01) g/g,与本研究结果相似。
蛋白质存在一定的持油性,这是因为蛋白质的非极性区域与可以和脂质中的甘油三酯以疏水性作用形成蛋白质—脂质复合物。蛋白质中疏水键或者疏水基团的暴露程度是其持油性的主要因素,暴露程度越高,蛋白质的持油性越强[25]。
由图1可知,在冻融循环过程中,小麦面筋蛋白的持油性呈现上升趋势。这是因为冻融循环过程中小麦面筋蛋白体内的冰晶的变化导致小麦面筋蛋白的构象也发生了改变,使疏水基团的暴露程度升高,从而小麦面筋蛋白持油性上升[21]。AsAFPs组小麦面筋蛋白的持油性略低于对照组,这可能是因为AsAFPs作用于小麦面筋蛋白,抑制了重结晶现象,从而减少了疏水基团的暴露,促使持油性下降[26]。
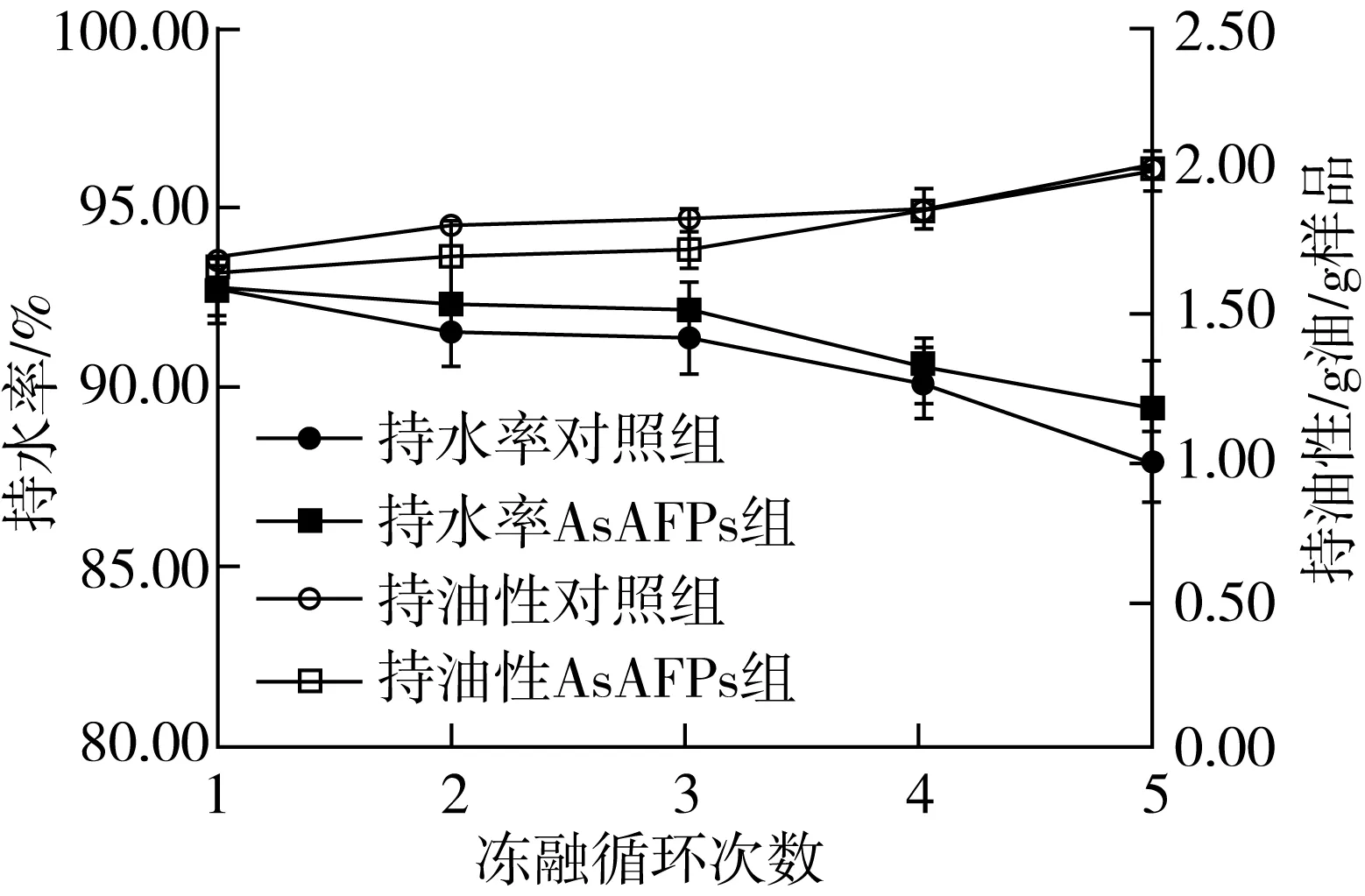
图1 AsAFPs对冻融小麦面筋蛋白持水率和持油性的影响
2.2 AsAFPs对冻融小麦面筋蛋白乳化性和乳化稳定性的影响
蛋白质的乳化性和乳化稳定性对食品的品质有一定的影响,它与蛋白质的自身结构、溶解度、表面疏水性、电荷情况、亲水-亲油平衡性等有关[27,28],蛋白质的溶解性越好,乳化性也越好。
由图2可知,小麦面筋蛋白在冻融循环过程中乳化性越来越差,而乳化稳定性的变化趋势则相反。这是由于在冻融循环过程中小麦面筋蛋白变性加剧,溶解度降低,从而小麦面筋蛋白的乳化性降低,然而小麦面筋蛋白变性使蛋白亲水-亲油平衡性更强,从而小麦面筋蛋白的乳化稳定性越来越好[21]。AsAFPs组的乳化性优于对照组,这是由于AsAFPs在一定程度上抑制了冰晶的重结晶,使小麦面筋蛋白的溶解度高于对照组,从而乳化性高于对照组。同时,AsAFPs的加入可能抑制了小麦面筋蛋白的变性,进一步使得乳化稳定性低于对照组。姬晓月[29]的研究表明,添加0.75%的γ-PGA时,小麦面筋蛋白的乳化性及乳化稳定性降至最低值,和对照组相比分别减少了32.4%、36.5%。
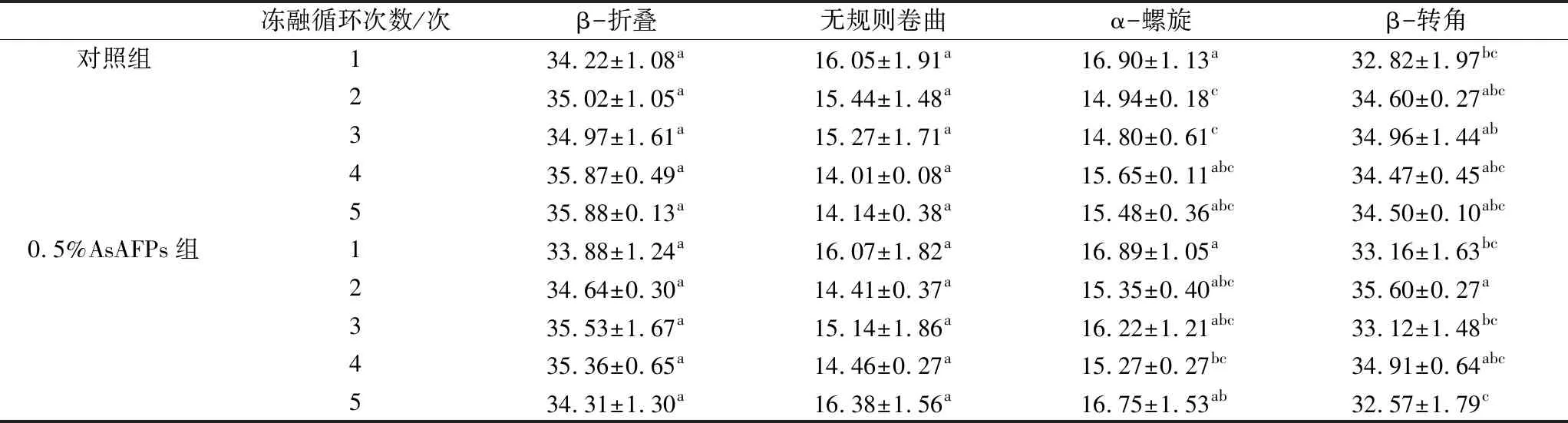
表1 AsAFPs对冻融小麦面筋蛋白二级结构的影响
注:平均值±标准差;同一列不同字母上标之间代表存在显著性差异(P<0.05),相同字母上标之间代表无显著性差异(P>0.05),下同。
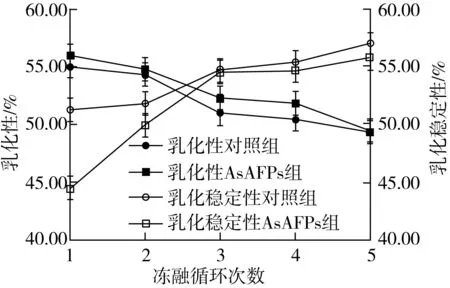
图2 AsAFPs对冻融小麦面筋蛋白乳化性和乳化稳定性的影响
2.3 AsAFPs对冻融小麦面筋蛋白二级结构的影响
由表1可知,冻融循环且添加AsAFPs前后,小麦面筋蛋白的二级结构均以 β-转角和β-折叠为主。经过冻融循环后,无规则卷曲、α-螺旋整体呈下降趋势,β-折叠和β-转角整体呈上升趋势。α-螺旋含量的减少,是因为随着冻融时间的延长,冰晶不断生长重结晶,导致α-螺旋氢键弯曲,结构遭到破坏,形成小分子物质[9,30]。同时在冻融循环过程中,蛋白质的亲水区域和疏水区域逐渐扩散,在新的区域出现新的分子交联,从而改变了蛋白质的二级结构[9]。相较于对照组来说,AsAFPs组无规则卷曲、α-螺旋的变化不明显。这是由于AsAFPs对于冰晶的修饰作用和重结晶的抑制作用可以有效抑制冻融循环对面筋结构的破坏[31]。
2.4 AsAFPs对冻融小麦面筋蛋白水分分布的影响
小麦面筋蛋白中水分子的存在状态为位于0.1~10 ms的强结合水和弱结合水(峰1)、位于10~100 ms的可冻结的自由水(峰2)[22]。
由表2可知,随着冻融循环次数的增加,小麦面筋蛋白的结合水含量逐渐减少,自由水含量逐渐增多,这说明在冻融循环过程中小麦面筋蛋白的结合水逐渐向自由水转变。与对照组相比,AsAFPs组小麦面筋蛋白结合水和自由水的含量变化幅度均小于对照组,这说明AsAFPs可以降低冻融循环过程中水分的流动性,减少水分的迁移[21]。
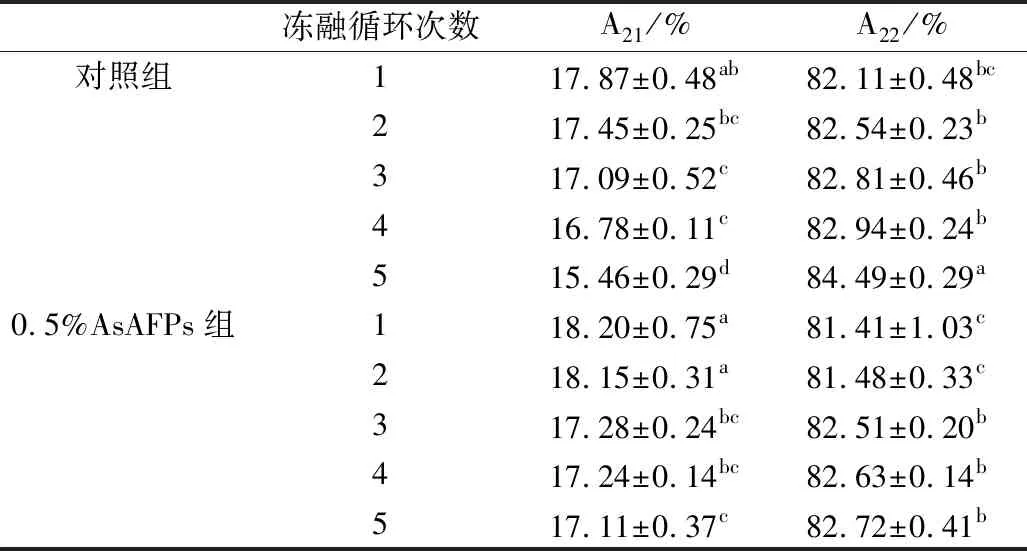
表2 AsAFPs对冻融小麦面筋蛋白水分分布的影响
注:A21、A22分别表示峰1的峰面积和峰2的峰面积占峰面积总和的百分比。
3 结论
AsAFPs的加入能够抑制冻融循环过程中水分的流失,减少疏水键的暴露,抑制冰晶的重结晶现象,减缓小麦面筋蛋白的持水率的下降,维持其持水能力;AsAFPs的添加影响了小麦面筋蛋白的构象和变性情况,减缓冻融处理对小麦面筋蛋白的持油性和乳化稳定性的改变;AsAFPs减缓了冻融过程中冰晶的破坏可能导致的对小麦面筋蛋白结构的伸展或聚集作用,使无规则卷曲、α-螺旋下降的幅度变小。

