南方地区樱桃砧木吉塞拉6号的组培快繁技术
张益,王琳,郑佳铌,王云冰*,洪莉,董军
(1.台州科技职业学院 农业与生物工程学院,浙江 台州 318020; 2.台州市农业科学研究院 果树研究所,浙江 台州 371000)
甜樱桃砧木吉塞拉6号产自德国,是酸樱桃与灰毛叶樱桃杂交培育的品种。吉塞拉系列甜樱桃砧木适应性广,矮化性强,表现突出,抗病能力强[1-2],但南方甜樱桃对气候有极其严格的要求,常规种植方式育苗速度慢,生长状况不够理想,难以满足市场需求。采用组织培养技术可有效解决育苗难的问题,已经有大量的樱桃或樱桃砧木建立了组培体系[3-5]。南方地区缺乏甜樱桃育苗技术,制约了甜樱桃产业发展的问题,为满足南方地区对甜樱桃种苗的迫切需求,本研究建立了一套适宜南方甜樱桃砧木吉塞拉6号组织培养快繁体系,现将研究结果报道如下。
1 材料与方法
1.1 材料
试验材料为台州市农业科学研究院的樱桃砧木吉塞拉6号,取其幼芽为外植体,幼芽取材时间为3月。
1.2 处理设计
1.2.1 外植体消毒
选晴朗天气摘取生长健壮、无病虫害的新生樱桃砧木吉塞拉6号的幼芽,采用1 000倍多菌灵溶液处理,并套袋保护15 d,剪下幼芽备用。选取饱满幼芽,在肥皂水中清理干净,用流水冲洗30 min以上;随后在无菌条件下,用75%乙醇溶液浸没幼芽,均匀晃动进行消毒,无菌水冲洗3~4次,每次约1 min,然后用0.1%的HgCl2溶液浸没幼芽均匀晃动进行消毒,再用无菌水冲洗3~4次,沥干备用。其中75%乙醇处理时间分别为30、45 s,0.1%的HgCl2溶液处理时间分别是6、8、10 min,具体处理为:T1,75%的乙醇30 s+0.1%的HgCl26 min;T2,75%的乙醇30 s+0.1%的HgCl28 min;T3,75%的乙醇30 s+0.1%的HgCl210 min;T4,75%的乙醇45 s+0.1%的HgCl26 min;T5,75%的乙醇45 s+0.1%的HgCl28 min;T6,75%的乙醇45 s+0.1%的HgCl210 min。
所有处理的外植体接种于MS+0.5 mg·L-16-BA+0.2 mg·L-1NAA+30 g·L-1蔗糖+6 g·L-1琼脂培养基上。每种处理15瓶,每瓶接种3株。10 d后统计污染率、褐化率和成活率。
1.2.2 培养基筛选
增殖培养以MS+30 g·L-1蔗糖+6 g·L-1琼脂为基础培养基,生根培养以1/2MS+蔗糖30 g·L-1+6 g·L-1琼脂为基础培养基,pH值为5.8,在不同生长时期添加不同含量的激素。
增殖培养:选取健壮、生长势良好的分化苗,接种到含不同激素的增殖培养基上进行继代培养。试验共设置6种增殖培养基,标记为T7~T12。各培养基均以MS为基础培养基,每个处理中NAA均为0.1 mg·L-1,T7~T9中KT为0 mg·L-1,6-BA分别为0.3、0.5、0.8 mg·L-1;T10~T12中,6-BA为0 mg·L-1,KT分别为0.3、0.5、0.8 mg·L-1。每种处理接种15瓶,每瓶接种3株。继代培养30 d,统计分化苗的增殖率、株高和生长状况。
生根培养:将株高约1.5~3.0 cm的健壮继代增殖苗转接到生根培养基中进行培养,试验设置6种生根培养基,标记为T13~T18。各培养基均以1/2MS为基础培养基,每个处理中IAA均为0.1 mg·L-1,T13~T15中IBA为0 mg·L-1,NAA分别为0.3、0.5、0.8 mg·L-1;T16~T18中NAA为0 mg·L-1,IBA分别为0.3、0.5、0.8 mg·L-1。每种处理接种15瓶,每瓶接种3株,放置培养室进行生根培养。生根培养30 d,统计瓶苗的生根长度、生根率和生长状况。
2 结果与分析
2.1 消毒处理方式的影响
消毒剂对植物试验材料有一定程度的伤害,消毒时间长,虽然污染率会降低,但是褐化率会升高。由表1可知,同种消毒剂消毒不同时间对吉塞拉6号生长影响也不同。75%乙醇溶液消毒45 s,吉塞拉6号的成活率低于消毒30 s;随着HgCl2处理时间的延长,污染率逐渐下降,成活率呈先增高后下降的趋势。综合考虑,以75%乙醇溶液30 s+0.1% HgCl2溶液8 min的消毒处理效果较好,成活率达90%。
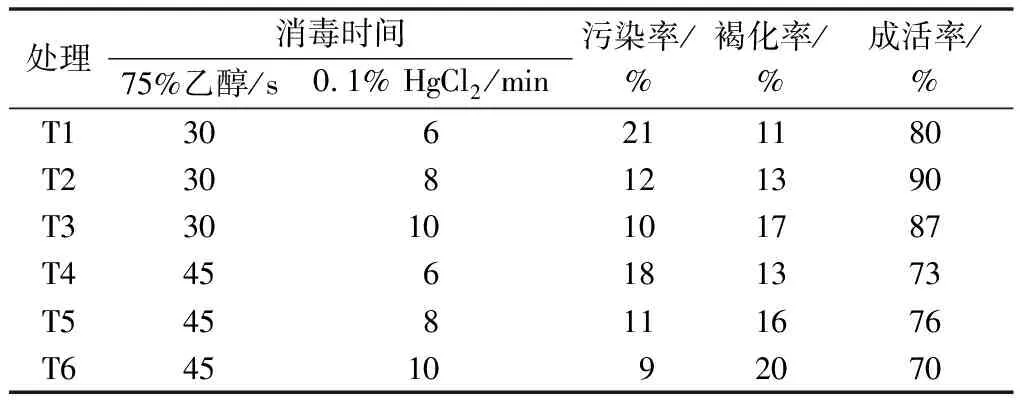
表1 消毒方式对外植体消毒效果的影响
2.2 增殖培养基的影响
表2数据表明:吉塞拉6号在T7、T12培养基中增殖率均较高,分别为90%、95%;T12培养基中的苗生长旺盛,叶片嫩绿;T9培养基的分化苗增殖率最低,且叶片生长不良,生长速度慢,还有过度水化现象发生,玻璃化比较严重。表明6-BA明显影响樱桃砧木的增殖,易导致培养材料玻璃化,KT不易产生玻璃化,是良好的替代品。综合考虑,增殖培养基以MS+0.8 mg·L-1KT+0.1 mg·L-1NAA为宜。

表2 不同增殖培养基对樱桃生长的影响
2.3 生根培养基的影响
表3表明,吉塞拉6号在T17、T18培养基中生根率较高,分别达93%和91%,T17培养基内的增殖苗生根速度快,一般7 d左右就有根长出,根长适宜,根系生长状况良好,粗细适中,根系白,须根较多;T14培养基生根率最低,长根速度慢甚至不长根。IBA比NAA生根效果略好,综合考虑,生根培养基以1/2MS+0.1 mg·L-1IAA+0.5 mg·L-1IBA为宜。

表3 不同生根培养基对樱桃生长的影响
3 小结
以75%乙醇溶液30 s+0.1% HgCl2溶液8 min消毒处理为宜,诱导成活率可达90%,且生长良好;增殖培养基以MS+0.8 mg·L-1KT+0.1 mg·L-1NAA为宜,增殖率达95%,该培养基内生长的分化苗健壮,生长旺盛;生根培养基以1/2MS+0.1 mg·L-1IAA+0.5 mg·L-1IBA为宜,生根率达93%。
消毒处理环节的消毒剂含量越高,污染率越低,褐化率越高,成活率越低。通过试验发现,增殖培养基中细胞分裂素6-BA含量越高,分化苗玻璃化程度越高,达到0.8 mg·L-1就会产生严重的玻璃化现象;同时加入KT,玻璃化症状消失,这与组培中植物激素种类影响玻璃化发生的理论基本一致。在生根试验中,各个激素的种类和配比至关重要,是影响植株能否成活的关键。本实验分化苗的须根不多,这还要考虑到各方面因素,如基础培养基的影响、是否需要添加活性炭和有机物、苗的生理状态,以及培养的环境条件等因素。

