粪便具核梭杆菌与clbA+大肠埃希菌DNA 检测在结直肠癌诊断中的价值
刘 艳,龙 吟,潘伟杰,张 通,翁文浩,俞 莹
(1.上海市第二康复医院检验科,上海 200431;2.上海市杨浦区中心医院检验科,上海 200090)
近年来,我国结直肠癌发病率呈逐年上升趋势,成为继肺癌、肝癌后居第3位的恶性肿瘤。我国2015年癌症统计数据表明,与2005年相比,我国大肠癌新发病例数和死亡例数均在10年间翻了一番,分别达到37.7万例和19.11万例[1]。此外,有近20%~25%的肠癌患者在初诊时发现伴有肝转移,且晚期肠癌患者生活质量很低,尽管使用各种昂贵的化疗及靶向药物,但其5年生存率仍仅为65%。因此,结直肠癌早查筛期生物标志物相关研究成为热点。近年来,肠道微生态与肠癌的关系正不断被揭示。有研究发现,clbA1+大肠埃希菌具有pks致病岛,并可产生大肠埃希菌素,而大肠埃希菌素可诱导宿主细胞DNA断裂、细胞衰老,促进分泌生长因子,使细胞增殖[2]。具核梭杆菌可在结肠、直肠中富集,与肠癌患者预后有关,可促进肠癌细胞增殖、转移和侵袭,并参与肿瘤细胞的免疫逃避、化疗药物抵抗等[3-5]。本研究拟检测粪便样本中clbA+大肠埃希菌及具核梭杆菌DNA相对表达量,同时结合临床诊断资料、粪便隐血试验(fecal occult blood test,FOBT)及血清癌胚抗原(carcinoembryonic antigen,CEA)检测结果,评价clbA+大肠埃希菌、具核梭杆菌潜在的临床应用价值。
1 材料和方法
1.1 研究对象
收集2017年12月—2019年1月上海市杨浦中心医院、上海市第二康复医院38例腺瘤患者、115例肠癌患者及58位体检健康者(健康对照组)粪便样本。腺瘤患者男20例、女18例,年龄(61±10)岁;肠癌患者男62例、女53例,年龄(60±11)岁,其中早期(Ⅰ~Ⅱ期)肠癌患者87例、晚期(Ⅲ~Ⅳ期)肠癌患者28例。健康对照者男31名、女27名,年龄(59±8)岁。健康对照者粪便性状正常,FOBT结果阴性;腺瘤及肠癌患者无消化道或全身炎症表现,未进行抗菌药物及化疗药物治疗,其粪便样本采集于手术前。
1.2 方法
1.2.1 DNA提取 采用粪便DNA抽提试剂盒(批号为DP328,北京天根生化科技有限公司),按说明书要求进行操作。抽提后DNA浓度及质量采用Nanodropone分光光度计(美国赛默飞世尔科技公司)进行分析,A260nm/A280nm比值应为1.7~1.9。
1.2.2 实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测 采用实时荧光定量PCR检测clbA+大肠埃希菌及具核梭杆菌DNA相对表达量。仪器为7900HT荧光定量PCR仪(美国ABI公司),试剂为TB Green qPCR Master Mix(货号639676,大连宝生物有限公司),按说明书要求配制反应缓冲液及DNA模板。PCR反应条件:预变性 95°C 30 s;变性95°C 10 s,退火/延伸60°C 35 s,45个循环。clbA+大肠埃希菌引物序列:上游引物为5'-AT GAGGATTGATATATTAATTGGACA-3',下游引物为5'-GGTTTGCCATATTTGCACGTAC-3'。具核梭杆菌引物序列:上游引物为5'-TTCAAT AAAAGTGGCAGGTCAAG-3',下游引物为5'-TAACAACACATGCAGGTCAATGG-3'。总细菌内参基因16SrDNA引物序列:上游引物为5'-CCATGAAGTCGGAATCGCTAG-3';下游引物为5'-GCTTGACGGGCGGTGT-3'。靶细菌DNA相对表达量采用2-ΔCt表示,ΔCt=Ct靶细菌序列-Ct16SrDNA。
1.3 统计学方法
采用GraphPad Prism及MedCalc软件进行统计分析。呈非正态分布的数据采用中位数(M)[四分位数(P25~P75)]表示,组间比较采用非参数Mann-WhitneyU检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价各项指标诊断及鉴别诊断肠癌的价值,采用χ2检验比较早、晚期肠癌患者各项指标阳性率的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 健康对照组、腺瘤组及肠癌组粪便clbA+大肠埃希菌及具核梭杆菌DNA相对表达量的比较
肠癌组粪便clbA+大肠埃希菌DNA相对表达量高于腺瘤组和健康对照组(P<0.01、P<0.0001)。健康对照组、腺瘤组、肠癌组粪便具核梭杆菌DNA相对表达量依次升高,各组间差异均有统计学意义(P<0.05)。
2.2 粪便clbA+大肠埃希菌及具核梭杆菌DNA相对表达量诊断诊断腺瘤和肠癌的效能
采用Logistic回归模型建立clbA+大肠埃希菌与具核梭杆菌联合检测的模型,诊断腺瘤的模型为Log(P腺瘤)=94.56447a+91.36771b-1.39321,诊断肠癌的模型为Log(P肠癌)=77.53525a+139.44605b-0.53603,式中a为clbA+大肠埃希菌DNA相对表达量,b为具核梭杆菌DNA相对表达量。ROC曲线分析结果显示,clbA+大肠埃希菌诊断腺瘤和肠癌的曲线下面积(area under curve,AUC)分别为0.672、0.712,诊断肠癌的最佳临界值为0.0033,敏感性为64.32%,特异性为65.52%;具核梭杆菌诊断腺瘤和肠癌的AUC分别为0.628、0.750,诊断肠癌的最佳临界值为0.0023,敏感性为80.87%,特异性为68.97%;联合检测诊断腺瘤和肠癌的AUC分别为0.723、0.761,诊断肠癌的最佳临界值为0.5378,敏感性为80.87%,特异性为67.17%。clbA+大肠埃希菌和具核梭杆菌单项检测及联合检测鉴别诊断腺瘤与肠癌的AUC分别为0.517、0.616、0.608。

表1 健康对照组、腺瘤组及肠癌组粪便clbA+大肠埃希菌及具核梭杆菌DNA相对表达量的比较 M(P25~P75)

图2 clbA+大肠埃希菌和具核梭杆菌的诊断效能
2.3 早期肠癌组、晚期肠癌组粪便clbA+大肠埃希菌DNA、粪便具核梭杆菌DNA及血清CEA、FOBT阳性率的比较
早期肠癌组、晚期肠癌组粪便clbA+大肠埃希菌DNA阳性率、粪便具核梭杆菌DNA阳性率、粪便clbA+大肠埃希菌DNA与具核梭杆菌DNA联合检测阳性率、FOBT阳性率差异均无统计学意义(P>0.05),晚期肠癌组血清CEA阳性率高于早期肠癌组(P<0.05)。早期肠癌组clbA+大肠埃希菌DNA及粪便具核梭杆菌DNA单项检测及联合检测的阳性率分别为75.7%、80.5%、81.6%,均高于FOBT及CEA的阳性率。见表2。
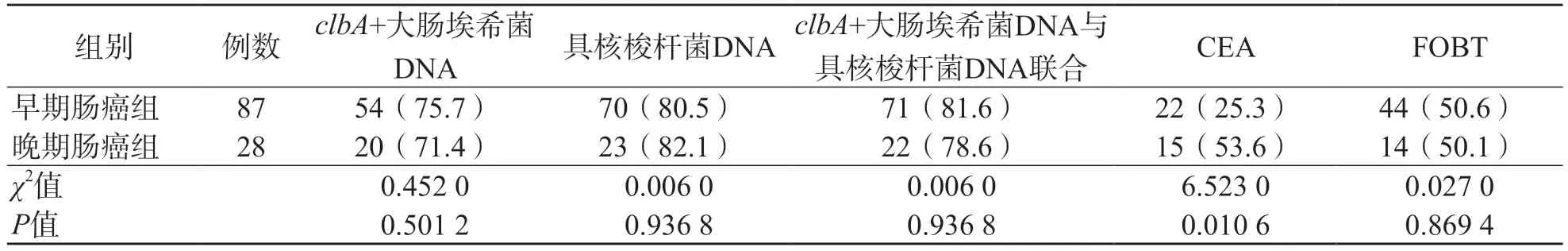
表2 早期肠癌组、晚期肠癌组粪便clbA+大肠埃希菌DNA、粪便具核梭杆菌DNA及血清CEA、FOBT阳性率的比较 例(%)
3 讨论
在大肠癌筛查的方法中,仅有FOBT和乙状结肠镜检查具有高级别的循证医学证据。FOBT是目前应用最为广泛的筛查方法,具有无创、价廉的优点,筛查敏感性为30%~80%[6]。乙状结肠镜主要用于观察远侧结肠的病变情况,敏感性为60%~70%[6]。多项临床研究结果证实,FOBT和乙状结肠镜检查对早期发现大肠癌,降低患者死亡率还不够理想[7-8]。尽管FOBT操作简单、成本低,但受多种因素影响,结果稳定性及敏感性均不理想,而乙状结肠镜检查为创伤性操作,患者依从性差[9-10]。因此,目前尚缺少高敏感性、低创伤性的实验室检查手段。
粪便微生物标志物检测具有诸多优点,如经济有效、无创伤、人群依从性好、留取样本简便等。此外,粪便微生物DNA稳定、提取方法成熟且简便。本研究以粪便具核梭杆菌与clbA+大肠埃希菌为研究靶点,初步探索了微生物标志物作为结直肠癌筛查工具的临床潜在应用价值。结果显示,健康对照者、腺瘤患者、肠癌患者具核梭杆菌和clbA+大肠埃希菌DNA相对表达量逐渐升高,诊断肠癌的敏感性分别为80.87%、64.32%,较文献报道的FOBT为30%~80%[6]、乙状结肠镜检查为60%~70%[6]有一定提高。此外,在早期肠癌中,具核梭杆菌和clbA+大肠埃希菌检测敏感性分别为80.5%、75.7%,而CEA为25.3%,FOBT为50.6%,表明粪便具核梭杆菌和clbA+大肠埃希菌作为肠癌早期筛查的生物标志物具有广阔的应用前景。
近年来,有学者提出肠癌发生的肠道微生态“驱动-被动”学说,该学说认为某些细菌具有致癌性,可驱动肠癌发生;而另一群细菌在肠癌发生过程中由于肠道内环境的变化,被动发生数量或组成的改变[11]。产肠杆菌素的大肠埃希菌可增加上皮细胞突变率[12],为肠癌的驱动菌,而在肠癌发生过程中,转化或肠癌细胞表面的Gal-GalNAc水平不断增加,具核梭杆菌可通过其菌体蛋白Fap2形成Fap2/Gal-GalNAc复合物,提示具核梭杆菌可能是肠癌病变过程中不断吸附的被动菌[13]。本研究发现clbA+大肠埃希菌及具核梭杆菌在腺瘤阶段即开始富集,在肠癌患者中的丰度最高,表明上述细菌与肠癌发生、发展密切相关,为其作为诊断标志物提供了理论依据。
本研究发现,clbA+大肠埃希菌不能很好地鉴别腺瘤与肠癌,而具核梭杆菌具有一定的鉴别能力。有研究发现,80%的腺瘤患者存在APC等关键基因突变[14],而clbA+大肠埃希菌含量很有可能在癌前病变阶段已增加,对基因突变起重要作用,因此clbA+大肠埃希菌DNA相对表达量不能地很好地区分腺瘤和肠癌患者。具核梭杆菌作为被动菌在肠癌进展时才富集,因此其相对表达量可能在肠癌中更高,能起到鉴别作用。尽管clbA+大肠埃希菌和具核酸杆菌鉴别腺瘤与肠癌的作用有限,但区别健康对照者与肠癌患者的敏感性较高,因此可作为筛查标志物。
综上所述,粪便具核梭杆菌和clbA+大肠埃希菌可作为潜在的结直肠癌无创性早期筛查生物标志物。通过检测“高危”微生物,可筛查出肠癌高风险人群。鉴于本研究样本数量有限,尚需多中心参与,以证实本研究结果。同时,随着下一代测序技术的普及应用,新型肠癌相关微生物标志物不断将被发现。

