亚热带联和水库理化因子及浮游植物分布特征*
蔡阳扬,唐常源,2,曹英杰
(1.中山大学环境科学与工程学院,广东 广州 510275; 2.中山大学地理科学与规划学院, 广东 广州 510275)
我国地源辽阔,长江以南地域属于亚热带地区。此处气候四季分明,该地区的水库有着独特的环境特征。受气温和光照强度影响,夏季亚热带水库水体在垂直方向上呈温度分层现象,表层温度较高,接近气温,底层温度较低,而中间则形成温跃层,从水动力的角度上将表底两层隔开[1]。而在冬季,表底层水体温度基本一致,温跃层消失,水体上下混合动力强烈。这种独特的水文条件同时影响着水体中物理和化学因子的分布,从而进一步影响浮游植物的生长和分布。
通常,亚热带水库水体中的氮浓度较高,而磷浓度相对较低。在夏季,这种较高的氮磷比率,适合的温度光照以及充足的溶解氧含量,适合蓝藻的生长。因此,我国南方亚热带水库中蓝藻的生物量不断增加,甚至爆发大规模的蓝藻水华,对其它水生生物及人类健康造成严重危害[2-3]。惠州联和水库位于中国南部广东省内,属于亚热带地区,其水环境变化具有亚热带水库典型特征。从2012年夏季开始,联和水库每年都会爆发微囊藻水华,给当地造成巨大的饮水危机和经济损失。
为了研究微囊藻水华爆发的原因和机制,全面开展对联和水库物理和化学因子的时空分布调查是十分必要的。同时,研究水体中浮游植物群落组成及其分布也有助于了解浮游植物优势种更替的原因。此外,过去的研究通常认为爆发水华的藻种是由上游水域通过地表径流到达水库,并在水库中大量生长所产生的。因此,为了探究这一说法的准确性,本文也对联和水库上游河流以及周围村庄池塘中的浮游植物群落组成进行了调查。本研究结果有助于进一步了解亚热带水库理化因子变化特征,以及对微囊藻水华爆发的机制和来源,对制定防治微囊藻水华提供一定的理论依据。
1 材料与方法
1.1 采样地点
联和水库位于广东省惠州市博罗县(23°17′57.2″N, 113°55′8.8″E),是一个亚热带海洋性季风气候的峡谷型水库(图1)。水库修建于20世纪70年代,集水面积110.8 km2,库容8.2 ×107m3,集饮用水源地、灌溉、发电和防洪等多功能于一体。水库周围被自然林和村庄包围。陆地水源经两条小河(河流M和河流K)流入水库。从2012年夏季起联和水库开始爆发微囊藻水华,引发饮水危机。
1.2 样品采集与分析
分别于2014年9月27日、11月30日、2015年1月13日、6月12日对联和水库及周边水体进行采样分析(图1)。其中,库区内设5个采样点(X1~ X5),岸上设置4个采样点(Y1~ Y4)。根据每个站位的深度,利用多参数水质仪(YSI-EXO2,美国)以及有机玻璃采水器进行不同深度的采样。

1.3 联和水库氮磷收支参数的计算
由于湿沉降中氮磷含量占大气沉降的87%以上[21-22],因此,我们将用湿沉降中氮磷含量代替大气沉降中氮磷总量。每月大气中氮磷含量计算如下。

图1 联和水库采样位置图Fig.1 Illustration of Lianhe Reservoir showing the location of sampling stations
(1)
(2)
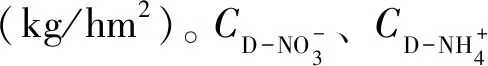
IDN=DN×S
(3)
IDP=DP×S
(4)
其中,S是水库的水平面积(3.3 km2)。
两条入库河流K和M分别经过Y1~Y4站位,因此,来自河流的氮磷含量计算公式如下:
(5)
(6)
其中,ISN和ISP分别是每月氮和磷经河流流入水库的含量(kg)。CK-TN和CK-TP分别是在河流K中总氮和总磷的平均质量浓度(mg/L)。CM-TN和CM-TP分别是河流M中总氮和总磷的平均质量浓度(mg/L)。IK和IM分别是河流K和M的月流量(m3)。
氮和磷从出水口流出水库的量为:
FON=CO-TN×O
(7)
FOP=CO-TP×O
(8)
其中,FON和FOP分别为每月从水库流出的氮和磷总量(kg)。CO-TN和CO-TP代表了X5站位总氮和总磷的质量浓度(mg/L)。O表示了水库每月的流出量(m3)。因此,联和水库从2014年9月到2015年8月的氮和磷收支状况计算公式为:
(9)
(10)
其中,RN和RP分别是氮和磷在这一年中滞留于水库的总量(kg)。

河流水库管理处在河流M和河流K入库处及水库出水口均设置自动采样器,所采集的样品用于估算河流入库和水库出库氮磷的量。样品中总氮和总磷的检测根据国家水质标准方法(GB3838-2002)测定,并对每月的样品质量浓度取平均值作为当月总氮和总磷的质量浓度。河流入库量及水库排水流出量均由水库管理处提供。
1.4 数据处理与分析
采用SigmaPlot 12.0制作环境因子的分布特征图。显著性差异及相关性分析采用SPSS 19.0完成。
2 结 果
2.1 水动力条件
水库所在地区月平均气温变化在13.7~ 30.2 ℃。其中,12月气温最低,7月气温最高(图2)。一年之中有9个月的气温都高于20 ℃。该地区的雨季从4月持续到9月,旱季从10月到次年3月(图2)。其中最高月降雨量出现在5月(0.840 m),最低降雨量在10月(0.001 m)。从图2可以得知,夏季水库水位高于冬季水位,这取决于降雨量及对下游的供水需求。8月水位最高,为53.9 m;4月水位最低,为44.7 m。
水库最深处X3站位在夏季(9月)和冬季(1月)的流速和流向具有显著差异(表1)。9月份5~10 m的流速变化为(5.7~7.4)×10-2m/s,在23 m处的流速为8.7 ×10-2m/s;在0.5~ 5 m处的流向变化为108.9°~ 75.2°,在20~ 23 m处流向则变为90°~ 201.0°之间。但是在15 m处流速降为3.0 ×10-2m/s,流向为123.0°,这表示夏季在垂直方向上水库中间水体相对静止,形成一个屏障将上下水体分为两个相对独立的循环系统。而在冬季(1月),流速变化范围为(2.0~11.5)×10-2m/s,远高于9月份的流速。同时,不同深度的流向大致一致,均指向西北方向。因此,在冬季水库整个水体在垂直方向上混合完全。
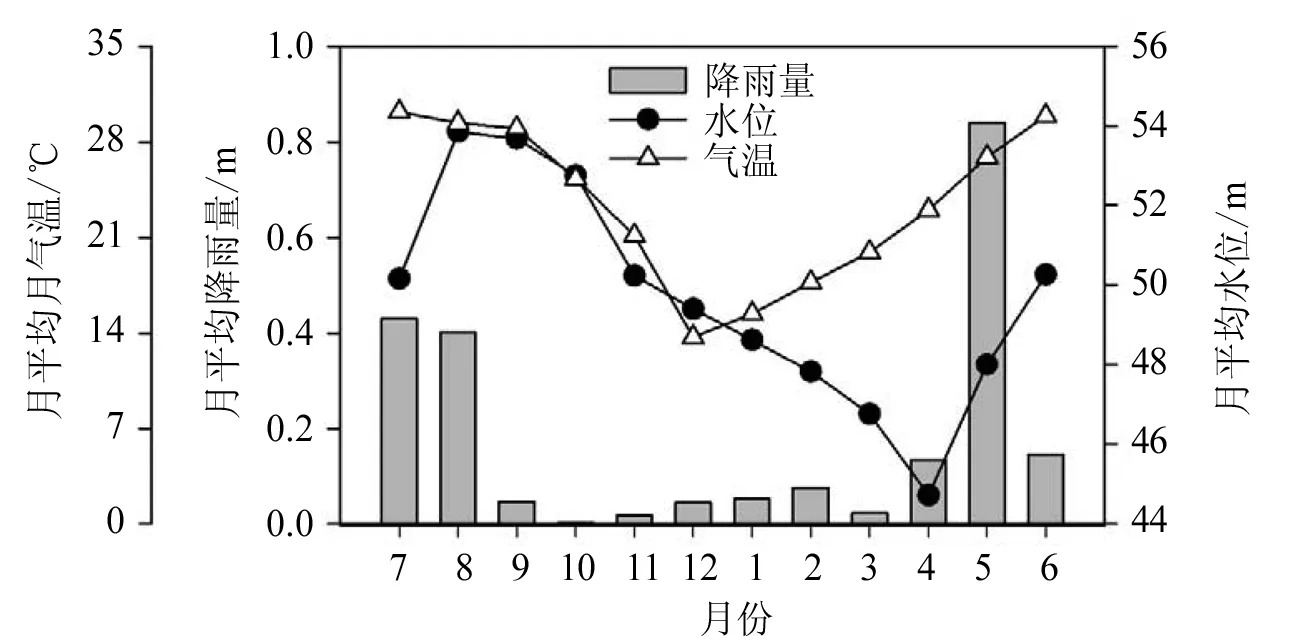
图2 月平均气温、降雨量和水位变化图Fig.2 Variation of mean monthly air temperature (hollow triangles), mean monthly rainfall (shaded columnar), and water level (solid circles) in Lianhe Reservoir

表1 联和水库X3站位在热分层(9月)和混合(1月)时期的水体流速和流向的垂直变化1)Table 1 Vertical profile of flow velocities and flow direction at station X3 in Lianhe Reservoir during thermal stratification (September) and mixing (January) periods
1) The values are mean±S.D.(n=2)
2.2 透明度
不同季节的水体透明度(SDD)被用来表征光照透过水体所到达的最深处(表2)。SDD均值在2014年9月最高(1.75 m),在2015年1月最低(0.99 m)。9月,X4和X5站位的SDD均值均约为2.50 m,表明夏季(9月)水体透明度较高,透光性良好,适合浮游植物的生长。

表2 联和水库各站位水体的透明度1)Table 2 Secchi disk depth of water column at stations X1, X2, X3, X4 and X5 in Lianhe Reservoir from September 2014 to June 2015
1)The values are mean±S.D.(n=2)
2.3 热分层过程
从X3和X5站位的水温(WT)垂直剖面图(图3)可知,水体温度分层从4月开始,一直持续到12月,这段时期被成为热分层期。此时整个水柱可垂直分为三层(图4):表层(深度为0~ 12 m),受气温影响强烈;温跃层(深度为12~18 m),以及水温较冷的底层(18~ 30 m)。根据流速和流向结果,这三层水体系统相对独立(图4)。然而在1月至3月,由于水体垂直混合明显,水温较低且基本均匀。此时期成为混合期。因此,我们把每年4月至12月时间段称为热分层时期,1月至3月称为混合时期。
2.4 浮游植物
叶绿素a(Chl a)可用于指示浮游植物生物量。叶绿素a质量浓度从3月份开始持续增长,在6月到达最大值,变化范围为5.45~ 21.9 μg/L(图3)。与其它站位相比,坝前X5站位的叶绿素a质量浓度最高。在热分层时期,表层叶绿素a质量浓度显著大于温跃层和底层质量浓度,表明受温度和光照影响,表层水体最适合浮游植物生长。
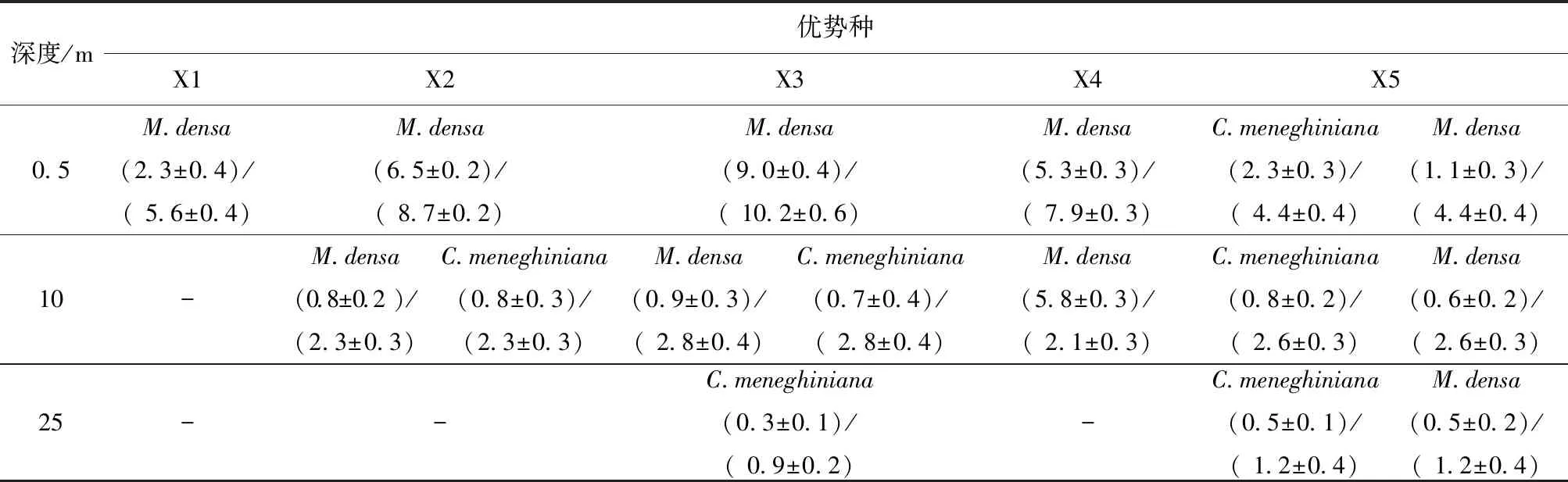
在热分层和混合时期,分别检测出60和55种浮游植物种类(表3)。其中,混合时期梅尼小环藻(Cyclotellameneghiniana)的最大细胞密度为(4.7±0.3)×106cells/L ,浮游植物总细胞密度最大值为(8.0±0.7)×106cells/L(表4),梅尼小环藻细胞密度占浮游植物总细胞密度约60%,远远大于其它藻类的细胞密度(P< 0.05),因此可以认为梅尼小环藻为混合时期的优势种。而在热分层时期,密集微囊藻(Microcystisdensa)的最大细胞密度为(9.0±0.4)×107cells/L,浮游植物总细胞密度最大值为(1.0±0.6)×108cells/L(表5),密集微囊藻细胞密度占浮游植物总细胞密度约90%,其密度显著大于其它藻类的密度,密集微囊藻为热分层时期的优势种。
在混合期,除X5站位20 m深处有一定数量的密集微囊藻存在外,整个水柱的浮游植物优势种均为梅尼小环藻(表4)。然而,在热分层时期,表层水中浮游植物群落由密集微囊藻主导,温跃层附近优势种为密集微囊藻和梅尼小环藻,底层水体的优势种则变为梅尼小环藻(X5站位除外),这表明优势种的变更主要受水温影响(表5)。在X5站位中,整个水柱的优势种都由梅尼小环藻和密集微囊藻共同承担,这可能是由于X5站位靠近取水口,垂直水动力强烈。可见,优势种的变更除了水温,还受水动力的影响。
岸上水体中浮游植物优势种及细胞密度如表6所示。Y3站位在3月和6月的优势种及浮游植物总细胞密度分别约为(1.6±0.2)×107cells/L(3月)、(3.2±0.8)×106cells/L(6月)和(4.8±0.7)×107cells/L(3月)、(9.2±0.9)×106cells/L(6月),均显著高于其它站位(P< 0.05)。岸上的藻种分析显示,密集微囊藻并未在岸上河流及池塘水体中检测到,表明爆发水华的藻种并非来自岸上,而是来自库区本身。
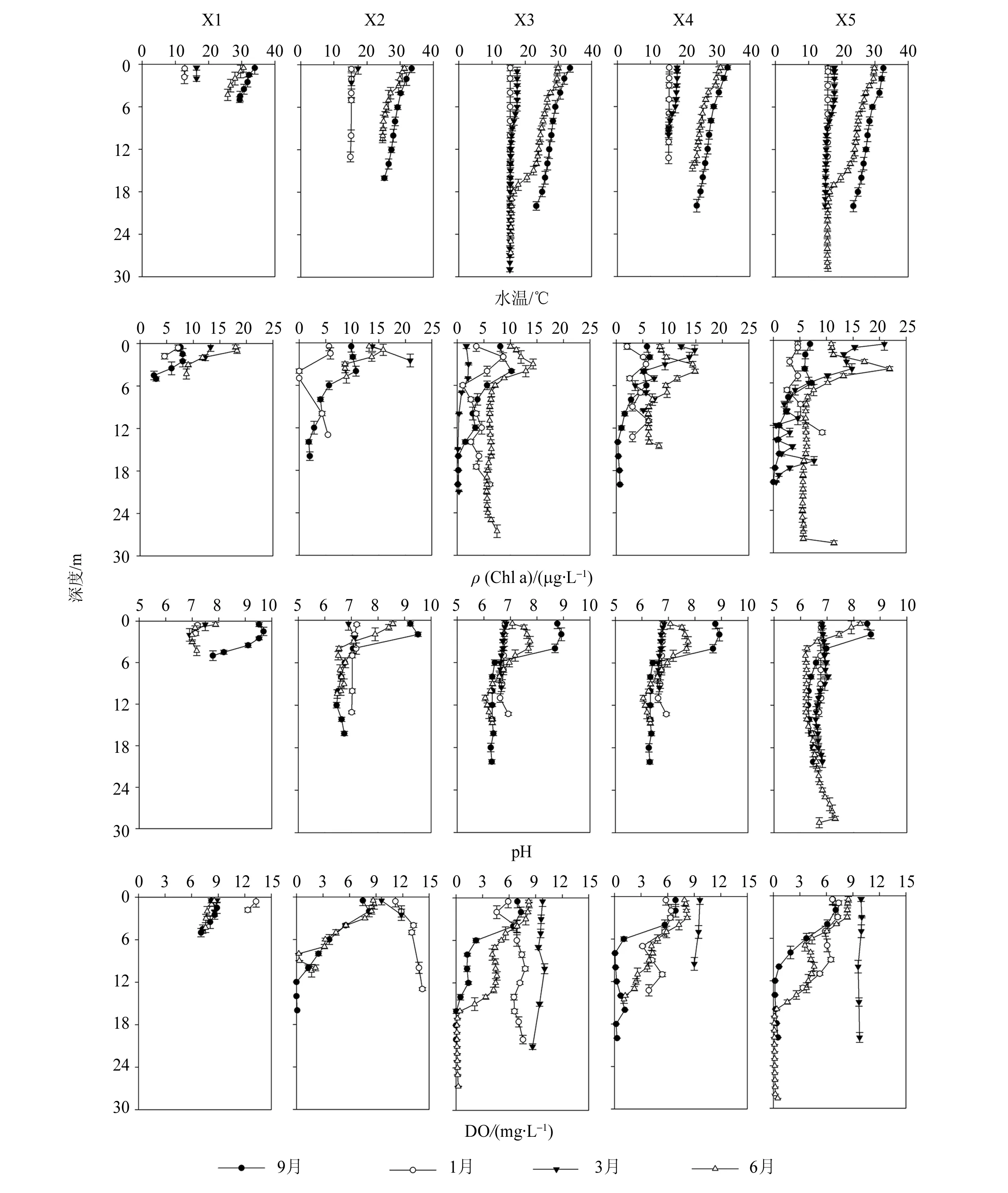
图3 联和水库不同季节水温(WT)、叶绿素a(Chl a)、pH和溶解氧(DO)垂直变化图Fig.3 Vertical concentration variations of water temperature, chlorophyll a, pH and dissolved oxygen in Lianhe Reservoir in different seasons
2.5 pH和DO
热分层时期,pH值在表层水中较高,其数值在表层到水深6 m处,从9.0逐步下降到6.18;水深6 m以下,pH值变化不大。但在混合期,整个水体的pH值较为均一,无显著变化(图3)。总体来讲,9月份pH值高于其它月份的数值。
现场调查显示,DO具有季节性变化(图3)。热分层时期,表层DO含量充足,质量浓度在6.3~ 9.3 mg/L之间变化。从X3和X5站位的结果可知,在4~ 6 m和12~ 18 m处有两个氧跃层,DO含量迅速下降。水深大于18 m,DO含量低于2 mg/L,处于缺氧状态[7]。在混合期,DO垂直分布均匀,变化范围在7.56~ 9.76 mg/L。其中,3月份的整体质量浓度8.57~ 11.85 mg/L高于其它月份。

图4 联和水库温度分层及水动力剖面示意图Fig.4 Illustration of thermal stratification, the depth of thermocline, and the circulations of water column in Lianhe Reservoir during thermal stratification period


总氮(TN)在1月、3月和6月没有明显的垂直变化(图5)。但9月的垂直质量浓度变化较为显著(P> 0.05)。最低质量浓度出现在1月,各站位之间没有显著区别(P> 0.05),平均质量浓度为2.45 mg/L。最高平均质量浓度出现在9月,为5.43 mg/L。3月和6月的平均质量浓度较为接近,分别为3.77 和3.84 mg/L。

表3 联和水库在2015年热分层(6月)和混合(3月)时期所有的浮游植物种类Table 3 All the phytoplankton species in Lianhe Reservoir during the thermal stratification (June) and mixing (March) periods in 2015
续上表

The thermal stratification periodThe mixing periodCrucigenia quadrataElakatothrix gelatinosaCyanobium paarvumEuglena acusCyclotella sp.Euglena mutabilisCymbella sp.Euglena pisciformisDictyosphaeria cavernosaEuglena polymorphaDictyosphaerium ehrenbergianumEuglena sporogyraEudorina elegansFragilaria capucinaEuglena acusHyallotheca dissiiensEuglena gasterosteusKirchneriella contortaEuglena mutabilisKirchneriella lunarisLepocinclis autumnalisMelosira italicaLepocinclis fusiformisMelosira variansMelosira granulataMelosira wriansMelosira variansMicractinium pusillumMicrocystis densaMicrocystis densaMicrocystis wesenbergiiMicrocystis wesenbergiiNavicula bicapitellataNavicula bicapitellataOscillatoria acuminataNavicula cuspidataOscillatoria chlorineNavicula sp.Pediastrum clathratumOscillatoria chlorinaPediastrum duplexPeridiniopsis keveiPediastrum duplex var.clathratumPeridinium pusillumPediastrum duplex var.gracillimumScenedesmus acuminatusPeridinium gatunenseScenedesmus brasiliensisScenedesmus acuminatusScenedesmus denticulatusScenedesmus denticulatusScenedesmus platydiscusScenedesmus platydiscusScenedesmus quadricandaScenedesmus producto-capitatusStaurastrum planctonicumScenedesmus quadricaudaStaurastrum sexangulareScenedesmus wuhanensisStaurodesmus aristiferusStaurastrum dilatatumSurirella robustaStaurastrum planctonicumSynedra acusStaurastrum sexangulareSynedra sp.Staurastrum tetracerumTetrastrum elegansStaurodesmus aristiferusTetrastrum glabrumTetraedron trigonumTrachelomonas hispidaTrachelomonas lismorensisTrachelomonas scabraTrachelomonas nodsoniTrachelomonas volvocinaTrachelomonas oblonga-Trachelomonas similis-Trachelomonas volvocina-Treubaria crassispina-Trochiscia reticuraris-
表4 混合时期(3月)库区各站位在0.5、10和20 m 深度处的浮游植物优势种、优势种细胞密度及浮游植物总细胞密度1)
Table 4 Dominant species, cells densities of dominant species / phytoplankton total cells densities at stations X1, X2, X3, X4, and X5 in water layer of 0.5, 10 and 20 m during isothermal mixing period (March, 2015) 106cells·L-1
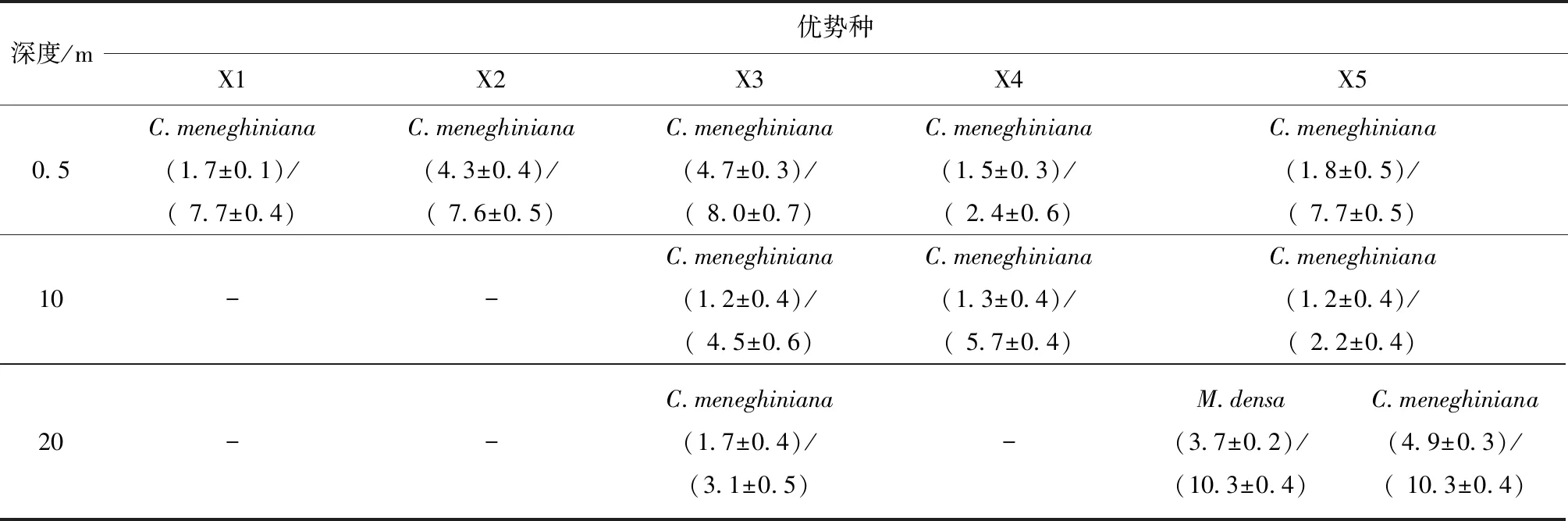
深度/m优势种X1X2X3X4X50.5C.meneghiniana(1.7±0.1)/( 7.7±0.4)C.meneghiniana(4.3±0.4)/( 7.6±0.5)C.meneghiniana(4.7±0.3)/( 8.0±0.7)C.meneghiniana(1.5±0.3)/( 2.4±0.6)C.meneghiniana(1.8±0.5)/( 7.7±0.5)10 --C.meneghiniana(1.2±0.4)/( 4.5±0.6)C.meneghiniana(1.3±0.4)/( 5.7±0.4)C.meneghiniana(1.2±0.4)/( 2.2±0.4)20--C.meneghiniana(1.7±0.4)/(3.1±0.5)-M.densa(3.7±0.2)/(10.3±0.4)C.meneghiniana(4.9±0.3)/( 10.3±0.4)
1) The values are mean±S.D.(n=3)
表5 热分层时期(6月)库区各站位在0.5、10和20 m 深度处的浮游植物优势种、 优势种细胞密度及浮游植物总细胞密度1)
Table 5 Dominant species, cells densities of dominant species / phytoplankton total cells densities at stations X1, X2, X3, X4, and X5 in epilimnion (0.5 m), water layer of 10 m, and hypolimnion (25 m) during thermal stratification period (June, 2015) 107cells·L-1
深度/m优势种X1X2X3X4X50.5M.densa(2.3±0.4)/( 5.6±0.4)M.densa(6.5±0.2)/( 8.7±0.2)M.densa(9.0±0.4)/( 10.2±0.6)M.densa(5.3±0.3)/( 7.9±0.3)C.meneghiniana(2.3±0.3)/( 4.4±0.4)M.densa(1.1±0.3)/( 4.4±0.4)10-M.densa(0.8±0.2 )/(2.3±0.3)C.meneghiniana(0.8±0.3)/(2.3±0.3)M.densa(0.9±0.3)/( 2.8±0.4)C.meneghiniana(0.7±0.4)/( 2.8±0.4)M.densa(5.8±0.3)/( 2.1±0.3)C.meneghiniana(0.8±0.2)/( 2.6±0.3)M.densa(0.6±0.2)/( 2.6±0.3)25--C.meneghiniana(0.3±0.1)/( 0.9±0.2)-C.meneghiniana(0.5±0.1)/( 1.2±0.4)M.densa(0.5±0.2)/( 1.2±0.4)
1) The values are mean±S.D.(n=3)
表6 混合时期(3月)和热分层时期(6月)联和水库附近水域浮游植物优势种、优势种细胞密度及浮游植物总细胞密度1)
Table 6 Dominant species, cells densities of dominant species / phytoplankton total cells densities at stations Y1, Y2, Y3 and Y4 near Lianhe Reservoir during mixing (March) and thermal stratification (June) periods 104cells·L-1

时期优势种Y1Y2Y3Y4混合时期(3月)Hyallotheca dissiiens(1.4±0.2)/(2.5±0.4)Melosira wrians(1.1±0.2)/(1.7±0.3)Melosira italica(1 595±200)/(4 800±700)Oscillatoria chlorina(5.1±0.3)/(9.9±0.5)热分层时期(6月)--Melosira islarica(322±80)/(917±90)Microcystis wesenbergii(1.6±0.2)/(2.9±0.3)
1) The values are mean±S.D.(n=3)
9月总磷(TP)质量浓度显著低于其他月份质量浓度(P< 0.05),平均质量浓度为0.11 mg/L(图5)。最高平均质量浓度出现在6月,为5.48 mg/L。在表层到水深12 m处,质量浓度有较强烈的变化幅度。水深18 m以下,总磷质量浓度逐渐增加,X3站位底部质量浓度增加到22.73 mg/L。除了6月以外,其它月份的质量浓度在垂直方向上均没有显著变化(P> 0.05)。
3 讨 论
3.1 浮游植物及其优势种在亚热带水库中的分布特征
梅尼小环藻是典型的越冬性硅藻,在冬季成为联和水库唯一的优势种,其最大细胞密度为4.7 ×106cells/L(表4)。通常来讲,梅尼小环藻只适合于低温生长,并不能生长于较高温度。但调查结果显示,夏季X5站位的表层水体依然有大量的梅尼小环藻存在(2.3×107cells/L)。我们推测这种现象可能是由X5站位靠近取水口导致的。在坝20 m深处有一取水口,每天均有一定流量的水经取水口流入下游。因此,X5处垂直水动力强烈,其水文条件与库中央X3站位的条件不一致。强烈的垂直混合水流将底部较冷水体中的梅尼小环藻带入表层水。许多研究也表明,在快速流动的高温水体中,硅藻的生长速率较快,有时甚至超越蓝藻的速率[8-10]。而在X3站位,梅尼小环藻只发现存在于水库底部(表5),这是由于X3站位位于水库中央,缺乏较强的垂直水动力。因此,藻类优势种的分布除了受水温影响,还受水动力影响。
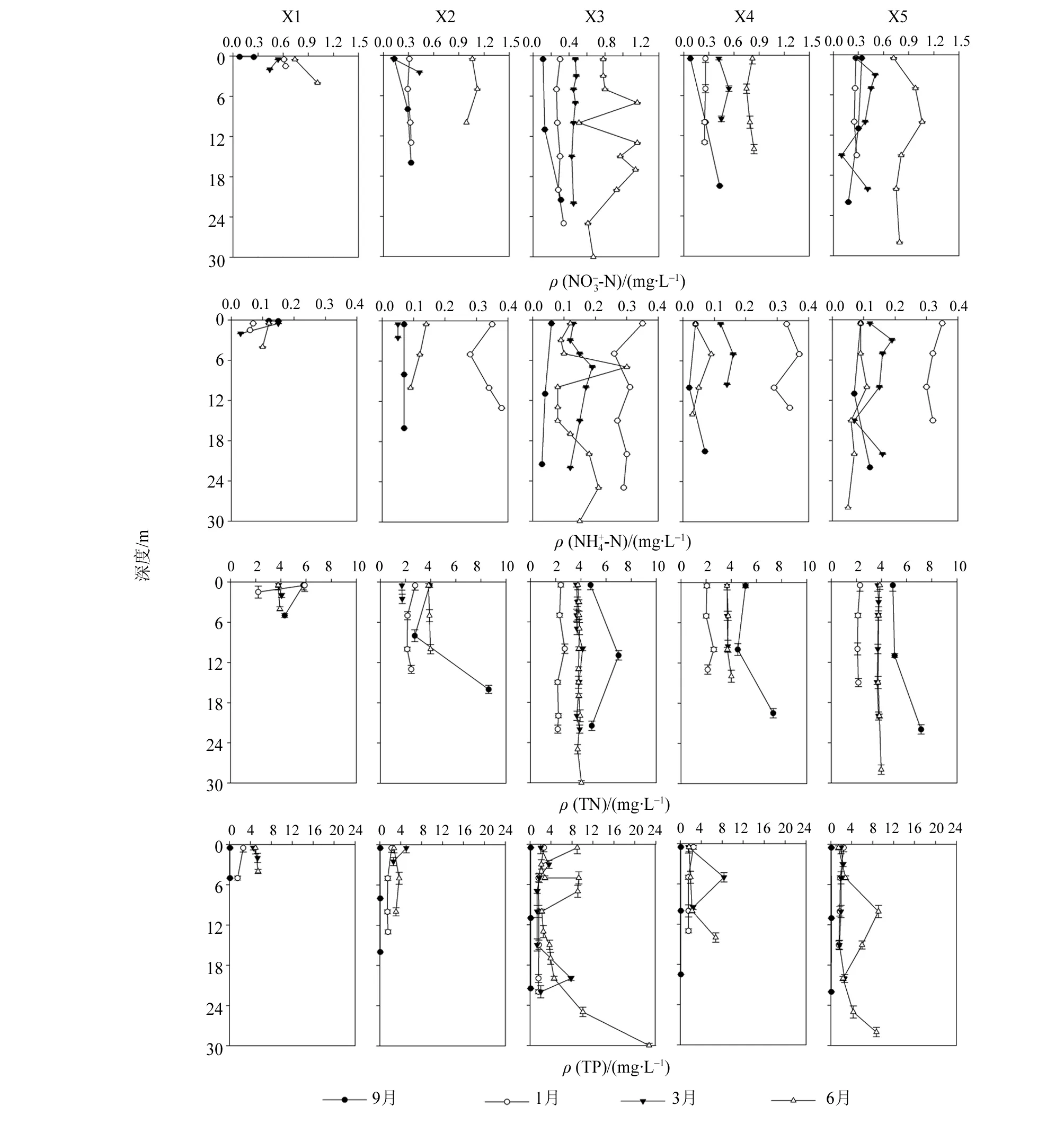
图5 联和水库不同季节硝氮、氨氮、总氮和总磷垂直质量浓度变化图Fig.5 Vertical concentration variations of TN and TP in Lianhe Reservoir in different seasons
在混合时期,除梅尼小环藻外,X5站位的底部也发现了密集微囊藻的存在(表4)。事实上,自2012年夏季以来联和水库都会爆发密集微囊藻的水华。因此,我们推测水华后期的密集微囊藻被北风吹到大坝(X5站位)附近,并以休眠的形式下沉于库底。密集微囊藻细胞通常不能忍受较低的温度,因此他们在水库底部进入休眠期,直到条件成熟再大量增殖。与其它蓝藻不同,密集微囊藻在越冬过程中并没有发生形态变化[11-13]。根据X5站位发现的密集微囊藻细胞,我们认为这些藻细胞是以往水华遗留下来的,并作为未来微囊藻水华的藻种保存在库底。在热分层时期,各水层均以密集微囊藻为优势种,并且其密度从表层到底层逐渐减少(表5)。这表明,密集微囊藻已经从低温且黑暗的底部上升到水温较高且光照强烈的表层,并快速生长。可见,特殊的地形和水动力条件也是藻类生长与爆发的关键。当然,藻类的生长和分布还与其它因素息息相关,例如营养盐、溶解氧等等。但不同区域水库中环境因素对浮游植物的影响程度并不一致。对于亚热带联和水库来说,水温、地形和水动力条件是影响水库浮游植物的重要因素。
3.2 浮游植物对溶解氧分布的影响
许多研究显示,在热分层时期,水中物质(例如溶解氧和营养盐)的渗透都会被温跃层所阻挡,形成氧跃层和底部缺氧的现象[14-15]。同时,营养盐也会形成分层现象。然而,本文发现总氮在垂直方向上的分布均一,无明显分层现象(图5)。这说明了温跃层的存在并不能阻挡所有物质的上下迁移。在联和水库中,由热能驱动的水动力并不是影响溶解氧和营养盐垂直分布主要原因。
在热分层时期,大量的浮游植物聚集在水深0~ 4 m处,此处叶绿素a质量浓度最高,因为此处有充足的溶解氧、适合的光照和温度,适宜浮游植物生长。随着深度增加,叶绿素a质量浓度逐渐下降。结果显示,在水深4~ 6 m和12~18 m处叶绿素a质量浓度迅速下降(图3)。溶解氧的氧跃层也同时存在于这两处深度,与叶绿素a的变化趋势一致。此外,叶绿素a质量浓度与溶解氧含量呈显著相关(P< 0.01)。浮游植物除了需要足够的氧气进行呼吸作用,还可以通过光合作用释放氧气,它是水体中溶解氧含量的调节者。因此,我们推测浮游植物的生物量是影响溶解氧垂直分布的重要原因。为了证明这个结论,还需在后续进一步研究浮游植物对溶解氧分布的影响,开展相关的现场模拟实验。
3.3 溶解氧和浮游植物对总磷分布的影响
水库中的磷由地表径流从上游河流带入水库中。然而调查结果显示,在热分层时期,表层总磷质量浓度显著低于底层质量浓度(P< 0.05),其垂直变化趋势与浮游植物相反。浮游植物表层生物量高于底层。分析显示,总磷与浮游植物生物量分布具有相关性(P< 0.05)。这可能是因为浮游植物在指数生长期时需要耗尽大量的磷[16-18]。
表层大量聚集的藻类死亡后,藻细胞内的磷将会析出。一部分重新进入水体被其它藻类所吸收。另一部分则以碎片的形式沉入底部,经过矿化作用重新以无机磷的形式保存于库底,这也是库底磷质量浓度显著高于表层的原因之一。然而,这两种途径的磷都会被浮游植物所吸收和同化,其质量浓度受浮游植物生物量的影响。因此,初步判断浮游植物作为初级生产力,对总磷的垂直分布具有调节作用。
热分层时期库底总磷质量浓度显著升高,我们认为另外一个原因是由于底部缺氧导致的。在缺氧的条件下,上覆水中的氢氧化铁能与磷结合,置换成亚铁离子,同时把磷从底泥中释放出来[19-20]。因此,底部缺氧是磷释放的关键条件。从这个意义上来说,溶解氧的垂直分布是影响沉积物释放磷的主要因素。为了进一步解释浮游植物和溶解氧对水中磷分布的影响,还需要开展生态实验来证明我们的观点。
3.4 联合水库氮磷收支状态
本文估算了2014年9月至2015年8月的大气氮磷沉降。结果显示,氮从大气沉降和上游河流流入库区的量每年分别为14 815.4和481 696.1 kg。由于受径流量增大的影响,5月至10月,从河流入库的总氮量逐步升高。每年约有324 025.3 kg的氮随水库排水离开了库区,用于发电、饮用水蓄水储备和防洪等功能。可见,剩下约172 486.3 kg的氮被储存在水库里(表7)。
由于湿沉降中的磷含量低于检出限,因此本文认为从大气沉降来入水库的这部分磷可以忽略不计。然而,以颗粒态存在的磷在大暴雨事件中被地表径流带入到水库中。从9月到12月,冬季降雨量减少,磷的流入量也逐渐减少;但从3月到8月,由于受大暴雨事件影响,磷的流入量一直保持在较高水平。磷的总输入量和总输出量分别为352 218.1和227 668.6 kg,有124 549.5 kg的磷储存在库中(表8)。
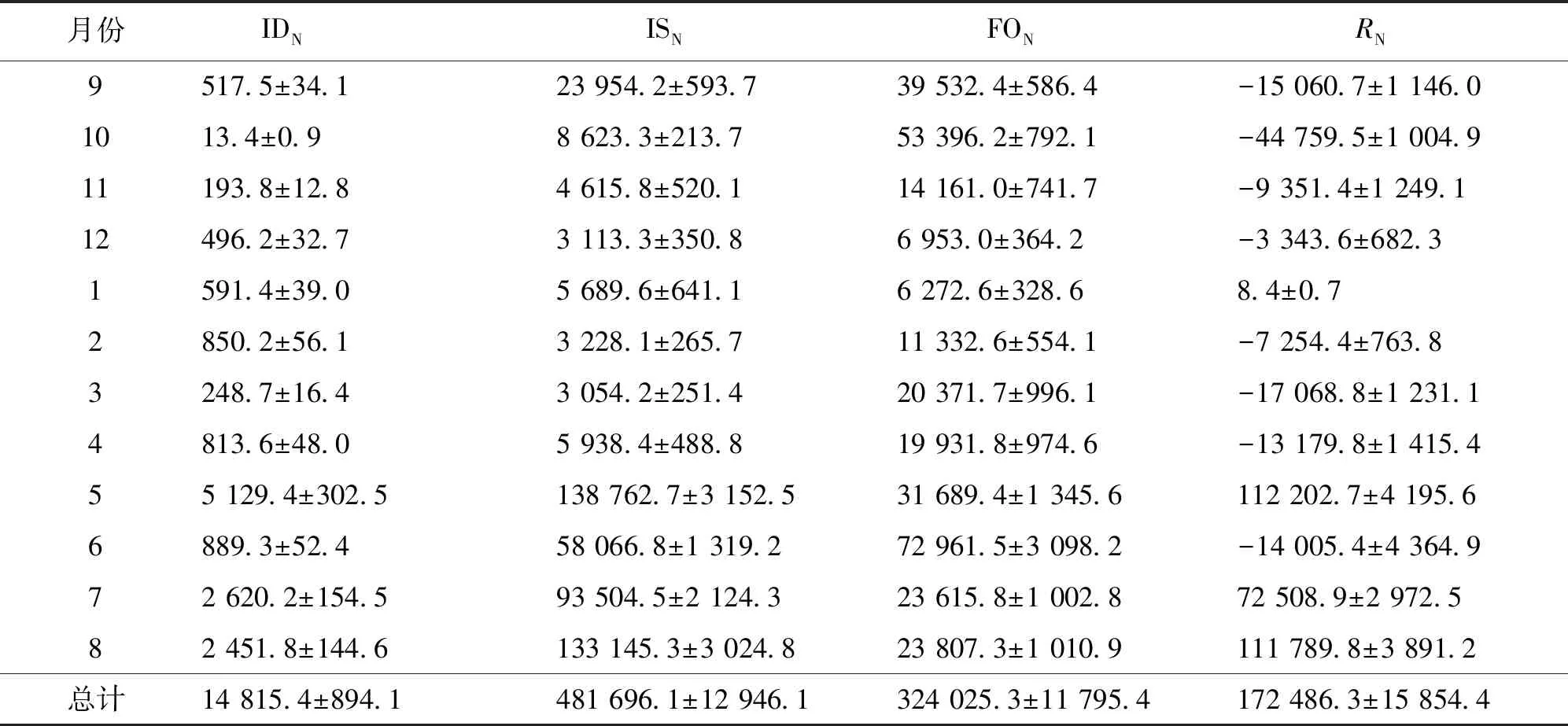
表7 联和水库中氮经大气沉降(IDN)、河流(ISN)输入量、氮流出量(FON)以及氮滞留量(RN)1)Table 7 Nitrogen input from deposition (IDN), nitrogen loading through rivers (ISN), nitrogen flux through outlet (FON), and nitrogen retention (RN) at Lianhe Reservoir from September 2014 to August 2015 kg
1) The values are mean±S.D.(n=3)

表8 联和水库中磷经大气沉降(IDP)、河流(ISP)输入量、磷流出量(FOP)以及磷滞留量(RP)1)Table 8 Phosphorus input from deposition (IDP), phosphorus loading through rivers (ISP), phosphorus flux through outlet (FOP), and phosphorus retention (RP) at Lianhe Reservoir from September 2014 to August 2015 kg
1)NC:Non-detected;The values are mean±S.D. (n=3)
由计算结果可知,在绝大多数月份里,氮和磷的输入量都远超输出量。氮的滞留量与入库流量有很大关系。当上游河流入库流量显著增加时,大量的氮被保存在水库中。氮的流失主要发生在流入量小于出水量的时候。同时,热分层时期,由于库底缺氧,底层水体会发生反硝化脱氮作用。许多研究表明,反硝化细菌可以去除大量的氮[23-24]。然而,在联和水库中,由于没有发现固氮蓝藻,因此,氮不能通过氮固定的形式来储存。因此,热分层时期库区底部发生脱氮作用。总体而言,库区的氮量仍处于富余状态,这主要由河流和大气沉降贡献。
对于磷来说,在干旱的季节里,库区磷量处于亏损状态;而在湿润季节(特别是7、8月),磷的输入量由于上游径流量的增加呈快速增长状态。与其它亚热带水库相比[20, 25],联和水库的磷储存量相对较高。在库底,许多沉积物被发现富含磷,这些磷以颗粒态的形式存在。这是由于在大暴雨事件中,大量携带磷的颗粒物随着地表径流被冲进库区,导致水库中磷的含量上升。因此,水库中磷显然是来自于陆地土壤。其它研究也显示,库区总磷的含量与岸上河流与湖泊中的颗粒物有很大关联[20, 26],这也支持了我们的研究结果。
4 结 论
联和水库中的垂直水温分布呈季节性变化,分为热分层和混合层时期。水体中溶解氧、pH和叶绿素a的垂直分布也随之发生变化。除6月总磷外,营养盐在垂直方向上变化不显著。此外,浮游植物群落的优势种在混合期为梅尼小环藻,在热分层时期为密集微囊藻。优势种的变更被认为与水温、地形和水动力有关。对比岸上水域的浮游植物种类,本文发现水库中造成水华的密集微囊藻是来自于水库底部,而不是岸上。藻种通过休眠状态来克服恶劣的生存环境。因此,本文认为控制水华的着落点在于库区本身。

