蒜头果中CYP71基因克隆与果实不同发育时期的表达分析
原晓龙 陈中华 李云琴 王毅


摘 要: 由氨基酸衍生的氰苷是由植物细胞色素P450单加氧酶(CYP)催化氨基酸生成的次生代谢产物,与植物的防御和抗逆境胁迫相关。该研究通过分析蒜头果转录组数据,从中分离并克隆得到1条细胞色素P450基因(命名为MoCYP71,GenBank登录号为MK172858),对其进行生物信息学分析并检测该基因在果实不同发育时期的表达情况。结果表明:MoCYP71基因含1 572 bp,编码523个氨基酸,该基因的cDNA序列与咖啡(Coffea eugenioides,XM_027319282)、小果咖啡(Coffea arabica,XM_027213456)中的CYP71基因的mRNA序列均有88%的一致性;MoCYP71蛋白的相对分子质量为58 976.54,理论等电点pI为8.10,分子式为C2675H4184N704O744S27,不稳定系数(Ⅱ)为40.84,是一种不稳定蛋白;该蛋白不存在信号肽,存在于分泌途径,含有两个跨膜结构,分别位于20~37和311~333位的氨基酸为跨膜疏水螺旋,锚定于细胞器上;该蛋白含有CYP家族的保守结构域,包括脯氨酸富集区(PPSPPRLP)、K螺旋(KETFR)、I螺旋(GGIDTS)、PERF域(PERF)和识别结构域血红素结合域(FGAGRRICPG),与可可、榴莲、高粱等的CYP71E家族的蛋白(GenBank登录号分别为EOX92908.1、XP_022773875.1和AAC39318.1)聚为一支;在花謝后,MoCYP71基因表达量逐渐降低, 花谢后1个月>2个月>3个月,但在花谢后4个月的表达量急剧增加。以上结果对研究蒜头果的对虫害的防御、组织成熟及蒜头果中有效次生代谢产物的发掘具有重要意义。
关键词: 蒜头果, CYP71基因, 氰苷, 生物信息学分析, 基因表达
中图分类号: Q781 文献标识码: A
文章编号: 1000-3142(2020)04-0501-08
Abstract: Amino acids-derived cyanogenic glucosides catalyzing by plant cytochrome P450 enzymes are plant secondary metabolism, which is related to plant defense and anti-stress. A gene of cytochrome P450(namely MoCYP71, GenBank ID is MK172858) from Malania oleifera was isolated and cloned through analyzing the transcriptome of M. oleifera, then its function was analyzed by bioinformatics analysis, and the expression of MoCYP71 in different developmental periods of fruit was detected. The results were as follows: MoCYP71 gene has 1 572 bp, encodes 523 amid acids, and its sequence of cDNA has 88% identity with the CYP71 cDNA of Coffea eugenioides(XM_027319282) and Coffea arabica(XM_027213456); The relative molecular weight of MoCYP71 protein was 58 976.54, the theoretical pI was 8.10, the molecular formula was C2675H4184N704O744S27, the instability index(Ⅱ) was 40.84, and the protein belonged to an instable protein; There had no siginal peptide in this protein sequence, and the protein exists in the secretion pathway and contained two transmembrane structure, located in the protein sequences of 20-37 and 311-333, and the transmembrane sites anchored in the organelle membrane; MoCYP71 had all the conserved domain of CYP family, containing proline-rich region (PPSPPRLP), K helix region(KETFR), I helix region(GGIDTS), PERF domain(PERF) and the main identified feature heme-binding region (FGAGRRICPG), and the protein MoCYP71 and the CYP71E protein in Theobroma cacao, Durio zibethinus, Sorghum bicolor(GenBank ID is EOX92908.1, XP_022773875.1and AAC39318.1, respectively) clustered into one clan; The expression level of MoCYP71 gene reduced gradually in the first three months after blossom fading, particularly, 1st month the fruit after blossom fading> 2nd month> 3rd month, however, its expression level increased sharply in 4th month. The present study had a important significance to defense to insect pests, tissue ripening and secondary metabolism digging in Malania oleifera.
Key words: Malania oleifera, CYP71 gene, cyanogenic glucosides, bioinformatics analysis, gene expression
蒜头果(Malania oleifera)隶属于铁青树科(Olacaceae),为我国特有的单种属濒危植物,仅分布于云南东南部和广西西部 (刘雄民等, 2007)。在蒜头果果实的成熟期,其果实和枝叶中会含有少量苯乙腈、氰苯基苯甲酸类等氰苷类化合物 (Tang et al., 2013);这是因为植物成熟过程中需要合成乙烯,同时会产生少量氰苷类化合物 (Gleadow & Moller, 2014),而通常情况下植物中的氰苷能稳定地存在于细胞的区室中(Morant et al., 2008),但当植物受到昆虫等侵袭时,氰苷就会被降解成酮和氰化物以抵御其侵害(Anne Vinther et al., 2008; Jorgensen et al., 2011)。
氰化物是一类对人类具剧毒作用的化合物,急性氰化物中毒会抑制线粒体中的细胞色素aa3氧化酶的活性并阻断细胞呼吸,严重时甚至危及生命(Nelson, 2006a)。氰苷的生物合成途径首次在高粱(Sorghum bicolor)中阐明 (Jones et al., 1999;Gleadow & Moller, 2014),高粱中氰苷类的生物合成途径中仅包含3个结构基因,包括两种生物膜锚定的多功能细胞色素P450(CYP79A1和CYP71E1)和一个可溶的UDPG-葡萄糖基转移酶(UGT85B1) (Halkier et al., 1995; Bak et al., 1998; Jones et al., 1999)。其中CYP79A1负责催化酪氨酸转化成 p-羟基苯乙醛肟(p-hydroxyphenylacetaldoxime);CYP71E1负责将p-羟基苯乙醛肟转化成p-羟基苯乙醇腈,CYP71E1又名4-羟基苯乙醛肟单加氧酶(4-hydroxyphenylacetaldehyde oxime monooxygenase)(Xie et al., 2017); UGT85B1负责在p-羟基苯乙醇腈(p-hydroxymandelonitrile)上添加葡萄糖基生成蜀黍苷(dhurrin)。高粱中的CYP71E1酶属于CYP71家族(Xie et al., 2017),但CYP71家族中的基因存在大量新功能化或亞功能化的多重复制与重组,如双子叶植物拟南芥(Arabidopsis thaliana) CYP71家族中的52个成员仅覆盖了CYP71A和CYP71B两个亚家族 (Paquette et al., 2000; Nelson et al., 2004), CYP71家族同源基因的多样性极为丰富(Jorgensen et al., 2011),因此对CYP71家族基因的具体功能鉴定存在一定的困难。目前,研究人员从拟南芥(Bak et al., 2001)、大豆(Guttikonda et al., 2010)等多种植物分离得到多种CYP71家族基因,但尚未有关蒜头果(Malania oleifera)方面CYP71基因的报道。本研究选择生长3个月的蒜头果果实进行转录组测序,从转录组数据中搜索获得CYP基因(命名MoCYP71),采用RT-PCR技术克隆获得该基因全长cDNA,并用生物信息学分析的方法对其潜在功能进行预测,再检测该基因在果实的不同发育时期的表达量,为进一步研究蒜头果果实中次生代谢物质的生物合成、揭示对非生物和病原体胁迫的防御机制奠定基础。
1 材料与方法
1.1 材料
从生长于云南省文山州广南县旧莫乡岩腊村的蒜头果上分别采集花谢后1个月、2个月、3个月、4个月的果实,同时采集叶片作为对照;迅速将所采集的样品放入液氮中保存,带回实验室置于-80 ℃冰箱中备用。
1.2 转录组分析与RNA提取
将花谢后3个月的蒜头果果实送到华大基因进行转录组测序,通过对转录组Unigene进行本地Blast,并将各Unigene在NR、NT、Swiss-Prot、KEGG、COG、GO等数据库中进行注释和分析,寻找蒜头果果实转录组中的CYP71基因。按照Qiagen Plant RNA提取试剂盒说明书的步骤提取蒜头果果实和叶片的总RNA,用1%的琼脂胶检测所有样品RNA的完整性。再取1 μg 符合试验要求的RNA进行反转录得到cDNA,将cDNA保存在-20 ℃冰箱中备用。
1.3 蒜头果MoCYP71基因克隆
通过对蒜头果转录组数据分析,获得表达量高且拥有完整开放阅读框的CYP基因,以获得的CYP基因序列,设计含有起始密码子的特异引物(MoCYP71F:5′-ATGCACTTGAGCTTCCAAAG-3′)和含有终止密码子的特异引物(MoCYP71R: 5′-GGTATAATTGGGATGCATAG-3′)。以蒜头果果实cDNA 为模板,用HiFi高保真聚合酶进行PCR扩增,电泳检测后通过将目的片段连接到pGMT载体上、转化、菌落PCR筛选获得含MoCYP71基因的阳性克隆,送上海生工测序,最终通过序列比对确定获得MoCYP71基因全长cDNA,并永久保存在-80 ℃冰箱。
1.4 MoCYP71的生物信息学分析
用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)对CYP71基因进行翻译获得其蛋白序列,用ProtParam(https://web.expasy.org/protparam/)、CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)等分析MoCYP71蛋白的理化性质、保守结构域和跨膜结构域,并用DNAMAN比对其氨基酸同源序列,确定MoCYP71的保守结构域。将蒜头果MoCYP71蛋白与NCBI上已知的其他植物的CYP蛋白进行多重比对,并用MEGA7软件中邻位相接法(Neighbor-joining)构建分子系统进化树。
1.5 蒜头果MoCYP71基因不同组织表达分析
分别取蒜头果不同组织的RNA 2 μg,反转录合成cDNA第一條链。以不同组织的cDNA为模板,用特异引物TMoCYP71F(5′-ACCGCCGTCGCCCAATCTTC-3′)和TMoCYP71R(5′-AACAGAGCATGAGGACTTGG-3′)进行荧光定量PCR分析,并以elongation factor 1-alpha基因作为内参基因。具体反应体系如下:分别向PCR管中加入2×SYBR Green master mix(含ROX) 12.5 μL、 引物TMoCYP71F和TMoCYP71R各0.5 μL、cDNA 1 μL,最终用PCR water nucle-free补足25 μL。PCR反应条件:首先,预变性温度95 ℃,时间10 min;然后,变性温度95 ℃,时间15 s;最后,退火和延伸温度为 60 ℃,时间为30 s,共40个循环。反应结束后,收集信息做Ct值分析。
2 结果与分析
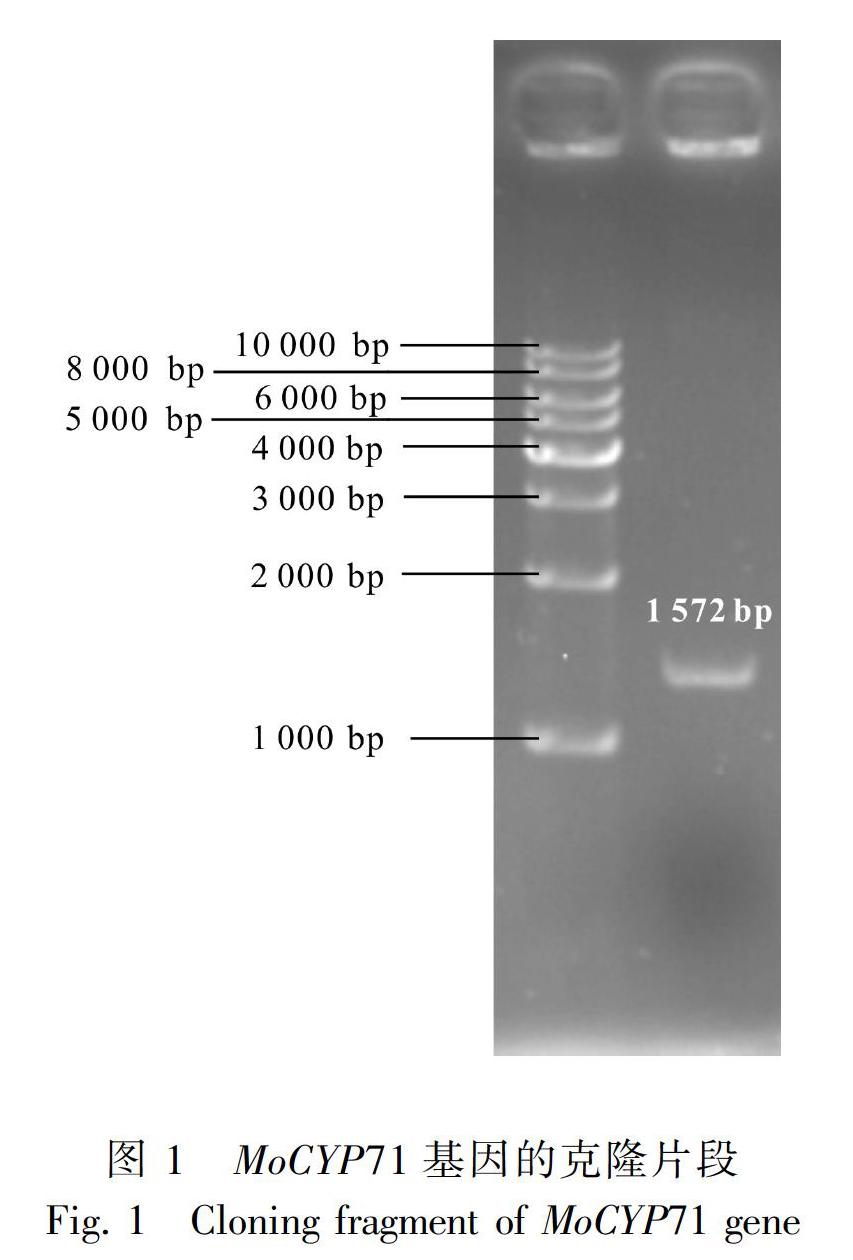
2.1 蒜头果MoCYP71基因的克隆
通过对蒜头果转录组数据的分析,获得一条植物细胞色素P450相关的DNA序列,并以其为基础设计特异引物MoCYP71F和MoCYP71R,以蒜头果果实的cDNA为模板进行PCR扩增,获得一条长1 572 bp的cDNA序列(图1),将其命名为MoCYP71基因(GenBank登录号为MK172858)。将MoCYP71基因的cDNA序列在NCBI上进行Blast比对,发现该基因的cDNA序列与咖啡(Coffea eugenioides,XM_027319282)、小果咖啡(Coffea arabica,XM_027213456)中编码植物细胞色素P450基因的mRNA序列均有88%的一致性。
2.2 MoCYP71基因及其蛋白的生物信息学分析
MoCYP71基因可编码523个氨基酸,将其氨基酸序列在NCBI上进行Blast比对,发现该蛋白与高粱(Sorghum bicolor)中编码4-羟苯乙酮肟单加氧酶(Bak et al., 1998)(4-hydroxyphenylacetaldehyde oxime monooxygenase,EC:1.14.14.37)的细胞色素P450蛋白(GenBank登录号为AAC39318.1)的一致性为58%,4-羟苯乙酮肟单加氧酶属于CYP71家族。MoCYP71的生物信息学分析结果显示,该蛋白的相对分子质量为58 976.54,理论等电点pI为8.10,分子式为C2675H4184N704O744S27,不稳定系数(Ⅱ)为40.84,是一种不稳定蛋白;该蛋白不存在信号肽,存在于分泌途径,含有两个跨膜结构,分别位于20~37和311~333位的氨基酸为跨膜疏水螺旋,锚定于细胞器上。将蒜头果的MoCYP71蛋白与高粱、木薯(Manihot esculenta)和拟南芥(Arabidopsis thaliana)的CYP71家族蛋白(GenBank登录号分别为O48958、Q6XQ14和Q9LVD2.1)进行同源序列比对,发现MoCYP71蛋白具植物细胞色素P450的所有保守结构域(图2),脯氨酸富集区(PPSPPRLP)、K螺旋(KETFR)、I螺旋(GGIDTS)、PERF域(PERF)和CYP超酶家族的典型识别结构域血红素结合域(FGAGRRICPG)。选择已鉴定过功能的可可(Theobroma cacao)、中华猕猴桃(Actinidia chinensis var. chinensis)、高粱等的4-羟苯乙醛肟单加氧酶 (GenBank登录号分别为EOX92908、PSR86236 和AAC39318);大豆(Glycine max)、梅(Prunus mume)和鳄梨(Persea americana)等属于苯醛肟加氧酶的蛋白(GenBank登录号分别为AF022157、AB920492和P24465);菊苣(Cichorium intybus)、黄花蒿(Artemisia annua)、埃及莨菪(Hyoscyamus muticus)和烟草(Nicotiana tabacum)等的萜类合成酶蛋白(GenBank登录号分别为E1B2Z9、BAM68808、ABS00393和AAD47832);长春花(Catharanthus roseus)、拟南芥(Arabidopsis thaliana)、向日葵(Helianthus annuus)和大阿米芹(Ammi majus)等的吲哚类物质的生物合成酶蛋白(GenBank登录号分别为ADZ48681、O49342、AEI59779和Q6QNI4 )与蒜头果的MoCYP71蛋白一起构建分子系统进化树,图3结果显示:蒜头果与可可、中华猕猴桃和高粱等的4-羟苯乙醛肟单加氧酶(CYP71E1)蛋白聚为一支,该组中蛋白负责催化4-羟苯乙醛肟转化为4-羟基苯乙醇腈。
2.3 MoCYP71基因在不同果实发育时期和叶片中的表达分析
以不同发育时期的蒜头果果实、叶片的cDNA为模板,以特异的检测引物TMoCYP71F和TMoCYP71R检测MoCYP71基因的具体表达量,图4结果显示:MoCYP71基因在不同发育时期的蒜头果果实及叶片中均有表达,以叶片(L)的表达量为参照,MoCYP71基因在不同发育时期果实中表达量均高于参照;在花谢后,MoCYP71基因表达量逐渐降低, 花谢后1个月(F1)>2个月(F2)>3个月(F3),但在花谢后4个月(F4)的表达量急剧增加。Mo. 蒜头果CYP71蛋白; Sb. 高粱(Sorghum bicolor)CYP71蛋白(AAC39318.1); Me.木薯(Manihot esculenta)CYP71蛋白(Q6XQ14.1); At. 拟南芥(Arabidopsis thaliana)CYP71蛋白(Q9LVD2.1)。
3 讨论与结论
蒜头果的挥发油中扁桃腈的相对含量高达64.98 %(黄开响等, 2008),扁桃腈是由氢氰酸添加葡萄糖生成 (Rustler et al., 2007)。氰苷是一類广泛存在于植物中的次生代谢产物,其生物合成是由细胞色素P450单加氧酶(CYP)催化氨基酸形成(Bak et al., 1998),其中CYP79家族催化脂肪族或芳香族氨基酸形成相应的醛肟(Gleadow & Moller, 2014),CYP71催化醛肟生成相应的氰苷(Bak et al., 1998)。目前,已有CYP79和CYP71E酶在高粱(Bak et al., 1998)、木薯(Jorgensen et al., 2011)、红豆杉(Taxus baccata)(Luck et al., 2017)中参与氰苷生物合成的报道。迄今为止,尚未有关在蒜头果中参与氰苷生物合成的CYP家族基因的报道。
本研究从蒜头果中克隆获得CYP71家族的基因MoCYP71,通过生物信息学分析发现该基因的蛋白与其他植物细胞色素P450家族的蛋白理化性质、结构域、识别位点、细胞定位和跨膜结构等,与其他植物CYP71蛋白的研究结果相似(Boutanaev et al., 2015; Sharafeldin et al., 2017)。根据蛋白序列的一致性可将CYP71家族分成许多分支,其中蛋白序列一致性在40%属同一家族、高于55%属同一亚家族,高于97%则属于等位基因突变体(Nelson, 2006b; Liu et al., 2016); MoCYP71与高粱中编码4-羟基苯乙醛肟单加氧酶(Bak et al., 1998)的蛋白一致性为58%,可推测MoCYP71为4-羟基苯乙醛肟单加氧酶 (Xie et al., 2017)。本研究通过聚类分析将CYP71蛋白分成4个具不同催化功能的分支,是因为CYP71家族基因在植物的进化过程中分化多样(Jorgensen et al., 2011);该聚类分析中MoCYP71蛋白与可可、中华猕猴桃、高粱等编码4-羟基苯乙醛肟单加氧酶的蛋白聚为一支,MoCYP71蛋白可能为4-羟基苯乙醛肟单加氧酶,其催化功能可能为将4-羟苯乙醛肟催化为4-羟苯乙醇腈;其余分支分别为苯醛肟单加氧酶、萜类单加氧酶及吲哚类羟化酶。基因表达分析显示MoCYP71基因在花谢后前3个月的蒜头果果实中的表达量逐渐降低,而在第4个月的表达量急剧增高,推测该基因与蒜头果果实成熟存在一定关联。综上所述,MoCYP71基因参与氰苷的生物合成、与蒜头果成熟有关;这与CYP71基因参与组织成熟,在乙烯生物过程中会形成少量氰苷(Gleadow & Moller, 2014)的研究结果一致,高粱中CYP71E1基因的表达与MoCYP71基因表达类似,即在成熟前CYP基因表达逐渐降低,而在成熟期迅速跃升的现象(Bozak et al., 1990; Jones et al., 1999; Gleadow & Moller, 2014)。当植物组织损伤时,氰苷可水解为氰酸、腈等有毒物质(Irmisch et al. 2014)以保护成熟组织免遭食草动物侵害,MoCYP71基因在蒜头果果实不同发育时期的表达亦证明了这一现象。本研究通过对蒜头果转录组的分析分离并克隆得到MoCYP71基因,对其进行生物信息学分析并检测其在不同的果实发育时期的具体表达量,为蒜头果的防御机制和蒜头果成熟研究奠定基础。
参考文献:
ANNE VINTHER M, KIRSTEN JR, CHARLOTTE JR, et al., 2008. β-Glucosidases as detonators of plant chemical defense [J]. Phytochemistry, 69(9):1795-1813.
BAK S, KAHN RA, NIELSEN HL, et al., 1998. Cloning of three a-type cytochromes P450, CYP71E1, CYP98, and CYP99 from Sorghum bicolor (L.) moench by a PCR approach and identification by expression in Escherichia coli of CYP71E1 as a multifunctional cytochrome P450 in the biosynthesis of the cyanogenic glucoside dhurrin [J]. Plant Mol Biol, 36(3):393-405.
BAK S, PAQUETTE SM, MORANT M, et al., 2008. Cyanogenic glycosides: A case study for evolution and application of cytochromes P450 [J]. Phytochem Rev, 7(1):209.
BAK S, TAX FE, FELDMANN KA, et al., 2001. CYP83B1, a cytochrome P450 at the metabolic branch point in auxin and indole glucosinolate biosynthesis in Arabidopsis [J]. Plant Cell, 13(1):101-111.
BOUTANAEV AM, MOSES T, ZI J, et al., 2015. Investigation of terpene diversification across multiple sequenced plant genomes [J]. Proc Natl Acad Sci USA, 112(1): 81-88.
BOZAK KR, YU H, SIREVG R, et al., 1990. Sequence analysis of ripening-related cytochrome P-450 cDNAs from avocado fruit [J]. Proc Natl Acad Sci USA, 87(10): 3904-3908.
GLEADOW RM, MOLLER BL, 2014. Cyanogenic glycosides: Synthesis, physiology, and phenotypic plasticity [J]. Ann Rev Plant Biol, 65(1):155-185.
GUTTIKONDA SK, JOSHI T, BISHT NC, et al., 2010. Whole genome co-expression analysis of soybean cytochrome P450 genes identifies nodulation-specific P450 monooxygenases [J]. BMC Plant Biol, 10(1):243-243.
HALKIER BA, NIELSEN HL, KOCH B, et al., 1995. Purification and characterization of recombinant cytochrome P450 tyr expressed at high levels in Escherichia coli [J]. Arch Biochem Biophys, 322(2):369-377.
HUANG KX, LAI JY, YUAN X, et al., 2008. Study on extraction and chemical analysis of the essential oil composition from leaves of Malania oleifera [J]. J Guangxi Univ (Nat Sci Ed), 33(s1):88-91. [黄开响, 赖家业, 袁霞, 等, 2008. 蒜头果叶挥发油提取工艺及其成分分析研究 [J]. 广西大学学报(自然科学版), 33(s1):88-91.]
IRMISCH S, CLAVIJO MCCORMICK A,et al., 2014. Herbivore-induced poplar cytochrome P450 enzymes of the CYP71 family convert aldoximes to nitriles which repel a generalist caterpillar [J]. Plant J, 80(6): 1095-1107.
JONES PR, MOLLER BL, HOJ PB, 1999. The UDP-glucose: p-hydroxymandelonitrile-O-glucosyltransferase that catalyzes the last step in synthesis of the cyanogenic glucoside dhurrin in Sorghum bicolor [J]. J Biol Chem, 274(50): 35483-35491.
JORGENSEN K, MORANT AV, MORANT M, et al., 2011. Biosynthesis of the cyanogenic glucosides linamarin and lotaustralin in cassava: Isolation, biochemical characterization, and expression pattern of CYP71E7, the oxime-metabolizing cytochrome P450 enzyme [J]. Plant Physiol, 155(1):282-292.
LIU X, CAO F, CAI J, et al., 2016. The molecular cloning and expression analysis of a CYP71 gene in Ginkgo biloba L. [J]. Not Bot Hortic Agrobot, 44(1):77-84.
LIU XM, LI WG, LI PY, et al., 2007. A new method for synthesis of macrocyclic lactones via Malania oleifera Chum oil [J]. Chem J Chin Univ, 28(5):897-899. [劉雄民, 李伟光, 李飘英, 等, 2007. 用蒜头果油脂合成大环内酯的新方法 [J]. 高等学校化学学报, 28(5):897-899.]
LUCK K, JIA Q, HUBER M, et al., 2017. CYP79 P450 monooxygenases in gymnosperms: CYP79A118 is associated with the formation of taxiphyllin in Taxus baccata [J]. Plant Mol Biol, 95(1):169-180.
MORANT AV, JRGENSEN K, JRGENSEN C, et al., 2008. β-glucosidases as detonators of plant chemical defense [J]. Phytochemistry, 69:1795-1813.
NELSON L, 2006a. Acute cyanide toxicity: Mechanisms and manifestations [J]. J Emerg Nurs, 32(4):S8-S11.
NELSON DR, 2006b. Plant cytochrome P450s from moss to poplar [J]. Phytochem Rev, 5(2-3):193-204.
NELSON DR, SCHULER MA, PAQUETTE SM, et al., 2004. Comparative genomics of rice and Arabidopsis. Analysis of 727 cytochrome P450 genes and pseudogenes from a monocot and a dicot [J]. Plant Physiol, 135(2):756-772.
PAQUETTE SM, BAK S, FEYEREISEN R, 2000. Intron-exon organization and phylogeny in a large superfamily, the paralogous cytochrome P450 genes of Arabidopsis thaliana [J]. DNA Cell Biol, 19(5):307-317.
RUSTLER S, MLLER A, WINDEISEN V, et al., 2007. Conversion of mandelonitrile and phenylglycinenitrile by recombinant E. coli cells synthesizing a nitrilase from Pseudomonas fluorescens EBC191 [J]. Enzy Microb Technol, 40(4):598-606.
SHARAFELDIN MAA, ELKHOLY SMF, ABDIN MZ, et al., 2017. Functional characterization of cytochrome P450 variant (CYP71) isolated from Artemisia annua L. plants [J]. IJRRAS, 6(1):22-46
TANG TF, LIU XM, LING M, et al., 2013. Constituents of the essential oil and fatty acid from Malania oleifera [J]. Ind Crops Products, 43:1-5.
XIE Y, WU L, ZHU B, et al., 2017. Digital gene expression profiling of the pathogen-resistance mechanism of Oryza sativa, 9311 in response to Bacillus amyloliquefaciens, FZB42 induction [J]. Biol Control, 110:89-97.
(責任编辑 周翠鸣)

