西番莲PeERG基因克隆及其表达模式分析
樊航 冉娜 李安定 张洪亮 胥猛


摘 要: ERA(Eecherichia coli Ras-like protein)蛋白是与已知异三聚体G蛋白和小分子G蛋白不同的一种新的GTP结合蛋白。为了在木本植物中开展其同源基因ERG(ERA-like GTPase)克隆和功能验证的相关研究,该文首次在西番莲新品种‘平塘1号中采用cDNA末端快速克隆(RACE)技术克隆鉴定1个ERG基因。结果表明:西番莲PeERG基因cDNA全长为1 518 bp,包括1 260 bp的开放阅读框、38 bp的5′-端非翻译区和220 bp的3′-端非翻译区,该基因编码蛋白由420个氨基酸残基组成,其二级结构含有丰富的α-螺旋和延伸链。PeERG蛋白不含跨膜区域,也不存在信号肽酶切位点,既在其N端有典型的GTPase保守结构域(GTPase domain)又在其C端有独特的RNA结合结构域(KH domain)。系统进化树分析表明,西番莲PeERG蛋白和水稻OsERG1、拟南芥AtERG1、大肠杆菌ERA位于同一进化分枝。实时定量PCR检测揭示PeERG基因在西番莲根、茎、叶、花、果中均有表达,叶中表达最高;同时该基因响应低温胁迫信号,其表达呈动态变化模式。该研究首次鉴定和描述了木本植物西番莲的ERG基因,为深入挖掘西番莲特异基因资源提供参考,也有助于进一步探究ERG基因在植物中的生物学功能及其作用机制。
关键词: ERA蛋白, 西番莲, RACE, 表达模式, G蛋白, 低温胁迫
中图分类号: Q943 文献标识码: A
文章编号: 1000-3142(2020)04-0509-09
Abstract: Different from the known trimetical G protein and small GTPase, ERA (Eocherichia coli Ras-like protein) is a new GTP-binding protein. In order to study cloning and functional verification of ERG (ERA-like GTPase) homologous gene in woody plants, one ERG gene was firstly isolated from a cold-tolerant variety of Passiflora edulis (‘Pingtang 1) through the rapid amplification of cDNA ends (RACE). The resutls were as follows: The full-length sequence of PeERG cDNA was 1 518 nucleotides, including a 1 260 bp open reading frame (ORF), flanked by a 38 bp 5′-untranslated region (UTR) and a 220 bp 3′-UTR. PeERG may encode a protein of 420 amino acids, and its secondary structure was rich in alpha helix and extended strand. PeERG protein did not contain both transmembrane region and signal peptidase cleavage site, and had two conserved domains: a GTPase domain and a KH domain. Phylogenetic tree revealed that PeERG was clustered into the same clade as OsERG1, AtERG1 and ERA. (4) Using real-time RT-PCR, the transcripts of PeERG were detectable in various tissues (roots, stems, leaves, flowers and fruits), and its dynamic expression pattern under low temperature stress was analyzed. Altogether, one ERG gene was isolated from woody plants for the first time. These results will be valuable for further study of the biological function of ERG in plants and enrich the excellent genetic resources of Passiflora edulis.
Key words: Eecherichia coli Ras-like protein, Passiflora edulis, RACE, expression pattern, G protein, low temperature stress
西番蓮(Passiflora edulia)属于西番莲科西番莲属草质或半木质常绿藤本植物,花朵鲜艳优美,果汁风味独特、芳香怡人,俗称百香果、激情果、番石榴、巴西果等,原产南美洲巴西至阿根廷一带。目前作为国内水果市场的“新宠”,西番莲在台湾、福建、广东、广西、海南和云南等地栽培推广(周玉娟等,2008),其商业化品种主要有紫果、黄果、黄果与紫果杂交品种等3大类,其中紫果品种在我国栽培面积最大(郑文武等,2008)。西番莲具有较高的营养价值和药用效果,其果实含有多种人体必需的氨基酸、蛋白质、还原糖、维生素等(黄苇等,2003);其果汁占鲜果重量的35%~38%,果皮占50%~55%,种子占5%~8%;干果皮中含果胶20%,粗纤维25%(张佳艳和任仙娥,2016)。西番莲果汁具有芒果、石榴、柠檬等多种水果的浓郁香味,风味独特,具有“果汁之王”的美称(曾绍校等,2014)。以西番莲为主要原材料,添加适量奶粉、胡萝卜研制出的复合保健饮料,具有高维生素高优质蛋白的特点(殷建忠等,2005)。西番莲果皮可提取色素和果胶,也可制作食用纤维和果脯;其种子含油率达21%~25%,用其压榨出的食用油品质高、人体吸收率可达90%以上,有着非常高的营养价值和经济前景(徐智和汤利,2012)。西番莲叶片水提物具有抗炎作用(Montanher et al., 2007),果肉和种子中的多酚成分具有良好的抗氧化特性(Lopez-Vargas et al., 2013);进一步的研究表明低剂量西番莲地上部分提取物有较好的抗焦虑作用,而高剂量提取物有较好的镇定作用(Deng et al., 2010; Li et al., 2011)。此外,西番莲还具有抗肿瘤、清热降火、止咳化痰等功能(Chen & Guo,1999; Liu et al., 2017)。
最早在大肠杆菌(Eecherichia coli)中发现的ERA蛋白(E. coli Ras-like protein)普遍存在于原核和真核生物(Abu et al., 1999),它是一类新的GTP结合蛋白亚家族,既在其N端有典型的GTPase保守结构域(GTPase domain),又在其C端有独特的RNA结合结构域(KH domain),从而不同于异三聚体G蛋白和单体小分子G蛋白两个亚族(Abu et al., 1999;杨青青,2010)。植物中存在ERA的同源蛋白ERG(ERA-like GTPase),Ingram et al.(1998)首次报道了金鱼草(Antirrhinum majus)的EGR蛋白及其编码基因。拟南芥(Arabidopsis thaliana)基因组中存在两个同源的ERG基因,AtERG1 和AtERG2(Suwastika et al., 2014;Cheng et al., 2018)。此外,在烟草(Nicotiana benthamiana)、拟南芥、水稻(Oryza sativa)等高等植物中也存在包含两个串联重复的GTP结合结构域(GTP-binding domain)和一个CTD结构域(C-terminal domain)的DER蛋白(Double Era-like GTPase)(Jeon et al., 2013;Cheng et al., 2018)。这些ERG基因在植物的生长发育过程中发挥重要作用。
植物ERG蛋白定位于线粒体或叶绿体,它们在植物的生长发育过程中扮演重要角色(Ingram et al., 1998;Suwastika et al., 2014;Cheng et al., 2018)。迄今,還没有木本植物ERG基因克隆和功能验证的相关报道。西番莲抗寒新品种‘平塘1号,经受过2008年中国南方雪凝冰冻极端天气的考验,是目前选育出的唯一能在贵州喀斯特山区不经任何保暖防护措施而在零下温度条件能顺利越冬的西番莲新种质。课题组前期开展了西番莲抗寒性状的分子调控模式研究(Liu et al., 2017),差异基因表达谱分析发现,ERG基因参与调控西番莲低温应答响应。本研究以此为切入点,通过RACE技术克隆西番莲ERG基因,开展该基因编码蛋白质序列的同源性比对、保守结构域及系统进化分析,并利用实时定量PCR平台检测该转录本在低温胁迫条件下的动态变化模式,为深入揭示ERG基因在植物生长发育和逆境应答响应中的生物学功能提供新思路。
1 材料与方法
1.1 植物材料及低温胁迫试验
西番莲抗寒新品种‘平塘1号材料来自于贵州省平塘县西番莲种质资源库(106°48′45.44″ E、 25°44′24.77″ N,海拔884 m),其不同组织器官根、茎、叶、花、果(R、S、L、Fl、Fr)采集于2年生的大田扦插苗。盆栽的1年生扦插苗,用于4 ℃低温胁迫及25 ℃常温恢复试验,并在其低温胁迫0 h(对照)、1 h(LST-1h)、4 h(LST-4h)、8 h(LST-8h)、24 h(LST-24h)、72 h(LST-72h)及其放置于常温恢复1 h(NTR-1h)、4 h(NTR-4h)、8 h(NTR-8h)、24 h(NTR-24h)、72 h(NTR-72h)11个时间点取其叶片用于目的基因在低温胁迫及常温恢复过程中的表达谱分析。所用三个生物学重复的上述样品经液氮速冻后保存于-80 ℃超低温冰箱备用。
1.2 总RNA提取与cDNA合成
采用天根生物科技(北京)有限公司提供的RNAprep Pure Plant Kit(TIANGEN,北京)抽提纯化植物总RNA,并用宝生物工程(大连)有限公司的PrimeScriptTMRT Master Mix(TaKaRa,大连)进行反转录合成cDNA用于后续基因表达分析。
1.3 cDNA末端快速克隆(RACE)
根据实验室前期研究获得的候选基因unigene序列(Liu et al., 2017),设计PCR引物(表1),以‘平塘1号叶片cDNA为模板,开展候选基因片段的PCR扩增和测序验证。基于测序验证获得的基因片段序列设计RACE特异引物 (表 1), 按照SMARTerTM RACE cDNA Amplification Kit操作指南进行3′-RACE和5′-RACE巢式PCR扩增,并经PCR产物回收、连接、转化、测序和拼接,预测其开放阅读框(open reading frame, ORF)。最后设计ORF扩增引物(表 1), 完成ORF的PCR扩增和测序验证。
1.4 生物信息分析
BioEdit软件用于3′-RACE和5′-RACE序列比对拼接,ORF预测借助于FGENESH软件。Expasy Protparma和ProtScale在线程序用于分析蛋白质分子量、理论等电点、氨基酸组成以及疏水性。蛋白质二级结构、三级结构、跨膜区、信号肽、亚细胞定位分别采用SPOMA、SWISS-MODEL、TMHMM 、SignalP 和Cell-Ploc2.0工具进行。序列多重比对使用Clustal X2软件。系统进化树构建采用MEGA7软件中的邻接(Neighbor Joining,NJ)法进行构建。
1.5 实时定量PCR
以来源于不同组织和不同时长低温胁迫材料的cDNA为模板,使用Power SYBR Green PCR Master Mix试剂(Thermo Fisher Scientific,美国),在ViiA 7平台上开展目的基因实时定量PCR检测。每个样品三次技术重复,以eIF-5A为内参(表1),采用 2-ΔΔCt 法进行相对表达量分析。
2 结果与分析
2.1 西番莲PeERG基因cDNA全长序列分析
经3′-RACE和5′-RACE巢式PCR扩增、测序拼接及其ORF预测与测序验证,最终获得目的基因全长cDNA序列;经NCBI数据库BLAST比对,该基因与其他植物ERG基因有较高同源性,故将其命名为PeERG。西番莲PeERG基因cDNA全长为1 518 bp,包括38 bp的5′-端非翻译区(5′-UTR)和220 bp的3′-端非翻译区(3′-UTR),其ORF长度为1 260 bp (图1)。PeERG基因在39~41位为起始密码子ATG,下游存在同框终止密码子TGA和polyA尾。
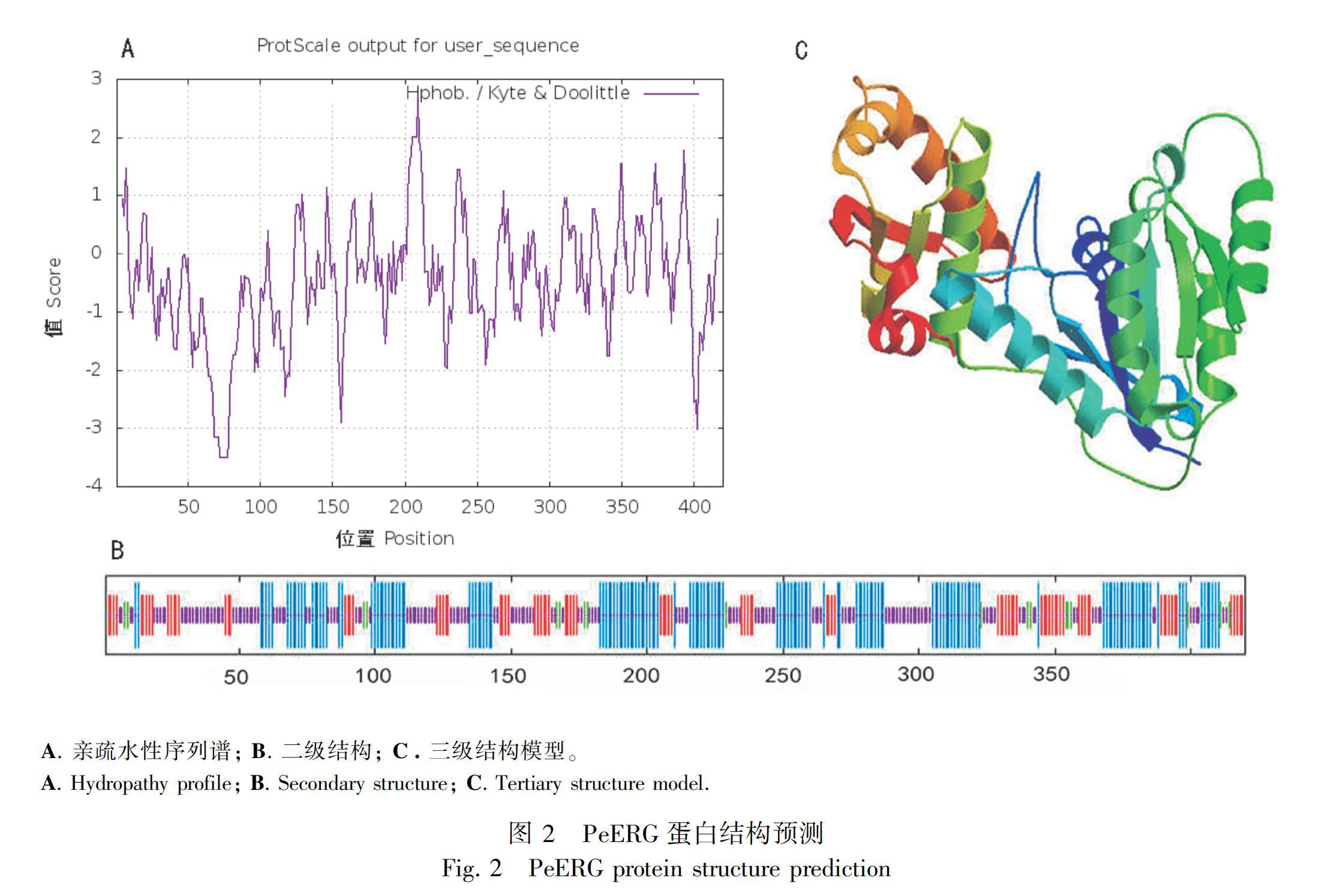
PeERG基因编码420个氨基酸,预测其编码蛋白质的相对分子量(MW)为 47.57 kD,理论等电点(pI)是5.53;带负电荷残基总数 (Asp+Glu) 为67个,带正电荷残基总数(Arg+Lys)为58个;不稳定指数(instability index) 为38.35,属于稳定蛋白;总平均亲水性(grand average of hybropathicity, GRAVY)为-0.431,预测该蛋白是亲水性蛋白。蛋白质亲疏水性序列谱见图2:A,PeERG蛋白质同时具有疏水性和亲水性区域,且亲水性氨基酸残基明显多于疏水性氨基酸残基。亲水区域最高值(Score=-3.500)出现在第86~第91个氨基酸残基, 疏水区域的最高值 (Score =2.689) 出现在第 A. 亲疏水性序列谱; B. 二级结构; C. 三级结构模型。
2.2 PeERG蛋白高级结构预测
蛋白质跨膜区(TMHMM)和信号肽分析(SignalP)结果显示,西番莲PeERG基因编码蛋白质序列不具有跨膜区域,也不存在信号肽酶切位点,推测其为非分泌、亲水性蛋白。通过Cell-PLoc2.0在线软件预测其定位于叶绿体。西番莲PeERG蛋白存在有20个Ser、12个 Thr和8个Tyr 等可能的磷酸化位点(NetPhos);其二级结构有37.62%的α-螺旋(alpha helix)、20.24%的延伸链(extended strand)、4.52%的β-转角(beta turn)和37.62%的无规则卷曲(random coil)(图2:B)。以 Swiss-Model Workspace上编号为3iev.1的模型作为模板,西番莲PeERG蛋白质与其相似性较高的氨基酸位于120~414位(图2:C)。
2.3 ERA蛋白质保守结构域分析
经NCBI数据库BLAST序列比对发现,PeERG蛋白与其他物种的ERA蛋白具有较高的同源性,与拟南芥(Arabidopsis thaliana, AtDER、AtERG2、AtERG1)、大肠杆菌(Eecherichia coli, ERA、EcDER)和水稻(Oryza sativa, OsERG1)等ERA蛋白相似(图3)。西番莲PeERG蛋白N端有典型GTPase保守结构域,该结构域由G1、G2、G3、G4、G5五个box组成,能够和鸟苷酸结合并水解GTP;同时在其C端有其特异的KH domain结构域,从而有别于异三聚体G蛋白和小分子G蛋白(small GTPase)两个亚族。
2.4 ERA蛋白系统进化树构建
为了探讨ERA蛋白在细菌、真菌、植物和动物中的系统进化关系,我们将西番莲(PeERG)、金鱼草(ERG)、拟南芥(AtERG1, AtERG2, AtDER)、番茄(Solanum lycopersicum,SlERG)、马铃薯(Solanum tuberosum,StERG)、烟草(NtERG)、黄瓜(Cucumis sativus,CsERG)、玉米(Zea mays,ZmDER)、水稻(OsERG1, OsERG2, OsDER)、斑马鱼(Danio rerio,DrERA)、小鼠(Mus musculus,MmERA)、人类(Homo sapiens,ERAL1)、大肠杆菌(ERA, EcDER)13个物种的19个ERA(ERG)同源蛋白进行多重序列比对后构建系统进化树(图4)。西番莲PeERG蛋白和水稻OsERG1、拟南芥AtERG1、大肠杆菌ERA位于同一进化分枝,PeERG与拟南芥AtERG1有更近的进化关系。
2.5 低温胁迫下PeERG基因的表达模式分析
通过荧光定量PCR进行了西番莲PeERG基因的组织表达差异分析,该基因在根、茎、花和果实中的表达量相当,而在叶中表达量最高(图5:A)。西番莲不同品种差异基因表达谱分析发现(Liu et al., 2017),PeERA基因可能参与‘平塘1号抗寒性状的分子调控。为了进一步揭示该基因低温胁迫应答的表达模式,以盆栽的1年生‘平塘1号扦插苗为材料,开展西番莲低温胁迫及常温恢复试验,并在此过程中于11个不同时间点取其叶片材料用于PeERG基因相对表达量分析。在低温胁迫及常温恢复条件,西番莲PeERG基因的表达仅有小幅度的波动,总体而言在0~24 h其表达先下降再上升,LST-4h是其低温胁迫应答最低表达,24~72 h有所下降;在恢复处理的1~72 h时,PeERG基因的表达整体上呈现先下降再上升的趋势,在NTR-8h为最低表达峰值(图5:B)。
3 讨论与结论
G蛋白是一类广泛存在于真核细胞、具有内源GTP酶活性的鸟嘌呤核苷酸结合蛋白,在动植物细胞内跨膜信号转导过程中起着“分子开关”的重要作用。ERA蛋白因其C末端存在与RNA或生物膜特异结合的KH domain结构域,有别于异三聚体G蛋白及小分子G蛋白,属于一类新的GTP结合蛋白亚家族,不僅存在大肠杆菌、酿酒酵母,而且在高等动植物以及人类细胞中均含有其同源蛋白。在原核生物中,ERA蛋白在DNA复制、蛋白质翻译以及细胞周期调控等生物学过程中发挥重要作用(Abu et al., 1999;杨青青,2010);而真核生物ERA基因起源于原核生物,两者之间的蛋白序列具有较高相似性,动物ERA蛋白参与细胞周期调控、可能与肿瘤发生密切相关(杨青青,2010)。然而,有关高等植物ERG基因克隆和功能研究的相关报道尚少。
金魚草ERG蛋白定位于线粒体,可能通过影响线粒体的分裂参与调控植株受精作用后胚珠发育成种子的过程。金鱼草ERG基因在各个组织器官中均有表达,其缺失突变体植株不能产生正常发育的种子(Ingram et al., 1998;杨青青 2010)。拟南芥中存在AtERG1和AtERG2两个ERA同源基因(杨青青,2011;Suwastika et al., 2014),其编码蛋白分别定位于叶绿体和线粒体。AtERG2基因主要在拟南芥叶脉、莲座叶表皮毛、成熟花粉和胚珠,其编码蛋白介导线粒体核糖体小亚基成熟及线粒体蛋白的翻译而调控早期种子的形成和发育(Cheng et al., 2018)。
温度是决定植物地域分布的主要限制因素。西番莲一般在热带及亚热带地区栽培,生长要求年平均气温在18 ℃以上,在低温胁迫条件下西番莲会遭到不同程度的伤害,而喀斯特山区适生品种‘平塘1号能在零下温度条件可顺利越冬。为什么‘平塘1号的抗寒性如此出众?经过前期研究发现,ERG基因在不同西番莲品种间显著差异表达(Liu et al., 2017)。以此为切入点,本研究首次从木本植物西番莲中克隆和鉴定了ERG同源基因,研究发现PeERG基因在西番莲抗寒新品种‘平塘1号的根、茎、叶、花、果中均有表达,叶中表达最高;在低温胁迫及常温恢复条件下该基因局限于低表达水平的动态变化;其编码蛋白预测定位于叶绿体,具有类似大肠杆菌ERA蛋白、金鱼草ERG蛋白、拟南芥AtERG1和AtERG2蛋白的四个保守G box和KH domain。PeERG基因在抗寒品种‘平塘1号低温胁迫条件下,其转录表达并未被低温诱导而显著性上升或下降;推测该基因分别在抗寒品种和不耐寒品种内均为组成性表达模式,品种间的差异表达显著,然而有关该基因具体的表达调控机制尚待深入研究。本研究首次在木本植物西番莲中鉴定和描述了ERG基因序列特征和表达模式,不仅有助于进一步揭示其生物学功能和作用机制,也将为深入挖掘西番莲特异种质资源提供理论基础。
参考文献:
CHENG PY, LI HJ, YUAN LL, et al., 2018. The ERA-related GTPase AtERG2 associated with mitochondria 18S RNA is essential for early embryo development in Arabidopsis [J]. Front Plant Sci, 9(182): 1-13.
COLETA M, BATISTA MT, CAMPOS MG, et al., 2006. Neuropharmacological evaluation of the putative anxiolytic effects of Passiflora edulis Sims, its sub-fractions and flavonoid constituents [J]. Phytother Res, 20(12): 1067-1073.
DENG J, ZHOU YJ, BAI MM, et al., 2010. Anxiolytic and sedative activities of Passiflora edulis f. flavicarpa [J]. J Ethnopharmacol, 128(1): 148-153.
HUANG W, HUANG Q, LUO RN, et al., 2003. Studies on seasonal variability of aroma components and principle sugar acids contents in passion fruit [J]. J S Chin Agric Univ(Nat Sci Ed), 24(4): 84-87. [黄苇, 黄琼, 罗汝南, 等, 2003. 西番莲香味及主要糖酸物质含量的季节性变化规律研究 [J]. 华南农业大学学报(自然科学版), 24(4):84-87.]
INGRAM GC, SIMON R, CARPENTER R, et al., 1998. The Antirrhinum ERG gene encodes a protein related to bacterial small GTPases and is required for embryonic viability [J]. Curr Biol, 8(19): 1079-1082.
JEON Y, AHN CS, JUNG HJ, et al., 2014. DER containing two consecutive GTP-binding domains plays an essential role in chloroplast ribosomal RNA processing and ribosome biogenesis in higher plants [J]. J Exp Bot, 65(1): 117-130.
LI HW, ZHOU P, YANG QQ, et al., 2010. Comparative studies on anxiolytic activities and flavonoid compositions of Passiflora edulis ‘edulis and Passiflora edulis ‘flavicarpa [J]. J Ethnopharmacol, 133(3): 1085-1090.
LIU SA, LI AD, CHEN CH, et al., 2017. De novo transcriptome sequencing in Passiflora edulis Sims to identify genes and signaling pathways involved in cold tolerance [J]. Forests, 8(11): 435-448.
LOPEZ-VARGAS JH, FERNANDEZ-LOPEZ J, PEREZ-ALVAREZ JA, et al., 2013. Chemical, physico-chemical, technological, antibacterial and antioxidant properties of dietary fiber powder obtained from yellow passion fruit (Passiflora edulis var. flavicarpa) co-products [J]. Food Res Int, 51(2): 756-763.
MONTANHER AB, ZUCOLOTTO SM, SCHENKEL EP, et al., 2007. Evidence of anti-inflammatory effects of Passiflora edulis in an inflammation model [J]. J Ethnopharmacol, 109(2): 281-288.
SAYED A, MATSUYAMA S, INOUYE M, 1999. Era, an essential Escherichia coli small G-protein, binds to the 30S ribosomal subunit [J]. Biochem Biophys Res Comm, 264(1): 51-54.
SUWASTIKA IN, DENAWA M, YOMOGIHARA S, et al., 2014. Evidence for lateral gene transfer (LGT) in the evolution of eubacteria-derived small GTPases in plant organelles [J]. Front Plant Sci, 5(678): 1-15.
ZENG SX, PENG B, CHEN J, et al., 2014. Study on extraction technology and basic properties of Passiflora edulis skin pigment [J]. J Chin Inst Food Sci Technol, 14(1): 104-113. [曾绍校, 彭彬, 陈洁, 等, 2014. 响应面法优化西番莲果皮花色苷提取工艺 [J]. 中国食品学报, 14(1):104-113.]
ZHOU YJ, TAN F, DENG J, 2008. Update view of Passiflora [J]. Chin J Chin Mat Med, 33(15): 1789-1793. [周玉娟, 谈锋, 邓君, 2008. 西番莲属植物的研究进展 [J]. 中国中药杂志, 33(15):1789-1793.]
YANG QQ, 2010. Era protein (E. coli ras-like protein)-A possible new molecular switch participating in the eukaryotic and prokaryotic cells signal control [J]. J Beijing Inst Edu(Nat Sci Ed), 5(2): 1-6. [楊青青, 2010. Era蛋白(E.coli ras-like Protein)——一个可能参与真、原核细胞信号调控的新分子开关 [J]. 北京教育学院学报(自然科学版), 5(2):1-6.]
YANG QQ, 2011. Initial screening of Arabidopsis exogenous ERG genes positive plants [J]. Life Sci Inst, 9(2): 53-55. [杨青青, 2011. 拟南芥外源ERG基因的阳性苗的初步筛选 [J]. 生命科学仪器, 9(2):53-55.]
(责任编辑 何永艳)

