基于Hedgehog通路探讨补肾活血方对实验性膝骨性关节炎兔退变软骨的保护作用*
贺自克,王上增,沈锦涛
(河南省中医院关节科,河南郑州450000)
膝骨性关节炎属于退行性骨关节疾病,在中老年人中患病率较高,严重影响患者生活,给家庭、社会带来一定的负担[1]。目前国内外学者主要从细胞因子、基质金属蛋白酶、免疫反应等方面探究膝骨关节炎发病机制,然而尚未有统一定论。近年来发现Hedgehog通路在膝骨关节炎的发生中扮演重要角色,研究显示Hedgehog通路激活后可诱导大鼠关节软骨损伤,而抑制Hedgehog通路活化则对软骨具有保护作用,推测Hedgehog通路在软骨退变中发挥重要作用[2]。镇痛药及非甾体药物是目前治疗膝骨关节炎常用的方法,但仅能缓解关节炎的发展,不能达到治愈的目的,因此减轻膝骨关节炎的软骨退变,诱导损伤软骨修复,是治疗膝骨关节炎的关键[3]。补肾活血方(Bushen-Huoxue prescription,BSHX)主要由熟地黄、丹参等中药组成,具有活血、镇痛、消炎、行气散寒等功效,在骨关节炎治疗中应用较多[4],然而具体作用机制目前尚不明确。本研究通过复制膝骨性关节炎动物模型,并给予BSHX干预,旨在探究BSHX对膝骨关节炎退变软骨的保护作用及可能的作用机制。
材料和方法
1 动物及药物制备
30只雄性新西兰兔,SPF级,10周龄,体质量(2.0±0.2)kg,购于河南省康华药业股份有限公司,许可证号为SYXK(豫)2017-0015,动物饲养室温为20~22℃,空气湿度为40%~60%,饲养1周后造模。
补肾活血方包含:桑寄生、积血、熟地黄、龟板、黄芪、白芍各30 g,阿胶、怀牛膝、补骨脂各20 g,地龙15 g,丹参、仙鹤草、当归各10 g。加水浸泡上述药材,温火煎煮1 h,过滤后加水再次煎煮30 min,收集两次药液,浓缩后依据人与兔体表面积换算法,给药剂量为1.86 g/kg(生药量)[5]。
2 主要试剂及仪器
Hedgehog通路激活剂 SAG(912545-86-9)购于MCE;TRIzol试剂(DP424)购于北京天根生化科技有限公司;BCA检测试剂盒(SP900)、RIPA裂解液(PP1901)、免疫组化检测试剂盒(PV6000)、HE染色试剂盒(C0105)及 TNF-α(PT516)和IL-Iβ(PI130)检测试剂盒均购于碧云天生物技术研究所;番红O染色试剂盒(G1371)购于北京索莱宝有限公司;兔抗Shh抗体(SAB2108581)、Ptch1抗体(SAB2501613)、Smo抗体(SAB1412475)、Gli1抗体(HPA068903)和β-actin抗体(A5316)均购于Sigma-Aldrich;兔抗基质金属蛋白酶13(matrix metalloprotein-13,MMP-13)抗体(ab237604)和II型胶原(collagen type II,Col-II)抗体(ab198200)购于Abcam。2500凝胶成像仪和EPS300垂直电泳仪购自于Bio-Rad。
3 主要方法
3.1 动物模型制备 从30只新西兰兔中随机抽取6只作为对照(control)组,其余24只参照Hulth法[6]制备膝骨关节炎模型,模型组兔仰卧手术台,麻醉后去除右肢后方膝关节内侧绒毛,于髌骨内制做纵向1 cm切口,逐层剥离后暴露内侧副韧带并剪断,切开关节囊将内侧半月板完全切除,同时将前后交叉韧带剪断,用生理盐水冲洗关节,消毒后缝合切口,采用无菌敷料加压固定。造模后连续3天注射青霉素(8×104U/d),隔天换药,2周后拆线,兔出现典型膝骨性关节炎表现(关节肿胀,关节活动度降低,皮温升高),则视为模型成功。control组兔仅进行麻醉,切开膝关节皮肤,不做其它处理。
3.2 动物分组与给药 造模8周后,将24只模型兔分为模型组(model组)、BSHX组、SAG组和BSHX+SAG组,每组6只。BSHX组:灌胃BSHX,剂量为1.86 g/kg;SAG组:灌胃SAG溶液,剂量为20 mg/kg[7]。BSHX+SAG组:灌胃 1.86 g/kgBSHX与 20 mg/kg SAG。Control组和model组灌胃等量生理盐水。各组均连续给药8周。
3.3 兔膝关节宽度则定 末次给药结束后,由两名工作人员用标尺测量各组兔膝关节宽度,记录数据,重复测量3次,求取平均值。
3.4 膝关节大体情况观察 各组兔处死后获得右膝关节,观察软骨表面颜色、光滑度、光泽、溃疡等变化,依据Pelletier评分[8]对软骨退变情况进行评定;参照软骨分级标准[9],将软骨表面状态分为4个等级,等级越高代表软骨退变越严重。
3.5 软骨组织病理形态学观察 截取胫骨近端1/4处到股骨远端1/4处膝关节,一部分膝关节软骨组织置于-80℃保存,另一部分膝关节软骨组织10%多聚甲醛固定。取出固定软骨组织,经脱钙、水合、透明、石蜡包埋后制备膝关节软骨组织石蜡切片,厚度为5 μm,参照试剂盒进行HE染色和番红O染色。依据Mankin评分[10]对兔膝关节软骨组织细胞、潮线、基质染色等情况进行评定,评分为0~13分,评分越高,代表软骨组织退变越严重。
3.6 酶联免疫法检测软骨组织匀浆中TNF-α和IL-1β水平 从-80℃冰箱取出软骨组织,称取1 mg,添加9 mg/L生理盐水,在匀浆器内制备组织匀浆液,5 000×g离心10 min,收集上清,采用酶联免疫检测试剂盒对TNF-α和IL-1β水平进行测定。
3.7 免疫组化法检测软骨组织中MMP-13和Col-II蛋白表达 将石蜡切片烘烤后,经脱蜡、水合后在热柠檬酸盐缓冲液中修复2 min,添加3%过氧化氢室温下反应15 min,添加山羊血清封闭抗原后,室温下加入I抗(1∶500稀释),4℃冰箱中孵育16~18 h,添加II抗(1∶5 000稀释)室温下孵育1 h,DAB显色后,水洗添加苏木素染色、温水返蓝,切片经脱水、透明、中性树脂封片后在显微镜下观察蛋白染色情况,MMP-13和Col-II主要定位在细胞质内,细胞质内出现棕黄色或棕褐色视为阳性染色细胞。采用ImageJ软件定量评估阳性表达率,阳性表达率(%)=细胞阳性数/细胞总数×100%。
3.8 Western blot法检测软骨组织中Shh、Ptch1、Smo和Gli1蛋白表达 采用RIPA裂解液提取膝关节软骨组织全蛋白,BCA法检测总蛋白浓度,经SDSPAGE后,将目的蛋白转移至PVDF膜上,用脱脂奶粉封闭膜后,I抗(抗Shh、Ptch1、Smo和Gli1抗体,均1∶500稀释)4℃孵育膜过夜,用II抗室温孵育膜1 h,经ECL发光液显色后,在凝胶成像仪中采集保存图像,以β-actin为内参照,利用ImageJ软件分析蛋白相对表达量。
4 统计学处理
本研究数据采用SPSS 22.0软件进行分析。计量资料以均数±标准差(mean±SD)描述,多组间均数比较采用单因素方差分析,进一步两两对比采用SNK-q检验。当P<0.05时认为差异有统计学意义。
结 果
1 兔膝关节一般情况
肉眼观察可见,control组兔膝关节大体正常,未出现畸形、肿胀等;model组兔膝关节出现肿胀,皮肤充血,行走出现轻微跛行;经BSHX治疗后,膝关节肿胀和皮肤充血均得到一定缓解,无明显跛行;SAG干预后兔膝关节肿胀、充血更为严重,出现较明显跛行;BSHX+SAG组兔膝关节得到缓解,但效果不显著。与control组相比,model组膝关节宽度显著增大(P<0.05);与model组相比,BSHX组膝关节宽度显著减小,SAG组膝关节宽度显著增大(P<0.05);BSHX+SAG组膝关节宽度显著小于SAG组(P<0.05),见表1。

表1 各组兔膝关节宽度对比Table 1.Comparison of knee joint swelling in rabbits of each group(Mean±SD.n=6)
2 膝关节软骨大体情况
与control组相比,model组软骨退变评分和软骨分级显著升高(P<0.05);与model组相比,BSHX组软骨退变评分和软骨分级显著降低,SAG组软骨退变评分和软骨分级显著升高(P<0.05);BSHX+SAG组软骨退变评分和软骨分级显著低于SAG组(P<0.05),见表2。

表2 各组兔软骨退变情况比较Table 2.Comparison of cartilage degeneration in rabbits in each group(Mean±SD.n=6)
3 膝关节病理形态学观察
HE和番红O染色均显示,control组软骨组织结构清晰,骨膜完整光滑,细胞排列整齐,潮线完整清晰,染色均匀;model组软骨组织结构不清晰,细胞排列紊乱,体积增大,潮线不清晰,细胞质基质染色变浅;经BSHX干预后软骨组织及细胞形态均得到一定改善,细胞质基质染色变深;SAG组软骨表层损伤较严重,细胞成簇增殖,形态不规则,潮线不完整或消失,细胞质基质染色不均;BSHX+SAG组软骨组织及细胞形态损伤有所减轻,但变化不显著,见图1、2。
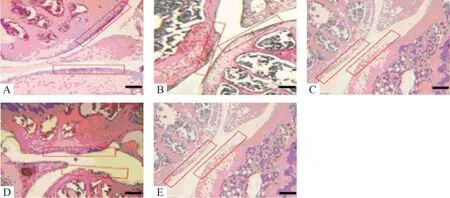
Figure 1.The pathological changes of cartilage tissues observed by HE staining(scale bar=50 μm).The articular cartilage is indicated by the box.A:control group;B:model group;C:BSHX group;D:SAG group;E:BSHX+SAG group.图1 HE染色观察软骨组织病理学变化
与control组相比,model组Mankin评分显著升高(P<0.05);与model组相比,BSHX组Mankin评分显著降低,SAG组Mankin评分显著升高(P<0.05);BSHX+SAG组Mankin评分显著低于SAG组(P<0.05),见表3。

Figure 2.The pathological changes of cartilage tissues observed by safranine O staining(scale bar=50 μm).A:control group;B:model group;C:BSHX group;D:SAG group;E:BSHX+SAG group.图2 番红O染色观察软骨组织病理形态学

表3 各组软骨组织Mankin评分比较Table 3.Comparison of Mankin score of cartilage tissue in each group(Mean±SD.n=6)
4 BSHX对软骨组织TNF-α和IL-1β的影响
与control组相比,model组软骨组织中TNF-α和IL-1β 水平显著升高(P<0.05);与 model组相比,BSHX组软骨组织中TNF-α和IL-1β水平显著降低,SAG组软骨组织中TNF-α和IL-1β水平显著升高(P<0.05);BSHX+SAG组软骨组织中TNF-α和IL-1β水平显著低于SAG组(P<0.05),见表4。

表4 各组软骨组织中TNF-α和IL-1β水平比较Table 4.Comparison of TNF-α and IL-1β levels in cartilage tissue of each group(ng/L.Mean±SD.n=6)
5 BSHX对软骨组织MMP-13和Col-II表达的影响
与control组相比,model组软骨组织中MMP-13阳性表达率显著升高,而Col-II阳性表达率显著降低(P<0.05);与 model组相比,BSHX 组软骨组织中MMP-13阳性表达率显著降低,Col-II阳性表达率显著升高,SAG组软骨组织中MMP-13阳性表达率显著升高,Col-II阳性表达率显著降低(P<0.05);BSHX+SAG组软骨组织中MMP-13阳性表达率显著低于SAG组,Col-II阳性表达率显著高于SAG组(P<0.05),见图3及表5。

Figure 3.Immunohistochemical staining for MMP-13 and Col-II expression in cartilage tissues(SP method,scale bar=100 μm).A:control group;B:model group;C:BSHX group;D:SAG group;E:BSHX+SAG group.图3 免疫组化检测软骨组织中MMP-13和Col-II的表达

表5 各组软骨组织MMP-13和Col-II阳性表达率的比较Table 5.Comparison of positive expression rates of MMP-13 and Col-II in cartilage tissue of each group(%.Mean±SD.n=6)
6 BSHX对软骨组织中Hedgehog通路表达的影响
与control组相比,model组软骨组织中Shh、Ptch1、Smo和Gli1蛋白表达显著升高(P<0.05);与model组相比,BSHX组软骨组织中Shh、Ptch1、Smo和Gli1蛋白表达显著降低,SAG组软骨组织中Shh、Ptch1、Smo和Gli1蛋白表达显著升高(P<0.05);BSHX+SAG组软骨组织中Shh、Ptch1、Smo和Gli1蛋白表达显著低于SAG组(P<0.05),见图4及表6。

Figure 4.The protein expression of Shh,Ptch1,Smo and Gli1 in cartilage tissues detected by Western blot.A:control group;B:model group;C:BSHX group;D:SAG group;E:BSHX+SAG group.图4 Western blot检测软骨组织中Shh、Ptch1、Smo和Gli1蛋白表达

表6 各组软骨组织中Shh、Ptch1、Smo和Gli1蛋白表达比较Table 6 Comparison of protein expression of Shh,Ptch1,Smo and Gli1 in cartilage tissue of each group(Mean±SD.n=6)
讨 论
膝骨关节炎是以软骨变性、关节周围骨质增生为特征的慢性关节炎症性疾病[11]。本研究通过采用Hulth手术造模法复制兔膝骨关节炎模型,手术切除膝关节前交叉韧带、关节内侧副韧带等造成关节力学失稳,诱发膝骨关节炎,与临床发病机制相似[12]。本研究结果表明,与control组相比,model组兔出现膝关节肿胀、宽度增加、活动减小等膝骨关节炎典型特征。关节软骨退变为膝骨关节炎的主要病理特征,关节负重前侧软骨发生糜烂后,软骨细胞密度增高,随后软骨结构紊乱,潮线消失或上移。本研究显示,model组软骨退变评分和软骨分级显著升高,HE染色观察到软骨表面不平滑、粗糙,出现一定溃疡,结构不清晰,细胞排列紊乱,体积增大,潮线不清晰,细胞质基质染色变浅,Mankin评分显著升高,与以往膝关节炎动物病理检测结果相似[13],提示兔膝骨关节炎模型制备成功。
膝骨关节炎在中医中属于骨痹、痹症、瘀证等范畴,中医认为膝部受风寒后滞于患处,长久凝集使筋脉损伤、痉挛,造成关节功能障碍,此外体虚、肝肾功能较弱会影响机体气血运行,造成气凝滞于关节,因此治疗该病的关键在于补肾活血[14]。补肾活血方主要由桑寄生、积血、熟地黄、龟板等组成,该方中熟地黄具有滋阴补血功效,丹参具有活血消肿的功效,整方具有补肾活血之功效。研究表明,BSHX能够提高骨性关节炎治疗效果,显著减轻患者关节疼痛程度[15]。本研究表明,与model组相比,BSHX组兔膝关节退变评分、软骨分级降低,HE染色显示关节软骨组织、细胞形态均得到一定缓解,细胞质基质染色变均匀,提示BSHX可减轻兔膝关节炎软骨损伤,延缓关节软骨退变,然而具体机制尚不清楚。
关节软骨细胞微环境由多型胶原、关节液及细胞外基质组成,其中Col-II是含量最高的胶原之一,正常生理状态下软骨细胞主要分泌Col-II,I型胶原(collagen type I,Col-I)分泌极少,而软骨受损后,细胞微环境发生变化,会导致胶原蛋白变化,造成Col-II含量降低,Col-I含量升高,进而改变软骨结构[16]。本研究显示model组Col-II蛋白阳性表达率显著降低,给予BSHX后Col-II蛋白阳性率明显升高,提示膝骨关节炎兔软骨组织结构发生异常,BSHX可以通过上调Col-II含量而促进软骨修复。炎症因子与膝骨关节炎的发生、发展密切相关。有研究证实,TNF-α和IL-Iβ活化后放大炎症反应,降低软骨组织中Col-II含量,诱导基质中MMP-13的释放,降解完整的Col-II[17]。本研究显示,model组 TNF-α和IL-Iβ 水平及MMP-13阳性表达率升高,给予BSHX后TNF-α和IL-Iβ水平及MMP-13阳性表达率降低,提示BSHX可能通过减弱软骨组织炎症反应,维持细胞外基质胶原平衡,发挥对软骨组织的保护作用。
Hedgehog通路与软骨组织的发育、增殖、分化等密切相关。该通路主要由4个部分组成,包括:Hh蛋白家族(Shh、Dhh和Ihh),跨膜受体Ptch1和Smo,转录因子Gli1。正常情况下Ptch1与Smo相互作用后抑制Smo活性,当Hh蛋白与Ptch1结合后能够解除Ptch1对Smo的抑制,引发通路活化,激活转录因子Gli1进入细胞核调节下游靶基因转录[18]。既往研究表明,Hedgehog通路异常激活与骨性关节炎的发生及软骨损伤程度相关[19]。Thompson 等[20]的研究表明,Shh蛋白在正常人的软骨中几乎不表达,在软骨损伤初期,该蛋白水平明显升高。动物研究报道,TGF-β II型受体显性负突变体小鼠软骨组织中Shh蛋白表达升高,同时小鼠出现软骨细胞肥大等与人骨关节炎损伤相似的表现[21]。Zhou等[22]通过动物研究表明,Hh通路蛋白表达越高,膝骨关节损伤越严重,而采用Hh信号通路抑制剂处理后大鼠软骨损伤减轻。本研究显示,与control组相比,model组Shh、Ptch1、Smo和Gli1蛋白表达显著升高,给予BSHX干预后Shh、Ptch1、Smo和Gli1蛋白降低,推测BSHX可能通过抑制Hedgehog通路的活化,进而发挥对膝骨关节炎软骨损伤的保护作用。为证实这一推测,本研究采用Hedgehog通路激活剂SAG处理兔模型组,其结果表明,SAG组膝关节软骨损伤更严重,关节软骨退变评分和Mankin病理评分进一步升高,TNF-α、IL-1β和MMP-13表达升高,Hedgehog通路蛋白表达升高;而给予SAG联合BSHX处理后,兔膝关节软骨损伤有所减轻,关节软骨退变得到缓解,TNF-α、IL-1β和MMP-13表达降低,提示BSHX可通过抑制Hedgehog通路进而缓解膝骨关节炎兔软骨退变,抑制软骨细胞外基质胶原失衡,减弱炎症反应,发挥对软骨组织的保护作用。
综上所述,补肾活血方可抑制Hedgehog通路活化,延缓膝骨关节软骨退变,减弱关节炎症反应,维持软骨细胞外基质胶原平衡。这可能为膝骨关节炎治疗提供新的思路。然而膝骨关节炎发生机制较复杂,补肾活血方具体通过Hedgehog通路下游哪些靶基因发挥作用,尚待后续深入探究。

