不同剂量右旋美托咪定预处理对体外循环瓣膜置换术病人脑氧代谢的影响
心脏瓣膜病为临床常见的心脏疾病,体外循环(cardiopulmonary bypass,CPB)下心脏瓣膜置换术是临床治疗该病的主要外科手段,CPB是手术中需借助的特殊血液处理装置,可完成血液循环、氧气输送等的一种技术[1-4]。CPB出现加之心脏瓣膜置换手术成熟、监测技术及麻醉药物和方法不断地发展,有效改善心脏手术的并发症和发病率。CPB极大地促进心脏外科发展,其在心脏手术中发挥重要作用[5-6]。在临床应用中,CPB使机体处于应激状态,诱导较多并发症,尤其脑损伤发病率较高,导致认知功能障碍或亚临床症状脑损伤,因而严重影响病人生活质量[7-9]。因此,心脏疾病手术中,需采取一定措施度过体外循环围术期。近年来,临床将右美托咪定作为CPB下心脏瓣膜置换术的常用药物,并证实其具有脑保护作用。右美托咪定作为α2肾上腺素能受体激动剂,具有辅助镇静和镇痛等作用[10-11]。本研究探讨不同剂量右美托咪定对CPB瓣膜置换术病人脑代谢的影响,为临床安全有效地应用右美托咪定,寻找右美托咪定脑保护的最佳剂量提供理论依据。
1 资料与方法
1.1 一般资料 选取2017年8月—2018年12月我院CPB下行心脏瓣膜手术病人40例,并记录性别、年龄、体质指数和CPB时间。按随机数字表法分为对照组、右美托咪定0.3μg/(kg·h)组(D1组)、右美托咪定0.5 μg/(kg·h)组(D2组)和右美托咪定0.7 μg/(kg·h)组(D3组),每组10例。所有病人均签署知情同意书,且本研究经医院医学伦理委员会批准。
1.2 纳入标准 风湿性心脏病拟行择期心内直视二尖瓣膜置换术;可耐受手术和麻醉;美国麻醉医师协会分级Ⅱ~Ⅲ级;生命体征平稳,肝、肾功能正常,凝血功能正常,意识清楚。
1.3 排除标准 年龄>70岁,既往患有心肌梗死;存在房室传导阻滞;存在凝血功能障碍;术前2周内使用激素及抗凝药物;合并严重脏器病变、其他恶性肿瘤和自身免疫性疾病病人;存在严重心律失常;放弃治疗、失访或不配合治疗。
1.4 麻醉方法 所有病人进入手术室前肌内注射鲁米那100 mg。进入手术室后行常规监测吸氧,并在局部麻醉下行桡动脉穿刺测定血压,监测脑氧饱和度。右美托咪定2 mL∶200 μg加入生理盐水48 mL混合稀释为4 μg/mL。D1组、D2组和D3组于麻醉诱导前30min静脉泵注右美托咪定0.3μg/(kg·h)、0.5 μg/(kg·h)、0.7 μg/(kg·h),对照组泵注等量生理盐水。待30 min泵注完毕后,行麻醉诱导:长托宁0.01 mg/(kg·h),咪达唑仑0.03~0.05 mg/(kg·h),舒芬太尼0.05 μg/(kg·h),依托咪酯0.3 mg/(kg·h)、罗库溴铵0.6 mg/(kg·h)进行诱导并完成气管插管。插管后行右颈内静脉向上穿刺置管至颈内静脉球部。术中应用舒芬太尼,罗库溴安维持麻醉,术中脑电双频指数(BIS)维持在40~60。
1.5 观察指标 分别在基础状态(T1)、CPB前(T2)、CPB后5 min(T3)、低温稳定期鼻咽温(NPT)28~30 ℃时(T4)、复温至NPT 34 ℃时(T5)、CPB后10 min(T6)及手术结束时(T7)各时间循环状态,并留取2 mL桡动脉血和颈内静脉球部血行血气分析,测定颈内静脉球血氧饱和度(SjvO2),脑动-颈内静脉血氧含量差(Da-jvO2)及脑氧摄取率(CERO2)。
2 结 果
2.1 4组一般资料比较(见表1)
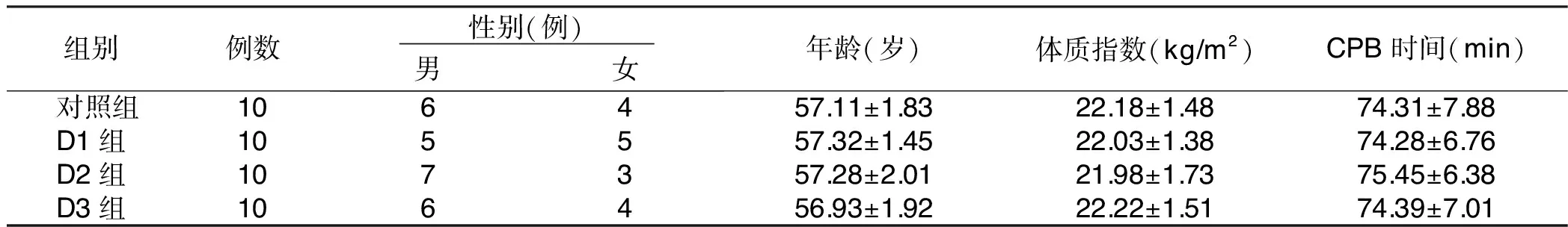
表1 4组一般资料比较
注:4组各项比较,P>0.05。
2.2 4组不同时间SjvO2比较 D2组T3、T4、T5、T6和T7各时间SjvO2均高于对照组、D1组和D3组,差异有统计学意义(P<0.05)。详见表2。

表2 4组不同时间SjvO2比较 (±s) 单位:%
与D2组比较,①P<0.05。
2.3 4组不同时间Da-jvO2比较 D2组T3、T4、T5和T6各时间Da-jvO2均低于对照组、D1组和D3组,差异有统计学意义(P<0.05)。详见表3。

表3 4组不同时间Da-jvO2比较 (±s) 单位:mmHg
注:1 mmHg=0.133 kPa。与D2组比较,①P<0.05。
2.4 4组不同时间CERO2比较 D2组T3、T4、T5和T6各时间CERO2均低于对照组、D1组和D3组,差异有统计学意义(P<0.05)。详见表4。

表4 4组不同时间CERO2比较 (±s) 单位:%
与D2组比较,①P<0.05。
3 讨 论
脑损伤是CPB下心脏瓣膜置换术后的主要并发症,脑损伤状况与脑氧代谢和氧合状态密切相关[12]。其中SjvO2、Da-jvO2和CERO2是目前临床监测脑代谢的重要指标。SjvO2反映脑血流量及氧供状态,其升高提示脑氧摄取降低或脑血供增加;Da-jvO2和CERO2反映脑摄氧能力,这两项指标降低提示脑氧摄取水平下降,脑血流相对耗氧量存下剩余[13]。本研究CPB开始后,SjvO2升高,Da-jvO2和CERO2降低,说明CPB操作开始后,病人体温下降,因此,脑基础代谢下降,予以右美托咪定诱导的3个组别中,CPB开始后,D2组SjvO2升高、Da-jvO2和CERO2降低较其他组更优。
右美托咪定为参与脑保护作用的主要受体亚型。右美托咪定对潜在的缺血性脑损伤保护作用已在多种脑缺血动物模型中得到证实。大量动物实验脑缺血模型证实,右美托咪定具有脑保护作用[14-16]。随着动物实验的成功,逐步开展人体临床试验。右美托咪定抗脑损伤机制包括:降低儿茶酚胺类物质释放,从而减轻对神经元毒性,发挥保护作用;减轻兴奋性氨基酸毒性,抑制兴奋性递质释放,从而抑制肾上腺素β受体活性,降低神经元代谢率;刺激星形胶质细胞,使得其上皮生长因子受体的配体脱落,通过旁分泌作用激活邻近星形胶质细胞核邻近神经元上皮生长因子受体,引起细胞外信号调节激酶磷酸化,促进细胞存活并抑制细胞凋亡;抑制缺血期次黄嘌呤生成及再灌注期丙二醛生成,从而抑制缺血再灌注损伤;抑制炎症因子释放,具有明显的抗炎作用,保护器官;对心脏病病人镇静具有良好效果,对围术期心律失常有一定的预防作用[17-20]。右美托咪定通过上述机制在脑缺血过程中起到神经保护作用。
人体临床试验提示,神经外科病人围术期应用对脑血流动力学无不良影响,具有良好的安全性。相关研究认为,心脏病病人使用右美托咪定应避免首次大剂量应用,推荐用量0.3~0.7 μg/(kg·h)[21]。本研究发现相对0.7 μg/(kg·h),右美托咪定0.5 μg/(kg·h)为最佳剂量,可较好地发挥脑保护作用,精确体外循环心脏手术中的应用剂量,可为临床安全有效地应用右美托咪定提供依据。

