地榆皂苷Ⅱ对H2O2诱导H9C2心肌细胞株凋亡的保护机制研究
心力衰竭是多种心血管疾病发展的终末阶段,目前已成为仅次于恶性肿瘤且严重危害人类健康的主要疾病[1]。治疗心力衰竭主要目的是防止并延缓疾病发生发展,减轻临床症状,提高病人生存质量,改善长期预后。有研究显示,心肌细胞株凋亡是心力衰竭发生发展的重要病理基础[2],而氧化应激反应在心肌细胞株凋亡中发挥关键作用[3]。中医中药治疗心血管疾病作用已得到临床证实,因其安全、与西药协同治疗效果显著被广泛应用[4]。中药作用机制复杂多样,多项研究表明,中药可有效抑制心肌细胞株的氧化应激反应,地榆皂苷Ⅱ是从地榆中分离的三萜皂苷类化合物,药理研究发现其具有抗氧化应激、抑制细胞凋亡,并抗炎、消肿、止泻和抗溃疡作用[5-6];地榆皂苷Ⅱ可有效改善化疗、放疗对癌症病人造成的外周血细胞减少[7]。但地榆皂苷Ⅱ是否可抑制心肌细胞株的氧化应激反应研究报道较少。本研究探讨地榆皂苷Ⅱ对H2O2诱导的大鼠H9C2心肌细胞株凋亡的作用机制。
1 材料与方法
1.1 实验材料 地榆皂苷Ⅱ购自上海纯优技术有限公司(货号:PO792),分子式:C15H12O6;H9C2心肌细胞株购自中科院上海细胞库;细胞培养采用达尔伯克改良伊格尔培养基(DMEM)、胎牛血清、0.25%胰蛋白酶、青链霉素双抗购自Gibco公司;采用四甲基偶氮唑盐微量酶反应比色法(MTT)试剂及流式细胞盒购自碧云天技术(上海)有限公司;细胞裂解液购自上海联迈生物工程有限公司;抗甘油醛-3-磷酸脱氢酶(GAPDH)鼠单克隆抗体,Bax、半胱氨酸蛋白酶-3(Caspase-3)、半胱氨酸蛋白酶-9(Caspase-9)、细胞磷酸化的细胞外信号调节激酶(p-ERK1/2)、卵黄状黄斑病蛋白3(Bestrophin3)、细胞外信号调节激酶(REK1/2)抑制剂LY3214996购自英国Abcam公司。
1.2 方法
1.2.1 细胞培养 使用含有10%胎牛血清的DMEM培养基培养H9C2心肌细胞株,培养箱设置条件37 ℃,5%CO2,湿度为95%,每两天换液1次,细胞密度达到培养皿90%时进行传代培养,传代密度为1×104个/mL。
1.2.2 实验分组及处理 对照组(H9C2组)、H2O2组(DMEM培养基培养24 h后加入150 μmol/L的H2O2处理2 h)、地榆皂苷Ⅱ组、地榆皂苷Ⅱ+H2O2组(30 μg/mL地榆皂苷Ⅱ培养24 h,再加入150 μmol/L的H2O2处理2 h)。
1.3 MTT法测定地榆皂苷Ⅱ细胞毒性 采用二甲基亚砜(DMSO)配制100 μg/mL地榆皂苷Ⅱ溶液,置于4 ℃冰箱中保存。取对数生长期细胞,消化为单细胞悬液。以每孔100 μL铺96孔板(5×103/孔)接种于96孔板中,每孔100 μL,放入含5%CO2的37 ℃恒温培养箱中培养至细胞密度达到75%,向每孔中加入不同浓度地榆皂苷Ⅱ(分别为5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、100 μg/mL),每个浓度6个复孔。培养24 h后每孔加入10 μL MTT溶液(5 g/L),继续培养4 h后弃上层培养基加入DMSO溶液100 μL,摇床37 ℃震摇10 min于450 nm波长用酶标仪测定各孔吸光度(OD值)。细胞增殖抑制率(%)=(OD对照组-OD加药组)/(OD对照组-OD空白组)×100%。
1.4 MTT法测定地榆皂苷Ⅱ对心肌细胞株保护作用 取对数生长期的心肌细胞株每孔100 μL接种于96孔板(5×103/孔),在37 ℃、CO2体积分数为5%的细胞培养箱中培养24 h,每组设置6个复孔,以只加DMEM培养液为对照组(H9C2组),实验组加入不同浓度地榆皂苷Ⅱ,对照组加入等体积DMEM溶液,培养24 h后,对照组与实验组加入等体积150 μmol/L的H2O2溶液,对照组加入等体积的磷酸缓冲盐溶液(PBS),培养2 h后,利用MTT方法,酶标仪450 nm测定,计算心肌细胞株活性。
1.5 流式细胞技术检测细胞活性 取对数生长期心肌细胞株按 5×105/孔的密度接种于6孔板,贴壁后,按1.2所述方法分组及处理,每组3个复孔,处理孵育完毕后胰酶消化收集细胞,PBS冲洗3遍,根据凋亡检测试剂盒protocol,重悬于5 μL的异硫氰酸荧光素(Annexin V-FITC)集合液中,充分混匀加入5 μL 碘化丙啶(PI)轻柔充分吹打均匀后室温避光条件下反应20 min,对细胞进行染色、孵育。流式细胞仪检测细胞凋亡率。
1.6 荧光显微镜测定活性氧(ROS) 取对数生长期心肌细胞株按2×105/孔的密度接种于24孔板,贴壁后,按1.2所述方法分组及处理,参照ROS试剂盒protocol,注意避光操作,使用无血清培养基按照1︰1000比例稀释2′,7′-二氯荧光黄双乙酸盐(DCFH-DA),最终浓度为10 μmol/L,去除6孔板内培养基,每孔各
加入1 mL DCFH-DA(10 μmol/L),放于细胞培养箱内孵育30 min。使用无血清DMEM培养液洗涤3次以去除未进入细胞内的DCFH-DA;之后在荧光显微镜下观察,绿色荧光强度代表ROS。
1.7 蛋白质印迹法(WesternBlot)检测凋亡蛋白及p-ERK1/2、Bestrophin3表达 取对数生长期心肌细胞株按2×105/孔密度接种于24孔板,贴壁后,按1.2所述方法分组及处理,采用牛血清白蛋白(BCA)法进行蛋白定量。蛋白样品在恒温水浴锅中煮沸5 min,将蛋白变性。蛋白样品经聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离后,转移至硝酸纤维素膜上。根据蛋白Marker位置切出目的蛋白所在条带,置于5%脱脂奶粉配制的封闭液中封闭2 h;4 ℃条件下,目的条带和一抗孵育过夜;使用磷酸缓冲盐水-吐温溶液(PBS-T)洗涤5 min,重复3次,洗去条带上残留一抗;室温下将目的条带和二抗孵育2 h;使用免疫印迹化学发光试剂盒,在核酸蛋白成像仪下显影,分析细胞凋亡相关蛋白Bax、Caspase-3、Caspase-9表达情况,并分析各组差异。
1.8 ERK1/2与Bestrophin3之间的关系 为明确ERK1/2与Bestrophin3关系分组为:H9C2组、H2O2组、地榆皂苷Ⅱ+H2O2组及地榆皂苷Ⅱ+抑制剂组,前3组处理方法同1.5所述方法,地榆皂苷Ⅱ+抑制剂组在药物处理前应用抑制剂LY3214996预先处理30 min,之后加入30 μg/mL地榆皂苷Ⅱ作用24 h,再加入H2O2处理2 h后收集蛋白,利用Western Blot法检测表达量变化。
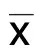
2 结 果
2.1 不同浓度地榆皂苷Ⅱ对H9C2心肌细胞活性的影响 应用MTT法测定不同浓度地榆皂苷Ⅱ对H9C2心肌细胞株活性的影响,不同浓度地榆皂苷Ⅱ培养24 h后H9C2心肌细胞株活性保持在85%以上,说明地榆皂苷Ⅱ在一定浓度范围对H9C2无细胞毒性。详见图1。

图1 不同浓度地榆皂苷Ⅱ对H9C2心肌细胞株活性的影响
2.2 地榆皂苷Ⅱ对心肌细胞株的保护作用 与H9C2组比较,H2O2组H9C2心肌细胞存活率明显降低,说明H2O2诱导心肌细胞株凋亡造模成功。加入不同浓度地榆皂苷Ⅱ后发现细胞活性明显提高,且随着地榆皂苷Ⅱ作用浓度增高,细胞活性随之升高;地榆皂苷Ⅱ浓度达到20 μg/mL及以上时,与H2O2组比较差异有统计学意义(P<0.05),表明地榆皂苷Ⅱ可有效减弱H2O2诱导的细胞凋亡作用,并与作用浓度呈正相关。详见图2。
与H2O2组比较,*P<0.05。
2.3 流式细胞技术检测心肌细胞株凋亡率 H9C2组心肌细胞株凋亡率为(5.20±1.12)%,与地榆皂苷Ⅱ组(10.90±1.56)%比较,差异无统计学意义(P>0.05);H2O2组心肌细胞株凋亡率为(46.70±3.04)%,高于H9C2组,差异有统计学意义(P<0.05);地榆皂苷Ⅱ+H2O2组心肌细胞株凋亡率为(34.09±2.89)%低于H2O2组,差异有统计学意义(P<0.05)。说明地榆皂苷Ⅱ可有效抑制H2O2对心肌细胞株的损伤。详见图3。

图3 流式细胞术检测地榆皂苷Ⅱ作用于H9C2心肌细胞株凋亡率
2.4 地榆皂苷Ⅱ对ROS的影响 H2O2组H9C2心肌细胞株绿色荧光多于H9C2组(P<0.05),说明H2O2通过诱导ROS产生进而促进H9C2心肌细胞株凋亡;地榆皂苷Ⅱ+H2O2组荧光强度明显少于H2O2组,差异有统计学意义(P<0.05)。提示地榆皂苷Ⅱ可有效抑制ROS产生。详见图4。

图4 地榆皂苷Ⅱ作用于H9C2心肌细胞株对ROS的影响
2.5 地榆皂苷Ⅱ对凋亡相关蛋白及p-ERK1/2、Bestrophin-3表达的影响 与H9C2组比较,H2O2组细胞凋亡相关蛋白(Bax、Caspase-3及Caspase-9)表达水平升高(P<0.05);与H2O2组比较,地榆皂苷Ⅱ+H2O2组Bax、Caspase-3及Caspase-9表达水平下降,差异有统计学意义(P<0.05),详见图5。应用ERK1/2抑制剂后测定p-ERK1/2及Bestrophin3表达量,地榆皂苷Ⅱ+H2O2组p-ERK1/2及Bestrophin3表达量高于H2O2组,差异有统计学意义(P<0.05);应用ERK1/2抑制剂后,抑制剂组p-ERK1/2及Bestrophin3表达量低于地榆皂苷Ⅱ+H2O2组,差异有统计学意义(P<0.05),详见图6。说明地榆皂苷Ⅱ可能通过促进p-ERK1/2和Bestrophin3表达发挥抑制H2O2诱导H9C2心肌细胞株凋亡的作用。

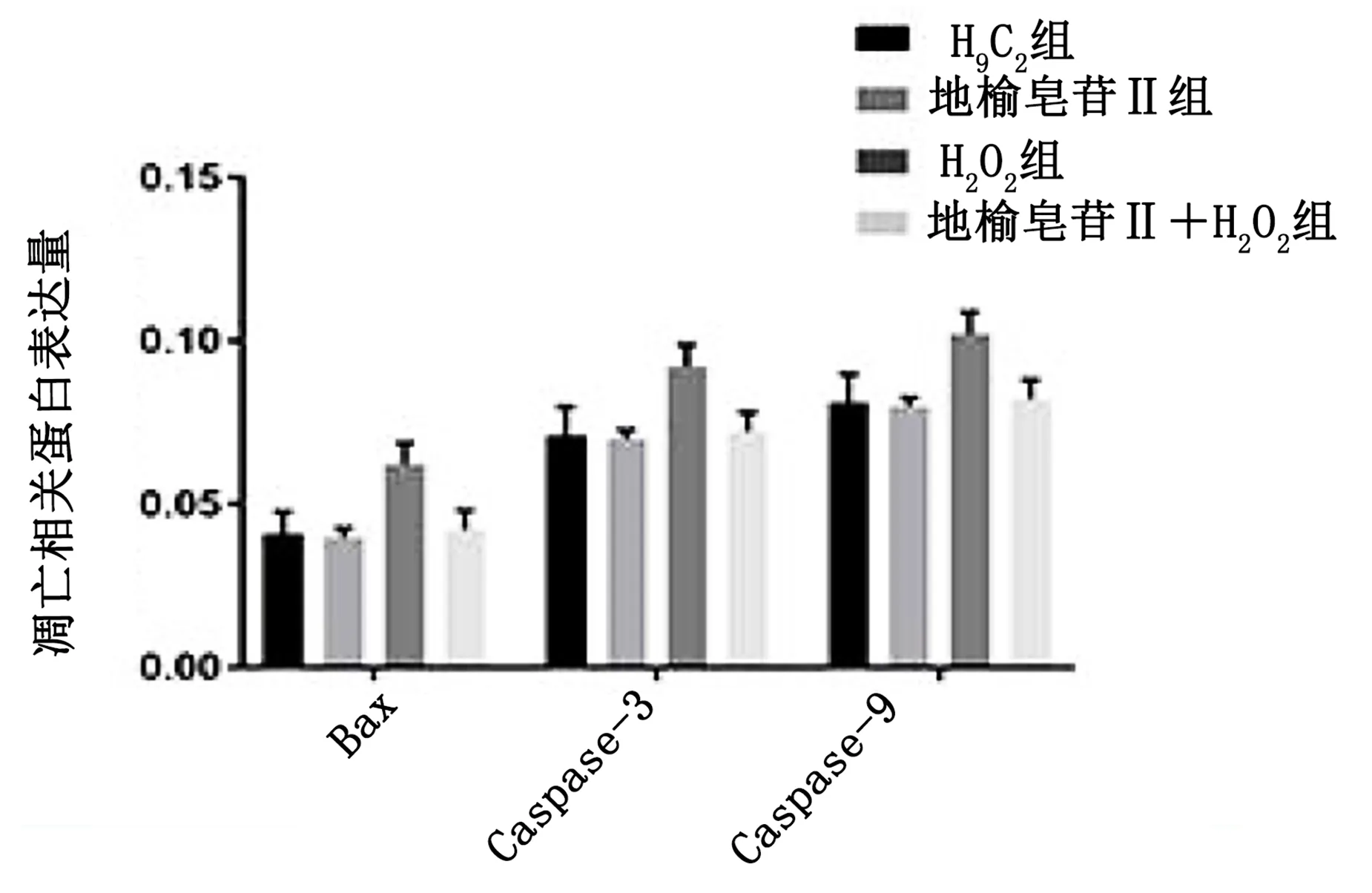
图5 地榆皂苷Ⅱ对凋亡相关蛋白的影响

图6 地榆皂苷Ⅱ对p-ERK1/2及Bestrophin3表达的影响
3 讨 论
随着人们生活水平提高及医疗科学技术发展,冠心病、高血压等慢性疾病发病率逐年增加,心力衰竭已成为严重危害人类健康的重要疾病[8-9],同时心力衰竭防治是心血管疾病的难点。心力衰竭临床表现主要是呼吸困难、水肿和乏力等。相关研究数据表明有明显临床症状病人5年生存率与恶性肿瘤相当。老年人群心力衰竭发病率更高,可达10%左右;心力衰竭一旦确诊,病人5年生存率男性仅为25%,女性为38%。心力衰竭高发病率与高死亡率严重威胁人类健康,因此对心力衰竭的防治工作尤为重要。
氧自由基(oxygen free radicals,OFR)是引起心肌细胞株凋亡的主要原因之一。OFR导致细胞膜通透性升高,Ca2+内流增加,损伤蛋白质功能[10-11]。有研究证明,Bestrophin3水平与Ca2+、Cl-通道性能有关,其过表达可有效抑制Ca2+内流[12-13]。
中医将“心力衰竭”归属于“喘症”“惊悸”“怔忡”等范畴,多为本虚标实,实以瘀血、痰饮为主。地榆为蔷薇科植物的干燥根,具有活血化瘀、通经活络作用,地榆皂苷Ⅱ是从地榆中分离的三萜皂苷类化合物。有文献报道,地榆皂苷Ⅱ具有抗氧化应激、抑制细胞凋亡作用[14-16]。急性毒性实验中,给予小鼠最大剂量灌胃,未出现明显毒性反应[17]。相关研究证明,地榆皂苷Ⅱ可有效抑制ROS产生,肾脏细胞结果提示ERK1/2可促进Bestrophin3表达[18];ROS与Bestrophin3均是影响Ca2+内流的相关因素[19-21],而Ca2+内流引起心肌细胞株凋亡。
本研究使用MTT法证明地榆皂苷Ⅱ对H9C2心肌细胞株无毒副作用;流式细胞技术结果提示地榆皂苷Ⅱ可有效抑制H2O2对H9C2心肌细胞株损伤。荧光显微镜检测ROS活性,结果发现H2O2可提高ROS活性,而加入地榆皂苷Ⅱ后ROS荧光强度明显减弱,提示H2O2通过诱导H9C2心肌细胞株氧化应激反应从而促进其凋亡,地榆皂苷Ⅱ可有效抑制该反应而保护H9C2心肌细胞株。Western Blot结果显示地榆皂苷Ⅱ作用于H9C2心肌细胞株能抑制凋亡相关蛋白Bax、Caspase-3、Caspase-9表达,其与流式细胞技术及ROS活性测定结果一致。本研究结果显示,地榆皂苷Ⅱ可促进ERK1/2及Bestrophin3表达,在加入ERK1/2抑制剂后,两者表达均下降。上述研究结果表明地榆皂苷Ⅱ作用机制可能通过促进ERK1/2和Bestrophin3表达从而抑制ROS产生,抑制Ca2+内流,发挥有效的抗心肌细胞株凋亡作用。
综上所述,地榆皂苷Ⅱ能有效抑制H2O2诱导的心肌细胞株凋亡,抑制凋亡相关蛋白Bax、Caspase-3、Caspase-9表达;其作用机制可能通过激活ERK1/2信号通路,促进Bestrophin3表达,从而抑制氧化应激反应。本研究为心力衰竭的治疗提供了新的药物选择和治疗靶点。

