基于NF-κB信号通路中药治疗支气管哮喘的实验研究进展
武明云 虞坚尔 白莉 薛征 蒋沈华 徐万超
[摘要] 本文综述中药干预核转录因子-κB(NF-κB)信号通路中药治疗支气管哮喘的实验研究进展。NF-кB信号传导途径可以调控免疫/炎症细胞和气道结构细胞等,诱发支气管哮喘的发生及发展。近年来研究显示,多种中药复方、中药单味药及其提取物和中药单体可通过抑制NF-κB通路,减轻气道炎症和气道高反应,逆转气道重塑,在防治支气管哮喘方面有显著疗效。
[关键词] 核转录因子信号通路;支气管哮喘;中药;综述
[中图分类号] R562.25 [文献标识码] A [文章编号] 1673-7210(2020)04(a)-0031-04
Progress of experimental research in the treatment of bronchial asthma with Chinese medicine based on NF-κB signaling pathway
WU Mingyun1,2 YU Jian′er1 BAI Li3 XUE Zheng1,3 JIANG Shenhua1,2 XU Wanchao1,2
1.Institute of Pediatrics of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200071, China; 2.Shanghai Clinical College of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 201203, China; 3.Department of Pediatrics, Shanghai Municipal Hospital of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200071, China
[Abstract] This paper reviews the experiment research progress of Chinese medicine in the treatment of bronchial asthma via nuclear factor-κB (NF-κB) signaling pathway. NF-кB signaling pathway can regulate immune/inflammatory cells and airway structure cells, inducing the occurrence and development of bronchial asthma. In recent years, experimental studies have shown that a variety of traditional Chinese medicine compounds, traditional Chinese medicine single-drugs and their extracts and traditional Chinese medicine monomers can be passed inhibits NF-κB pathway, improves asthma symptoms, reduces airway inflammation and airway hyperresponsiveness, reverses airway remodeling, and achieves significant effects in preventing and treating bronchial asthma.
[Key words] Nuclear transcription factor signaling pathway; Bronchial asthma; Chinese medicine; Review
支氣管哮喘(以下简称“哮喘”)是一种由多基因参与的具有遗传易感性的慢性气道炎症,与多种炎症细胞、炎症介质和细胞因子等密切相关。流行病学调查结果显示[1-2],全球哮喘患者数量为3亿左右,而我国已经超过3千万,其中相当比例的患者为未成年儿童。已有研究显示[3],核转录因子-κB(NF-κB)信号通路在哮喘发病机制中起重要作用,可调节许多促炎介质、黏附分子、呼吸黏蛋白以及生长因子和血管生成因子的表达。中药在哮喘发作期及缓解期的治疗中效果突出,且不良反应较少,对临床具有重要意义。本文就NF-κB通路与哮喘的关系及中药干预NF-κB信号通路治疗哮喘进行综述。
1 NF-κB信号通路概述
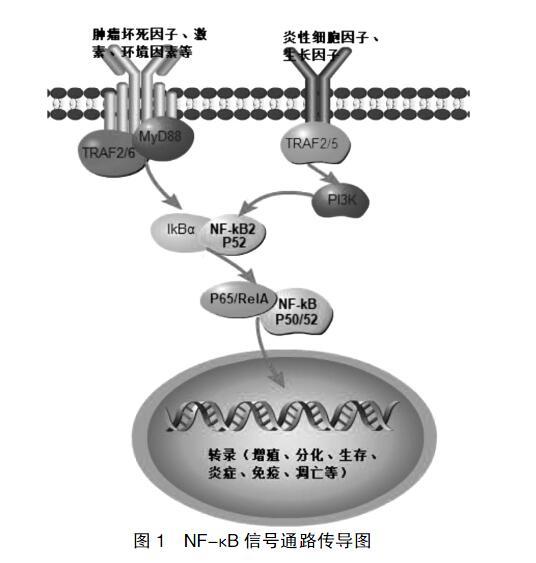
NF-κB家族广泛存在于哺乳动物细胞中,是一种重要的核转录调控因子。NF-κB家族有5个成员,包括NF-κB1(p50及其前体p105)、NF-κB2(p52及其前体p100)、RelA(p65)、RelB和c-Rel,通常所说的NF-κB蛋白,是由p50、p65两个亚基组成的异源二聚体,其在正常情况下呈非活跃状态,当受到病毒、细胞因子、氧化剂等激活剂激活后,NF-κB的抑制蛋白(IκB)激酶被激活,IκB磷酸化、泛素化,最终被降解,NF-κB二聚体得到释放,随后转入细胞核内与相应启动子或增强子的结合位点结合,进而调控多种基因如白细胞介素(IL)-I、肿瘤坏死因子(TNF-α)、粒细胞-巨噬细胞集落刺激因子(GMCSF)等的转录和表达。这些因子参与细胞增殖、分化、生长,诱发炎症趋化、免疫应答和凋亡等过程[4]。见图1。
图1 NF-κB信号通路传导图
2 NF-κB信号通路与哮喘的关系
NF-κB在1986年被发现,首次被鉴定为调节小鼠B淋巴细胞的k轻链表达的转录因子[5]。随着研究越来越多,发现NF-κB能调节多种促炎细胞因子和TNF的转录过程,而这些细胞因子与哮喘的发病机制密切相关[6-8]。NF-κB的激活渗透于气道组织重塑(气道周围组织纤维化、平滑肌细胞增生及肥大、黏液生成等)的多个环节和层面[9]。碱性成纤维细胞生长因子通过激活NF-κB,促使靶细胞如气道平滑肌细胞、成纤维细胞、内皮细胞等增生,最终导致气道重塑[10]。此外,NF-κB信号失活会抑制气道平滑肌细胞(ASMCs)的增殖和迁移[11]。提示NF-κB信号通路在哮喘的发病过程中发挥一定作用,与气道组织重塑和气道炎症的形成、持续存在及发展密切相关。
3 基于NF-κB信号通路的中药防治哮喘的研究
3.1 中药复方和中药制剂
3.1.1 清肺止咳类 小青龙汤是汉代《伤寒论》中治疗寒性哮喘的经典方剂,由麻黄、桂枝、白芍、生姜、细辛、半夏、五味子、甘草组成,具有温肺散结的功效。Song等[12]通过卵清白蛋白(OVA)致敏及冷风干预制做小鼠冷哮模型,通过不同药物治疗发现,小青龙汤和地塞米松均可通过降低冷哮小鼠IL-1β、TNF-α、NF-κB和胸腺基质淋巴细胞生成素(TSLP)水平,而两药联合应用的效果最佳,提示小青龙汤可以通过NF-κB途径来降低Th2相关炎症细胞的释放来治疗哮喘。
麻黄定喘汤出自朝鲜医家李济马的《东医寿世保元》,由麻黄、杏仁、黄芩、莱菔子、桑白皮、桔梗、麦冬、款冬花、白果组成,诸药共奏补肺泻肝,化痰平喘之功效。杨今实等[13]研究显示,麻黄定喘汤可降低OVA模型小鼠肺泡灌洗液(BAIF)中炎性细胞总数、中性粒细胞、嗜酸性粒细胞、淋巴细胞、IL-4、IL-5、IL-13水平及肺组织丝裂原活化蛋白激酶(MAPKs)/NF-κB/血管内皮生长因子(VEGF)蛋白表达水平,推测麻黄定喘汤是通过抑制MAPKs/NF-κB/VEGF信号通路的表达,实现对哮喘的治疗作用。
3.1.2 健脾益气类 健脾益肺汤由黄芪、茯苓、炒白术、炒谷芽、人参、陈皮、桔梗、升麻、甘草、砂仁等组成,张文斌等[14]研究发现,健脾益肺汤能显著抑制OVA致敏大鼠NF-κB及其磷酸化(p-NF-κB)水平,降低BALF中IL-4、IL-6和IL-13水平,增加γ干扰素(IFN-γ)的表达,降低大鼠气管壁厚度和平滑肌厚度,提示健脾益肺汤能改善哮喘模型大鼠气道炎症及气道重塑。
益气固本方由太子参、黄芪、白术、防风、茯苓、当归、川芎、白芍、熟地黄、陈皮、法半夏、炙甘草等组成,全方有益气平喘、扶正固本的功效[15]。邱立志等[16]采用益气固本方联合激素治疗哮喘患儿发现,益气固本方联合激素治疗组NF-κB、血管紧张素-Ⅱ(Ang-Ⅱ)、神经生长因子(NGF)、抗氧化物(TAC)水平低于激素治疗组,总有效率(95.24%)高于激素治疗组(80.95%),提示益气固本方可通过NF-κB信号通路改善哮喘患儿的气流受限情况。
3.2单味中药及其提取物
3.2.1 白术 白术是菊科植物白术(Atractylodes macrocephala Koidz.)的根茎,从白术中分离出的挥发油、多糖和内酯类等活性成分具有抗肿瘤、抗炎等作用[17]。Shin等[18]研究白术对OVA诱导过敏性小鼠的治疗作用发现,白术可降低小鼠BALF中IL-5、IL-13等炎性因子和免疫球蛋白(IgE)的浸润,减少黏液分泌等,同时伴有NF-κB磷酸化的降低。提示白术可以通过调控NF-κB通路减轻过敏性哮喘的炎性反应。
3.2.2 柴胡 柴胡为伞形科植物柴胡(Bupleurum chinense DC)或狭叶柴胡(Bupleurum scorzonerifolium Willd)的干燥根。其主要成分为柴胡皂苷,具有解热、镇痛、抗炎等作用[19]。Bui等[20]研究发现,柴胡提取物可抑制支气管壁增厚、黏液的过度分泌、胶原沉积和炎症细胞如IL-1b、IL-4、IL-5、IL-6和TNF-α等的分泌,同時显著降低NF-κBp65磷酸化、降解细胞质中的IkBα。提示柴胡提取物可通过阻断NF-κB通路来抑制Th2/Th17细胞因子的产生治疗过敏性哮喘。
3.2.3 黄芪 黄芪为豆科植物黄芪(Astragalus membranaceus Bunge)或内蒙古黄芪(Amongholicus Bunge)等的干燥根,其提取物可以有效抑制哮喘的气道重塑,减轻哮喘症状[21]。Yang等[22]研究显示,黄芪提取物可减轻OVA致敏小鼠的肺部炎症、杯状细胞的增生和气道高反应性,减少BALF中嗜酸性粒细胞和淋巴细胞,并通过抑制NF-κB从细胞质向细胞核的易位来降低过敏性哮喘Th2相关细胞因子如IL-4和IL-5的表达,初步显示黄芪提取物对哮喘的潜在治疗价值及其可以通过抑制NF-κB通路的表达而发挥作用。
3.3中药单体
3.3.1 穿心莲内酯 穿心莲是一种治疗呼吸系统疾病的常用中药,穿心莲内酯是穿心莲的天然二萜类化合物。Peng等[23]研究发现,穿心莲内酯可显著抑制OVA致敏小鼠BALF和血清TNF-α、IL-6、IL-4及IL-β水平,并显著降低IKKα/β、IkBα及NF-κB的磷酸化,显示穿心莲内酯通过调节NF-κB和NLRP3炎性小体的活化来减轻小鼠的肺部炎症。
3.3.2 姜黄素 姜黄素(CUR)属于小分子量的酸性多酚类物质,是从姜科植物姜黄等根茎中提取得到的黄色色素,具有抗癌、抗炎和抗氧化等功效[24]。尹正海[25]发现,姜黄素可显著抑制OVA致敏哮喘大鼠嗜酸性粒细胞、中性粒细胞和淋巴细胞的分泌,降低IL-5、IL-13水平,提高IFN-γ的分泌,姜黄素高、低剂量组肺组织内的NF-κBp65和p-p38MAPK的蛋白表达均显著低于模型组。提示姜黄素对哮喘大鼠发挥的抗炎作用是通过调控NF-κB/MAPK信号通路来调节Th1/Th2平衡而实现的。
3.3.3 雷公藤甲素 雷公藤甲素是从中草药雷公藤中分离得到的二萜类三环氧化合物,可通过抑制多种促炎细胞因子和黏附分子来治疗免疫性疾病,包括类风湿性关节炎和哮喘等,此外还具有抑制增殖和诱导凋亡的作用[26]。Chen等[27]用雷公藤甲素治疗OVA致敏小鼠发现,雷公藤甲素可抑制气道壁增厚,减少支气管平滑肌和杯状细胞增生,降低小鼠肺组织黏蛋白5AC(MUC5AC)RNA的表达和NF-κBp65的磷酸化,证实雷公藤甲素可以通过NF-κB信号通路抑制哮喘小鼠的气道重塑。
4 小结与展望
哮喘做为一种慢性气道疾病,抗胆碱能药物、皮质类固醇、H1-抗组胺和抗白三烯等治疗方法对大约5%的患者效果欠佳[28]。中药可以通过多成分、多靶点、多途径的协同作用于NF-κB信号通路,调节Th1/Th2和Th17/Treg的平衡,在预防和治疗哮喘方面取得了显著疗效。
虽然有大量研究显示中药通过NF-κB信号通路可以明显改善哮喘症状,但缺乏NF-κB相关通路阻断剂对照组的研究。此外,过度抑制NF-κB信号通路是否会造成免疫功能紊乱有待进一步探索。中医药在儿科过敏性哮喘的治疗中效果显著,而儿童用药更以中药制剂、中成药和外治法(冬病夏治等)为普遍,故今后的研究中可以在相关治法中有所侧重。
[参考文献]
[1] 李培培,黄娜,黄秀萍,等.认知行为干预对青年支气管哮喘患者生活质量、负性情绪及哮喘发作频次的影响[J].实用医院临床杂志,2018,15(2):63-66.
[2] 杨敏,李林瑞,孟燕妮,等.布地奈德辅助治疗小儿支气管哮喘对T淋巴细胞亚群及相关细胞因子的影响[J].疑难病杂志,2018,17(3):255-258,263.
[3] Mishra V,Banga J,Silveyra P,et al. Oxidative stress and cellular pathways of asthma and inflammation:Therapeutic strategies and pharmacological targets [J]. Pharmacol Ther,2018,181:169-182.
[4] Shi J,Wang X,Qiu J,et al. Role of NF-κB and SP-1 in oxidative stress-mediated induction of platelet-derived growth factor-B by TNF-α in human endo the glial cells [J]. J Cardiovasc Pharmacol,2004,44(1):26-34.
[5] Sen R,Baltimore D. Inducibility of kappa immunoglobulin enhancer-binding protein NF-kappa B by a posttranslational mechanism [J]. Cell,1986,47(6):921-928.
[6] Papadopoulos NG,Arakawa H,Carlsen KH,et al. In-ternational consensus on (ICON) pediatric asthma [J]. Allergy,2012,67(8):976-997.
[7] Mayuzumi H,Ohki Y,Tokuyama K,et al. Age-related differ-ence in the persistency of allergic airway inflammation and bronchi-al hyperresponsiveness in a murine model of asthma [J]. Int Arch Allergy Immunol,2007,143(4):255-262.
[8] 曾佳,熊瑛,贾晓琴,等.孟鲁司特钠对哮喘大鼠瘦素、STAT3及IL-6含量的影响[J].泸州医学院学报,2009, 32(1):9-13.
[9] Charokopos N,Apostolopoulos N,Kalapodi M,et al. Bronchial asthma,chronic obstructive pulmonary disease and NF-κB [J]. Curr Med Chem,2009,16(7):867-883.
[10] 冯小鹏,陈兴无.细胞因子在支气管哮喘气道重塑中作用的研究现状[J].中华肺部疾病杂志:电子版,2011,4(6):521-526.
[11] 石瑞瑞,陈显锋,朱洁晨,等.瘦素促进低氧状态下大鼠气道平滑肌細胞增殖及HIF-1α、NF-κB表达[J].细胞与分子免疫学杂志,2015,31(1):32-35.
[12] Song G,Zhang Y,Zhao K,et al. Regulatory Effect of Xiaoqinglong Decoction on Thymic Stromal Lymphopoietin (TSLP) Inflammation Promoter in Mice with Cold Asthma [J]. Iran J Allergy Asthma Immunol,2018,17(1):39-46.
[13] 杨今实,金香,孙天一,等.朝医麻黄定喘汤对哮喘小鼠MAPKs/NF-κB/VEGF信号通路的影响[J].中华中医药杂志,2017,32(10):4448-4452.
[14] 张文斌,王杰,王玮,等.健脾益肺汤抑制NF-κB/STAT3信号通路改善哮喘模型大鼠气道炎症及气道重塑作用研究[J].中国中医急症,2019,28(5):806-808,832.
[15] 何林丽.益肺平喘汤联合穴位贴敷治疗小儿咳嗽变异性哮喘的临床观察[J].中西医结合心血管病电子杂志,2017,5(21):141-142.
[16] 邱立志,蒲海波,杨传楹,等.益气固本方剂联合激素治疗支气管哮喘对患儿免疫功能和气流受限指标的影响[J/OL].中华中医药学刊:1-6[2019-03-17].http://kns.cnki.net/kcms/detail/21.1546.R.20190814.1615.105.html.
[17] 顾思浩,孔维崧,张彤,等.白术化学成分、药理作用与复方应用的研究进展[J/OL].中华中医药学刊刊:1-6[2019-03-17].http://kns.cnki.net/kcms/detail/21.1546.R.20190813.1559.037.html.
[18] Shin NR,Lee AY,Park G,et al. Therapeutic Effect of Dipsacus asperoides C. Y. Cheng et T. M. Ai in Ovalbumin-Induced Murine Model of Asthma [J]. Int J Mol Sci,2019,20(8):124-128.
[19] 辛国,赵昕彤,黄晓巍,等.柴胡化学成分及药理作用研究进展[J].吉林中医药,2018,38(10):1196-1198.
[20] Bui TT,Piao CH,Song CH,et al. Bupleurum chinense extract ameliorates an OVA-induced murine allergic asthma through the reduction of the Th2 and Th17 cytokines production by inactivation of NF-κB pathway [J].Biomed Pharmacother,2017,91:1085-1095.
[21] Qu ZH,Yang ZC,Chen L,et al. Inhibition airway remodeling and transforming growth factor-b1/Smad signaling pathway by astragalus extract in asthmatic mice [J]. Int J Mol Med,2012,29(4):564-568.
[22] Yang ZC,Yi MJ,Ran N,et al. Astragalus Extract Attenuates Allergic Airway Inflammation and Inhibits Nuclear Factor κB Expression in Asthmatic Mice [J]. Am J Med Sci,2013,346(5):390-395.
[23] Peng S,Gao J,Liu W,et al. Andrographolide ameliorates OVA-induced lung injury in mice by suppressing ROS-mediated NF-κB signaling and NLRP3 inflammasome activation [J]. Oncotarget,2016,7(49):80262-80274.
[24] Gupta SC,Patchva S,Koh W,et al. Discovery of curcumin,a component of golden spice,and its miraculous biological activities [J]. Clin Exp Pharmacol Physiol,2012, 39(3):283-299.
[25] 尹正海.姜黄素通过p38MAPK/NF-κB信号通路抑制哮喘大鼠气道炎症的实验研究[J].临床肺科杂志,2019, 24(5):831-835.
[26] Li J,Liu R,Yang Y,et al. Triptolide-induced in vitro and in vivo cytotoxicity in human breast cancer stem cells and primary breast cancer cells [J]. Oncol Rep,2014, 31(5):2181-2186.
[27] Chen M,Lv Z,Zhang W,et al. Triptolide suppresses airway goblet cell hyperplasia and Muc5ac expression via NF-κB in a murine model of asthma [J]. Mol Immunol,2015,64(1):99-105.
[28] 張铁栓,张国俊,刘颖,等.还原型谷胱甘肽对哮喘豚鼠气道上皮细胞的保护作用[J].郑州大学学报:医学版,2013,48(1):70-73.
(收稿日期:2019-11-05 本文编辑:刘明玉)

