胎盘间充质干细胞对大鼠子宫内膜损伤的修复作用
王香香 王焱 杨稍稍 张俊俊


[摘要] 目的 研究胎盤间充质干细胞对大鼠子宫内膜损伤的修复作用。 方法 2019年5~11月使用化学损伤法对60只雌性SD大鼠(南京市江宁区青龙山动物繁殖场)构建子宫内膜损伤模型,采用单纯随机抽样分为对照组、凝胶组、模型组,每组各20只。3个动情周期后,每组采用单纯随机抽样抽取10只大鼠行HE染色测量子宫内膜腺体数目、子宫内膜厚度,Masson染色测量子宫内膜纤维化面积百分比。其他30只大鼠与雄鼠合笼,受孕第10天,开腹观察大鼠子宫胚胎个数。 结果 与对照组比较,模型组子宫内膜腺体数目减少、子宫内膜厚度变薄、子宫内膜纤维化面积百分比升高、受孕大鼠子宫胚胎个数减少,差异有统计学意义(P < 0.05)。与模型组比较,凝胶组子宫内膜腺体数目增加、子宫内膜厚度增高、子宫内膜纤维化面积百分比降低,受孕大鼠子宫胚胎个数增多,差异有统计学意义(P < 0.05)。与对照组比较,凝胶组子宫内膜腺体数目、子宫内膜厚度无明显变化,差异无统计学意义(P > 0.05);子宫内膜纤维化面积百分比升高,受孕大鼠子宫胚胎个数减少,差异有统计学意义(P < 0.05)。 结论 胎盘间充质干细胞可一定程度地修复损伤的子宫内膜,增加子宫内膜腺体数目、子宫内膜厚度,降低子宫内膜纤维化面积百分比,提高胚胎着床率。
[关键词] 胎盘间充质干细胞;子宫内膜损伤;子宫内膜腺体计数;子宫内膜厚度;子宫内膜纤维化面积百分比
[中图分类号] R730.53 [文献标识码] A [文章编号] 1673-7210(2020)04(a)-0018-05
Repair effect of placental mesenchymal stem cells on endometrial injury in rats
WANG Xiangxiang1,2 WANG Yan1,2 YANG Shaoshao1,2 ZHANG Junjun2
1.College of Clinical Medical, He′nan University of Science and Technology, He′nan Province, Luoyang 471003, China; 2.Department of Obstetrics and Gynecology, the First Affiliated Hospital of He′nan University of Science and Technology, He′nan Province, Luoyang 471003, China
[Abstract] Objective To study the repair effect of placental mesenchymal stem cells on endometrial injury in rats. Methods From May to November 2019, a total of 60 female SD rats (Qinglongshan Animal Breeding Farm, Jiangning District, Nanjing) were constructed endometrial injury models by chemical damage method, and they were divided into control group, gel group and model group by simple random sampling, with 20 rats in each group. After three estrous cycles, 10 rats from each group were randomly sampled for HE staining, and the number of endometrial glands and endometrial thickness were measured, while the percentage of endometrial fibrosis were measured by Masson staining. The other 30 rats were caged with male rats. On the 10th day of conception, the number of uterine embryos in the rats was observed by laparotomy. Results Compared with the control group, the number of endometrial glands decreased, the thickness of the endometrium became thinner, the percentage of endometrial fibrosis increased, while the number of uterine embryos in pregnant rats decreased in the model group, and the differences were statistically significant (P < 0.05). Compared with the model group, the number of endometrial glands increased, the thickness of the endometrium increased, the percentage of endometrial fibrosis area decreased, while the number of uterine embryos in pregnant rats increased in the gel group, and the differences were statistically significant (P < 0.05). Compared with the control group, the number of endometrial glands and endometrial thickness had no significant changes in the gel group, and the differences were not statistically significant (P > 0.05); while the percentage of endometrial fibrosis increased, the number of uterine embryos in pregnant rats decreased, and the differences were statistically significant (P < 0.05). Conclusion Placental mesenchymal stem cells can repair damaged endometrium, increase the number of endometrial glands and endometrial thickness, reduce the percentage of endometrial fibrosis area, and improve embryo implantation rate.
[Key words] Placental mesenchymal stem cells;Endometrial injury;Endometrial gland count;Endometrial thickness; Percentage of endometrial fibrosis area
正常女性月经周期靠子宫内膜功能层周期性变化来维持,而基底层保持不变。随着医学的发展,人工流产、诊断性刮宫等宫腔操作的增加,子宫内膜损伤成妇产科常见疾病,且随宫腔操作次数的增加而增加,造成月经减少、闭经、不孕等情况,给广大女性患者及其家庭带来极大的心理、经济、社会负担。目前关于子宫内膜损伤的治疗方法包括放置宫内节育器、口服激素药物及宫腔镜治疗。然而效果并不理想,子宫内膜损伤后修复障碍成为妇产科领域解决的难题之一。将骨髓间充质干细胞[1]应用于重度宫腔粘连患者,有一定效果。但采集骨髓是再次创伤过程,增加患者感染等风险,且骨髓干细胞数量相对较少,影响因素较多,如年龄、健康情况等。胎盘间充质干细胞来源充足、取材方便,不增加产妇创伤。相对于其他干细胞,骨髓干细胞有分化能力较强、极低的免疫排斥反应等优点,引起越来越多的国内外学者们关注。通过构建大鼠子宫内膜损伤模型,立即宫腔移植胎盘间充质干细胞凝胶,观察子宫内膜腺体计数、子宫内膜厚度、子宫内膜纤维化面积百分比及受孕大鼠子宫胚胎个数,并分析胎盘间充质干细胞对大鼠子宫内膜损伤的修复作用,可能为修复损伤后的子宫内膜提供一种新方法。
1 材料与方法
1.1 实验设计
随机对照动物实验。
1.2 实验时间及地点
实验于2019年5~11月在河南科技大学第一附属医院(以下简称“我院”)完成。
1.3 实验材料
1.3.1 实验动物及饲养环境 未交配7~9周SD雌性大鼠60只、雄性大鼠10只SPF级,体重200~220 g。动物合格证号:201905293,生产许可证号:SCXK(苏)2017-0001。购买后常规饲养1周,室温22~24℃,保证充足的鼠粮和水。遵循国家制订的有关动物实验保护和使用指南,并经我院动物伦理委员会批准。
1.3.2 实验细胞 胎盘间充质干细胞凝胶由北京汉氏联合生物技术股份有限公司所赠。
1.3.3 主要实验试剂 95%乙醇(洛阳市洁康消毒剂厂,生产批号:180508);结晶紫(上海试剂四厂,生产批号:20180308);苏木精伊红染液(无锡市江原实业技贸总公司,生产批号:190610);Masson染液(北京索莱宝科技有限公司,生产批号:20190829)。
1.3.4 主要仪器 电脑程控组织包埋机(襄攀徕克生物电子仪器厂,型号:PPDB-21C);蜡块切片RM2235(Leica德国);电烤箱(上海精宏实验设备有限公司,型号:DHG-9070A);荧光倒置显微镜(日本,型号:Nikon Eclipse 80i)。
1.4 实验方法
1.4.1 大鼠子宫内膜损伤模型建立 参照张婷等[2]大鼠阴道分泌物涂片,结晶紫染色观察大鼠动情周期,于动情期(满视野无核角化细胞)造模。参考许春燕等[3]造模方法的改进,5%水合氯醛溶液麻醉(6 mL/kg),麻醉后取仰卧位。消毒后在下腹正中切口,耻骨联合上2 cm,打开腹膜,进入腹腔,轻轻夹出“V”型子宫。无菌生理盐水纱布保护子宫周围,0号缝合丝线活结结扎子宫两端,结扎力度适中。轻微拉直子宫,1 mL注射器针头进入宫腔,平行与子宫纵轴,注射95%乙醇约0.4 mL,使子宫呈充盈状态,且保持无液体明显溢出。作用约5 min将95%乙醇吸出,生理盐水冲洗宫腔3遍,松解子宫两端结扎线,观察子宫恢复情况。后将左侧子宫轻轻送回,同法处理右侧子宫,后逐层关腹,送至保温箱待其肌张力恢复,送动物房。
1.4.2 造模成功评价标准 病理形态学观察:模型组宫腔缩小,子宫内膜凸起不明显,子宫内膜上皮呈偏平状或低柱状,子宫内膜变薄、子宫内膜间质腺体数量减少,子宫内膜间质纤维化明显。
1.4.3 实验分组 60只雌性大鼠采用单纯随机抽样方法,通过随机数字表法分对照组、模型组、凝胶组,每组各20只。对照组仅行开关腹;模型组参照造模方法进行造模;凝胶组造模后立即(6~8 min)宫腔移植胎盘间充质干细胞凝胶0.1 mL。术后3个动情周期,每组采用单纯随机抽样方法,抽取10只大鼠断颈处死,获取大鼠双侧中段子宫标本各1份,经固定、脱水、透明、浸蜡包埋制成蜡块;其余雌性大鼠当天与雄鼠同笼,同笼雌雄比为3∶1,次日发现大鼠阴栓作为受孕当天,受孕10 d后,麻醉下开腹观察大鼠双侧子宫胚胎个数。
1.5 观察指标及方法
1.5.1 HE染色 以4 μm厚度连续切片,脱蜡水化,苏木精染色5 min,1%盐酸酒精分化3 s,1%氨水中蓝化3 s,伊红溶液染色4 min,脱水、透明、中性树胶封片。子宫内膜腺体计数:每张切片随机选取4个不同高倍视野(200×),计腺体数量,取平均值。子宫内膜厚度(100×):通过计算机图像分析系统测量子宫肌层与内膜交界处至宫腔的垂直距离,切片4个象限中子宫内膜的厚度,取平均值。
1.5.2 Masson染色 脱蜡前同HE染色,Weigert铁苏木精染色5 min,酸性乙醇分化液分化5 s,Masson蓝化液返蓝5 s,丽春红染色5 min,弱酸工作液1 min,磷泪酸溶液1 min,弱酸工作液1 min,苯胺蓝染色液1 min,脱水、透明、中性树胶封片。子宫内膜纤维化面积百分比:每张Masson切片随机选取4个高倍视野(200×),通过计算机图像分析系统测量每个视野子宫内膜间质纤维化面積与子宫内膜间质和腺体总面积的百分比比值,取平均值。
1.6 统计学方法
通过SPSS 19.0软件对所得数据进行统计分析,多组比较采用单因素方差分析,两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 三组大鼠术后状况
三组大鼠术后觅食、饮水状态如常,眼神有光,毛色顺亮,精神状态良好,无感染及死亡。
2.2 染色结果
2.2.1 HE染色
2.2.1.1 病理形态学观察 对照组子宫腔形态呈不规则状,可见凸起的子宫内膜,子宫内膜上皮呈高柱状,子宫内膜腺体丰富。凝胶组宫腔形态呈不规则状,可见凸起的子宫内膜,子宫内膜上皮呈高柱状,内膜腺体较多,子宫内膜纤维细胞较正常组多。模型组宫腔明显缩小,子宫内膜凸起不明显,子宫内膜上皮呈偏平状或低柱状,内膜间质腺体数量减少,子宫内膜间質纤维化明显。见图1(封三)。
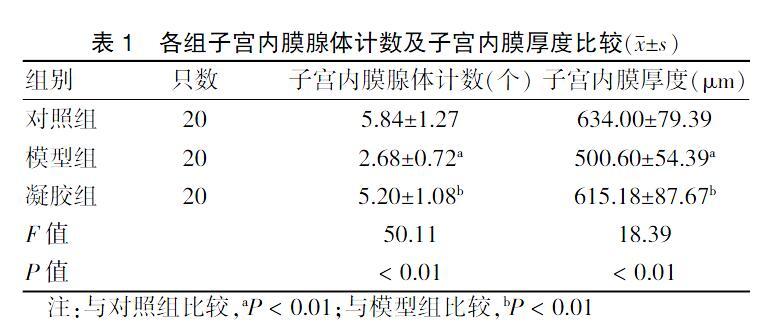
2.2.1.2 各组子宫内膜腺体计数及子宫内膜厚度比较 各组子宫内膜腺体数量整体比较,差异有高度统计学意义(P < 0.01)。进一步两两比较,模型组子宫内膜腺体计数明显少于对照组,差异有统计学意义(P < 0.05)。凝胶组子宫内膜腺体计数明显多于模型组,差异有统计学意义(P < 0.05)。各组子宫内膜厚度整体比较,差异有高度统计学意义(P < 0.01)。进一步两两比较,模型组子宫内膜厚度显著低于对照组,差异有统计学意义(P < 0.05)。凝胶组子宫内膜厚度明显高于与模型组,差异有统计学意义(P < 0.05)。见表1。
表1 各组子宫内膜腺体计数及子宫内膜厚度比较(x±s)
注:与对照组比较,aP < 0.01;与模型组比较,bP < 0.01
2.2.2 Masson染色
2.2.2.1 病理形态学观察 对照组子宫内膜腺体、上皮呈红色,子宫内膜可见梭形单束状浅蓝色胶原纤维,规律排列。凝胶组子宫内膜腺体、上皮呈红色,子宫内膜胶原纤维呈蓝色,部分区域呈蓝色片状。模型组子宫内膜腺体、上皮呈红色,子宫内膜胶原纤维呈蓝色,排列不规律、杂乱状,大多数区域呈蓝色片状。见图2(封三)。
2.2.2.2 子宫内膜纤维化面积百分比 各组子宫内膜纤维化面积百分比整体比较,差异有高度统计学意义(P < 0.01)。进一步两两比较,凝胶组及模型组子宫内膜纤维化面积百分比显著高于对照组,且凝胶组低于模型组,差异有统计学意义(P < 0.05)。
2.3 受孕大鼠子宫胚胎个数
2.3.1 各组子宫胚胎个数观察
对照组大鼠子宫胚胎数量最多且无死胎现象。凝胶组大鼠胚胎数量较正常组减少,未发现有死胎现象。模型组大鼠子宫胚胎数量稀疏,部分大鼠单侧子宫无胚胎着床,个别大鼠子宫胚胎着床后出现死胎现象。见图3。
A:对照组;B:凝胶组;C:模型组
图3 各组子宫胚胎个数观察
2.3.2 各组子宫胚胎个数
各组子宫胚胎个数总体比较,差异有高度统计学意义(P < 0.01)。进一步两两比较,模型组子宫胚胎数显著少于对照组,差异有统计学意义(P < 0.05)。凝胶组子宫胚胎个数显著多于模型组,且显著少于对照组,差异有统计学意义(P < 0.05)。见表2。
表2 各组子宫胚胎个数(x±s)
注:与对照组比较,aP < 0.01;与模型组比较,bP < 0.01
3 讨论
研究中选用胎盘间充质干细胞凝胶修复大鼠损伤的子宫内膜,考虑胎盘间充质干细胞凝胶自身流动性较差,宫腔既不能移植过多,也要保证凝胶均匀覆盖子宫内膜,选用造模后立即(6~8 min)宫腔移植0.1 mL(1×105细胞数)胎盘间充质干细胞凝胶。实验结果显示,胎盘间充质干细胞可增加子宫内膜腺体数量、增加子宫内膜厚度和胚胎着床率、降低子宫内膜纤维化面积百分比,对子宫内膜损伤有一定的修复作用。提示子宫内膜损伤后立即宫腔移植0.1 mL(1×105细胞数)胎盘间充质干细胞凝胶是可行的,为子宫内膜损伤修复提供一种新方法。在人工流产、诊断性刮宫等宫腔操作术后,立即移植胎盘间充质干细胞凝胶修复损伤后的子宫内膜,可以预防或者降低术后子宫内膜损伤带来的一系列问题,如宫腔粘连、月经稀发、不孕、流产等。但研究为动物实验,若能证实胎盘间充质干细胞无致瘤性及安全性,进行临床实验研究,在妇产科领域特别是生殖医学领域修复子宫内膜损伤可能带来巨大影响。但研究中存在样本量较小、观察时间较短等局限性,需要更大的样本量及较长的观察时间进一步研究。
大多数认为干细胞可能是通过信号通路、迁移、分泌、造血、免疫调节及其向多种细胞分化的功能[4-9]修复受损组织。关于间充质干细胞修复子宫内膜损伤的研究相对较多[10-18],牛婷等[19]研究显示,子宫内膜损伤后15 d移植胎盘间充质干细胞悬液(1×1010细胞数)修复子宫内膜。结果显示,胎盘间充质干细胞对子宫内膜损伤具有不同程度地修复作用,其效果可能宫腔移植组较静脉移植组较好。考虑其可能原因宫腔移植组的局部细胞浓度高于静脉移植组的宫腔细胞浓度或者通过其他途径来发挥效应。赵静等[20]研究显示,骨髓间充质干细胞早期(造模后6~8 h移植)宫腔移植组与晚期(造模后12 d移植)宫腔移植组同样对子宫内膜损伤均有一定的修复效果,但其最佳移植时机仍无定论。就其细胞移植时机来说值得肯定的是,子宫内膜损伤后立即宫腔移植间充质干细胞,可减少二次宫腔操作对子宫所带来的损伤。若应用于临床工作中,不仅减少了二次宫腔操作对子宫内膜的再损伤,在一定程度上减轻患者心理、经济负担,更避免了医疗资源浪费等优势。本研究选用子宫内膜损伤后立即宫腔移植胎盘间充质干细胞凝胶,实验结果显示胎盘间充质干细胞凝胶对子宫内膜损伤有一定的修复作用,还避免二次宫腔操作对子宫内膜的再次损伤,同时达到宫腔注射的局部高浓度状态,使研究目的真正接近临床。
目前,关于间充质干细胞对子宫内膜损伤的研究多数停留在动物实验阶段,对其致瘤性及安全性仍无统一意见,胎盘间充质干细胞有望成为治疗子宫内膜损伤的理想细胞。如何选取胎盘间充质干细胞的最佳移植时机、最佳移植浓度及应用于临床的安全性,仍需大量的动物及临床试验。
[参考文献]
[1] Singh N,Mohanty S,Seth T,et al. Autologous stem cell transplantation in refractory Asherman′s syndrome:A novel cell based therapy [J]. J Hum Reprod Sci,2014,7(2):93-98.
[2] 张婷,王颖,王莉.大鼠阴道涂片两种染色方法比较[J].中国比较医学杂志,2018,28(12):101-104.
[3] 许春燕,宋阳,李坤寅,等.薄型子宫内膜模型的动物选择及其造模方法改进[J].中国实验动物学报,2016,24(2):217-220.
[4] Haiyan Z,Yinshen J,Yibin P,et al. Human menstrual blood-derived stem cells promote the repair of impaired endometrial stromal cells by activating the p38 MAPK and AKT signaling pathways [J]. Reprod Biol,2018,18(3):274-281.
[5] 牛婷,李爱斌,曹景云,等.胎盘间充质干细胞的应用研究[J].中国组织工程研究,2015,19(32):5236-5242.
[6] Hur W,Lee HY,Min HS,et al. Regeneration of full-thickness skin defects by differentiated adipose-derived stem cells into fibroblast-like cells by fibroblast-conditioned medium [J]. Stem Cell Res Ther,2017,8(1):92.
[7] Redondocastro E,Cunningham C,Miller J,et al. Interleukin-1 primes human mesenchymal stem cells towards an anti-inflammatory and pro-trophic phenotype in vitro [J]. Stem Cell Res Ther,2017,8(1):79.
[8] Zhu J,Wang P,Yu Z,et al. Advanced glycosylation end product promotes forkhead box O1 and inhibits Wnt pathway to suppress capacities of epidermal stem cells [J]. Am J Transl Res,2016,8(12):5569-5579.
[9] Vasandan AB,Jahnavi S,Shashank C,et al. Human Mesenchymal stem cells program macrophage plasticity by altering their metabolic status via a PGE2-dependent mechanism [J]. Sci Rep,2016,6(1):38308.
[10] 王冰玉,姬霞.骨髓間充质干细胞移植联合益母草碱治疗宫腔粘连[J].中国组织工程研究,2016,20(32):4771-4777.
[11] Wang J,Ju B,Pan C,et al. Application of Bone Marrow-Derived Mesenchymal Stem Cells in the Treatment of Intrauterine Adhesions in Rats [J]. Cellular Physiol Biochem,2016,39(4):1553-1560.

