米曲霉来源的环二肽对荧光假单胞菌群体感应的抑制及其机制
丁 婷,李 勇
(北京大学 公共卫生学院 营养与食品卫生系,北京 100191)
水产品是食品蛋白质的重要来源,因其具有热量低、营养丰富、味道鲜美、富含不饱和脂肪酸等特点,深受消费者的喜爱。但是水产品在运输、加工及储存过程中容易受到微生物污染,造成食品质量恶化和经济损失[1-2]。微生物是引起食品腐败的主要原因[3],腐败食品中的致病菌会引起食物中毒,给人类的生命健康带来严重危害。冷藏水产品中部分嗜冷菌可以在低温条件下生长,如假单胞菌属(Pseudomonassp.)、微球菌属(Micrococcussp.)、希瓦氏菌属(Shewanellasp.)、不动杆菌属(Acinetobactersp.)和嗜冷杆菌属(Psychrobactersp.)等[4-6]。它们可以将蛋白质分解为各种有毒物质,包括吲哚、苯酚、腐胺、尸胺、硫化氢、甲烷和氨等,并释放异味[7]。冷藏水产品中最常见的假单胞菌是荧光假单胞菌(P.fluorescens),它是一种常见的食品腐败菌,常出现在牛奶、鸡肉、鱼类等各种冷藏食品中,是导致食物变质的主要细菌[8-9]。此外,在临床上,部分患者在接受到由荧光假单胞菌污染的血液和血液制品时,会表现出严重的临床症状,如败血症、感染性休克和血管内凝血等[10]。细菌依靠群体感应来调节各种表型的表达,如毒力因子的产生、致病性、生物被膜的形成等[11-12]。
群体感应(QS)是一种细胞间的通信机制,通过这种机制细菌可以监测其种群密度并调节各种群体性行为。QS系统是由小分子自体诱导物(AIs)来介导的。大多数革兰氏阴性菌利用N-乙酰高丝氨酸内酯(AHL)作为信号分子;革兰氏阳性菌主要由寡肽(AIP)信号分子介导;种间(内)信息交流主要由呋喃硼酸二酯类(AI-2)信号分子介导。此外,还包括喹诺酮类信号分子、扩散信号因子等[13]。荧光假单胞菌是一类革兰氏阴性、杆状、活动性强的细菌,能够在多种环境中生存。群体感应网络和生物被膜的形成特性是它们在环境中作用的重要组成部分。荧光假单胞菌主要存在LuxI/R型群体感应系统。在其QS通路中,信号分子AHLs是由LuxI型蛋白产生并与LuxR型蛋白结合,从而触发相关基因的表达,使细菌产生特定的生理活动。EI-Sayed等[14]发现,荧光假单胞菌P.fluorescensNCIMB 10586中存在mpuI-mpuR系统。这种LuxI/R型的QS系统调节聚酮类抗生素莫匹罗星的生物合成。Laue等[15]发现荧光假单胞菌P.fluorescensF113的QS系统中唯一已知的成分是AHL合成酶及其产生的AHLs。AHL合成酶(HdtS蛋白)与溶血磷脂酸酰基转移酶家族有关,能产生3种AHLs:N-hexanoyl-HSL、N-(3-hydroxy-7-cis-tetradecenoyl)-HSL和N-decanoyl-HSL。Kwak等[16]研究发现,荧光假单胞菌P.fluorescens2P24也具有LuxI/R型群体感应系统,即PcoIR系统,能合成6种AHLs。近年来,AHLs介导的QS系统在食品腐败和致病性中的作用机制受到了广泛关注,多种化合物被确认是群体感应抑制剂(QSIs)。QSIs能在不干扰细菌生长、诱导突变和产生抗性的前提下,有效地抑制病原菌的致病性[17]。因此,阻断其QS系统可能是食品保鲜和控制其毒性的一种新途径。
本研究中,笔者从米曲霉的代谢产物中分离得到一个环二肽,即环(L-苯丙氨酸-L-脯氨酸),该化合物具有很强的QS抑制活性。基于此,笔者测定了环二肽对荧光假单胞菌的QS表型的抑制作用,并通过分子对接分析了其抑制机制,旨在为探究腐败菌的群体感应系统和控制基于QS系统的腐败提供参考。
1 材料与方法
1.1 材料、菌株和培养条件
正丁酰基-L-高丝氨酸内酯(C4-HSL)、正己酰基-L-高丝氨酸内酯(C6-HSL)、正辛烷酰基-L-高丝氨酸内酯(C8-HSL)、正癸酰基-L-高丝氨酸内酯(C10-HSL)、正十二烷基-L-高丝氨酸内酯(C12-HSL)和正十四烷基-L-高丝氨酸内酯(C14-HSL),Sigma-Aldrich公司(色谱纯)。
紫色杆菌(Chromobacteriumviolaceum) CV026保藏于30%甘油中,于-80 ℃保藏。C.violaceumCV026是mini-Tn5突变体,自身不能产生信号分子,但是遇到外源的短链信号分子((C4~C8)-HSLs)时,能产生紫色杆菌素使平板变紫色。荧光假单胞菌分离于腐败的冷藏水产品;米曲霉(Aspergillusoryzae)D01保存于笔者所在实验室。
1.2 实验方法
1.2.1 米曲霉代谢产物萃取
米曲霉用马铃薯葡萄糖培养基培养(PDA),添加质量分数0.3%氯霉素。将PDA平板置于培养箱28 ℃培养7 d后,挑取单菌落接种于沙氏液体培养基(Liquid Sabourand Medium),30 ℃、160 r/min摇床培养6~15 d。将培养物超声破碎5 min后,纱布进行过滤。将滤液在室温下用3倍量乙酸乙酯提取2次,静置过夜。将乙酸乙酯层在35 ℃下用旋转蒸发器浓缩,直至除去溶剂。将萃取物用适量氯仿溶解,并用0.22 μm滤膜过滤,4 ℃保藏供进一步实验。
1.2.2 环二肽的分离纯化及鉴定
将萃取物用二氯甲烷和甲醇通过柱层析进行梯度洗脱。用C.violaceumCV026测定各组分的QS抑制活性。各组分经Sephadex LH20柱层析后,用二氯甲烷和甲醇以体积比8∶ 1洗脱,用薄层色谱法将相似物质合并。合并后的物质经QS抑制活性测试,用40%甲醇和半制备液相色谱法(Waters 2998,Waters公司)进行分离。用ESI-MS、1H NMR和13C NMR对产物进行结构鉴定。
1.2.3 环二肽最小抑菌浓度(MIC)测定
MIC的确定是为了排除物质的抗菌性对群体感应抑制活性的干扰。将过夜培养的C.violaceumCV026和P.fluorescens(OD600=1.0)按照体积比1∶ 100比例分别接种于LB肉汤培养基,将菌液加入96孔板中,每孔100 μL。在菌液中加入环二肽,使其最终质量浓度为15~120 μg/mL,不加环二肽的菌液作为对照。28 ℃培养24 h后,用分光光度计测定培养前后600 nm处的吸光度值。以肉眼观察,96孔板中最低浓度的孔无细菌生长的小分子物质的浓度,即为环二肽的MIC。每组3个平行。环二肽的QS抑制活性验证实验及其对荧光假单胞菌QS表型的影响测定实验都是在其亚抑菌浓度下进行。
1.2.4 紫色杆菌素实验
紫色杆菌素实验参照文献[18]的方法进行。将过夜培养的C.violaceumCV026按照体积比1∶ 100比例分别接种于100 mL的LB琼脂培养基(LB琼脂中需加入10 μL的C6-HSL)。混合均匀后倒平板(平板直径 90 mm)并用牛津杯打孔。在孔中加入100 μL亚抑菌浓度下的环二肽,以100 μL氯仿作为空白对照。将培养皿置于28 ℃下培养24 h,观察平板颜色变化,孔周围紫色素减少则表明物质具有群体感应抑制活性。
1.2.5 生长曲线分析
参照文献[19]的方法进行细菌生长曲线的测定,稍作修改。将过夜培养的C.violaceumCV026(OD600=1.0)按照体积比1∶ 100比例接种于10 mL LB肉汤培养基,加入环二肽使其最终质量浓度分别为60、30、15和7.5 μg/mL。将试管置于28 ℃培养箱160 r/min摇床培养24 h,每隔4 h用酶标仪测定荧光假单胞菌在600 nm处的吸光度值。
1.2.6 荧光假单胞菌无菌上清液的制备
将过夜培养的P.fluorescens(OD600=1.0)按照体积比1∶ 100比例接种于100 mL LB肉汤培养基,加入亚抑菌浓度环二肽,不加环二肽的培养基作为对照。28 ℃、160 r/min摇床培养24 h后,12 000 r/min离心15 min,用0.22 μm无菌滤膜过滤上清液,于-20 ℃下保存。
1.2.7 生物被膜的测定
生物被膜的测定参照文献[20]的方法进行。将过夜培养的P.fluorescens(OD600=1.0)按照体积比1∶ 100比例接种于96孔板,加入亚抑菌浓度的环二肽,不加环二肽的孔作为空白对照,将96孔板置于28 ℃下培养24 h。培养后,用灭菌水(200 μL)冲洗生物被膜3次,干燥30 min,用200 μL质量分数0.1%结晶紫(结晶紫用体积分数33%冰醋酸溶解)染色30 min后,用灭菌水(200 μL/孔)冲洗生物被膜。每孔加入200 μL 体积分数95%乙醇,5 min后测定590 nm处吸光度值。每个实验重复4次取平均值。
1.2.8 胞外蛋白酶产量的测定
参照文献[21]的方法测定胞外蛋白酶活性。将10 mL质量分数1.5%脱脂牛奶(115 ℃,0.06 MPa,单独灭菌30 min)加入90 mL LB琼脂中,当培养基温度降至50 ℃时,加入100 μL无菌上清液,100 μL氯仿作为空白对照,观察平板变化。
1.2.9 泳动和群集运动的测定
泳动平板:胰蛋白胨10 g/L、NaCl 5 g/L、琼脂 3 g/L。
群集平板:蛋白胨10 g/L、NaCl 5 g/L、琼脂5 g/L和D-果糖5 g/L。
配制2种培养基,121 ℃灭菌15 min,平板凝固后分别向培养基中心接种1.5 μL菌液,同时加入亚抑菌浓度环二肽,以不加环二肽的平板作为对照,将平板置于28 ℃培养24 h,观察平板变化。
1.2.10 分子对接分析
酰基高丝氨酸内酯合成酶(LuxI蛋白)和LuxR转录调控因子(LuxR蛋白)的氨基酸序列来自NCBI[acyl-homoserine-lactone synthase (P.fluorescens),GenBank为OKP72411.1;LuxR family transcriptional regulator (P.fluorescens),GenBank为KIF57652.1]。利用Swiss-Model[22](https://swiss model.expasy.org)建立LuxI和LuxR蛋白的三维结构。利用SYBYL-X 2.1对配体和受体蛋白结构进行优化。呋喃C-30和C4-HSL的三维结构来自ZINC网站(http://zinc.docking.org/browse/subsets/)。利用SYBYL-X 2.1进行分子对接操作,获取对接打分并分析配体-蛋白的相互作用。
1.2.11 实时荧光定量PCR验证

反应体系(20 μL):包含10 μL 2×SYBR Green PCR Master Mix,4 μL超纯水,0.5 μL上游引物,0.5 μL下游引物,5 μL cDNA。
PCR反应条件:95 ℃ 3 min;95 ℃ 10 s;55 ℃ 20 s;72 ℃ 20 s;75 ℃ 停留5 s收集荧光信号,反应共进行40个循环,并在65~95 ℃范围内建立溶解曲线。
1.2.12 统计分析
实验数据用平均值±标准差(SD)表示,实验重复3次。用Origin 8.0进行统计分析及作图。数据统计学分析采用 SPSS Statistics 16.0中的单因素ANOVA多量程检验对各组平均值的差异进行分析(p<0.05认为数据具有显著性差异)。

表1 荧光假单胞菌的引物序列Table 1 Primers of candidate genes of P.fluorescens P07
2 结果与讨论
2.1 环二肽结构鉴定结果
从米曲霉的代谢产物中分离出具有群体感应抑制活性的物质经ESI-MS、1H NMR和13C NMR(图1),经鉴定为一种环肽类物质(图2)。ESI-MS结果显示:m/z267 [M + Na]+、511 [2M + Na]+和分子量为244,分子式为C14H16N2O2。13C NMR结果显示,δ:59.1 (d),45.4 (t),28.3 (t),22.5 (t),表明该物质中有脯氨酸片段;δ:7.29 (5H,m)表明物质中具有苯丙氨酸结构。1H NMR (CDCl3,400 MHz)结果显示,δ:7.29 (5H,m),5.81 (1H,br.s,N-H),4.27 (1H,dd,J= 9.6,2.9,Hz,H-2′),4.07 (1H,t,J=7.5 Hz,H-2),3.65 (3H,m,H-3′a,H-5),2.81 (1H,dd,J= 14.4,9.6 Hz,H-3′b),2.32 (1H,m,H-3a),1.95 (3H,m,H-3b,H-4)。13C NMR结果显示:(CDCl3,400 MHz)δ:169.4 (s,C-1),165.1 (s,C-1′) 135.9 (s,C-4′),129.2 (d,C-5′,C-9′),129.1 (d,C-6′,C-8′),127.5 (d,C-7′),59.1 (d,C-2),56.2 (d,C-2′),45.4 (t,C-5),36.8 (t,C-3′),28.3 (t,C-3),22.5 (t,C-4)。通过上述结果可以得出,这种物质为环- (L-苯丙氨酸-L-脯氨酸)。
2.2 环二肽QS抑制活性和对P.fluorescens胞外蛋白酶、泳动、群集的影响
MIC测定结果如图3所示。由图3可知,环二肽对C.violaceumCV026和P.fluorescens的最小抑菌质量浓度分别为47.5和80 μg/mL。C.violaceumCV026自身不能产生C6-HSL信号分子,但当其遇到外源信号分子时,会产生紫色杆菌素,使平板显紫色[23]。

图1 环二肽的核磁检测结果Fig.1 NMR results of the cyclic dipeptide
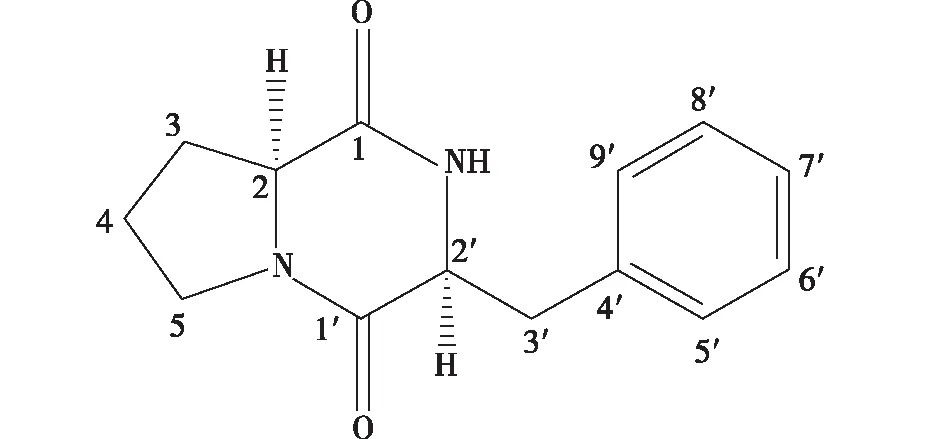
图2 环二肽的化学结构Fig.2 Chemical structure of the cyclic dipeptide
在亚抑菌浓度下,添加环二肽的孔周围出现淡黄色的晕圈,而对照组则无明显变化(图3(a)),表明环二肽显示了群体感应抑制活性,且黄色晕圈不透明,表明环二肽没有显示抑菌性,也表明环二肽的紫色素抑制作用不是由于抑菌性,而是由于群体感应抑制活性。
腐败微生物分泌胞外蛋白酶将食物中的蛋白分解为氨基酸和短肽,并进一步分解为H2S、腐胺醛、酮、酯、有机酸和各种有毒物质[24]。在脱脂乳平板中,未经环二肽处理的孔周围有大而透明的区域,表明荧光假单胞菌具有产生大量胞外蛋白酶的能力。加入环二肽后,孔周围没有明显变化(图3(b)),表明环二肽显著抑制了荧光假单胞菌产生胞外蛋白酶的能力。
细菌依靠鞭毛在固体培养基的表面快速迁移,使其能够逃离抗菌剂和宿主的免疫系统对细菌的杀伤作用。在泳动和群集运动平板上,荧光假单胞菌从接种点开始扩散运动,在平板上形成圆形菌落(图3(c)、图3(d))。当用环二肽处理时,菌落的半径显著减小,表明环二肽显著抑制了荧光假单胞菌的运动性。这一结果与Norizan等[25]的研究结果一致,表明咖啡因能抑制铜绿假单胞菌的群集运动[25]。
2.3 环二肽对荧光假单胞菌生物被膜和生长的影响
细菌产生的生物被膜会对食品工业造成严重危害。生物被膜附着在食品和加工设备上,即使采用现代技术也难以彻底清除,给经济带来巨大损失,对公众健康也构成严重威胁。因此,迫切需要寻找能够干扰或阻断生物被膜产生的新途径。生物被膜的产生受到QS系统的调控。本文中,笔者研究了环二肽对荧光假单胞菌生物被膜和生长的影响,结果如图4所示。
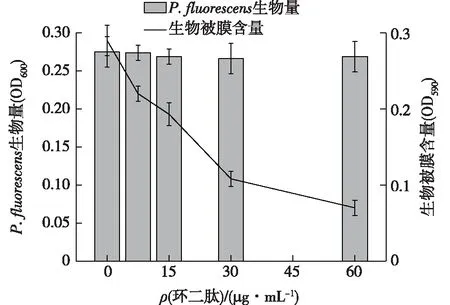
图4 环二肽对荧光假单胞菌生物被膜和生长的影响Fig.4 Effects of the cyclic dipeptide on bacterial growth and biofilm formation of P.fluorescens
由图4可知,环二肽在亚抑菌浓度下,对生物被膜的分泌呈浓度依赖性的抑制作用,环二肽浓度越高,生物被膜含量越少。特别是当环二肽质量浓度为60 μg/mL时,生物被膜含量下降了75.86%。从荧光假单胞菌的生物量可以看出,环二肽的添加没有对细菌的生长造成影响。由此表明,环二肽在没有干扰细菌生长的前提下,显著抑制了细菌生物被膜的产生。Husain等[26]发现丁香油对铜绿假单胞菌P.aeruginosaPAO1和嗜水气单胞菌AeromonashydrophilaWAF-38的总蛋白酶、绿脓杆菌素、泳动、生物被膜的形成等均有抑制作用。
2.4 环二肽群体感应抑制机制探究
2.4.1 序列比对、同源建模以及模型评价结果
利用ClustalW程序对目标蛋白和模板蛋白的序列进行比对,发现氨基酸序列具有很高的保守性,结果如图5所示。从中选择相似度大于30%的蛋白序列进行同源建模,对模板蛋白的研究表明,分别有3个模板(3p2h.1.A,1ro5.1.A,1k4j.1.A)和9个模板(2q0o.1.A,2q0o.1.B,3qp5.2.A,3qp5.1.B,3qp5.2.B,3qp5.1.A,3szt.1.A,3szt.1.B,3qp6.1.A)适合进行荧光假单胞菌LuxI型蛋白和LuxR型蛋白的建模(表2)。GMQE(global model quality estimation)是指全局模型质量评价,其得分用来评价所建模型的质量。得分越高,表明模型的质量越好。QMEAN(qualitative model energy analysis)定性模型能量分析,是一个综合评分函数,能够在单一模型的基础上,得出全局和局部的绝对质量评估。由表2可知,分别选择3p2h.1的A链和2q0o.1的A链作为LuxI型蛋白和LuxR型蛋白的模板蛋白进行同源建模。

图5 荧光假单胞菌LuxI型蛋白(a)和LuxR型蛋白(b)序列比对结果Fig.5 Sequence alignment of the acyl-homoserine-lactone synthase (a) and Lux R family transcriptional regulator (b) proteins and template proteins of P.fluorescens
对建好的LuxI型蛋白和LuxR型蛋白模型进行质量评价,结果如图6所示。由图6可知,对于LuxI型蛋白和LuxR型蛋白,其QMEAN、Z-score得分别是0.66、-1.08和0.57、-2.16,表明2个模型均具有较好的质量。Gnanendra等[27]也通过同源建模的方法建立了鼠伤寒沙门菌SdiA的同源物模型,并将SdiA与AHL进行分子对接分析。
2.4.2 分子对接结果
基于AHL的QS系统由LuxI型和LuxR型受体蛋白组成。该合成酶产生的AHLs作为信号分子与受体蛋白结合,诱导某些QS靶基因的表达。为了探讨环二肽对荧光假单胞菌QS系统的抑制机制,采用分子对接技术研究其与受体蛋白之间可能的相互作用。P.fluorescens的LuxI型蛋白和LuxR型蛋白模型与环(L-苯丙氨酸-L-脯氨酸)、C4-HSL和呋喃C-30的对接结果如图7所示,从图7中可以看出,环二肽嵌于LuxI型蛋白的对接口袋中,二者形成了重要的相互作用。环二肽与LuxI型蛋白的关键残基ARG105形成氢键;与LuxR型蛋白模型的关键残基LEU177形成关键氢键。C4-HSL和呋喃C-30分别与LuxR型蛋白模型的GLU183和ARG164形成了关键氢键。
配体与蛋白的对接得分如表3所示。表中,Crash是碰撞打分,Polar是指氢键和盐桥相互作用对总得分的贡献。由表3可知:环二肽与LuxI型蛋白模型对接得分为4.5836,高于LuxR型蛋白(3.1372)。信号分子C4-HSL与LuxR型蛋白模型的总得分为2.8235,高于呋喃C-30(1.7139)。环(L-苯丙氨酸-L-脯氨酸)与LuxI型蛋白模型的对接得分高于其他模型,特别是天然配体C4-HSL。表明该抑制机制可能是由于环二肽与LuxI蛋白竞争性结合,从而抑制了信号分子的产生,从而阻断了QS通路和相关基因的表达。
2.5 RT-qPCR验证结果
通过RT-qPCR技术,探究环二肽对荧光假单胞菌的luxI、luxR以及与细菌运动相关基因(flgA)的影响,相关基因的表达差异结果如图8所示。由图8可知,细菌经环二肽处理后,luxI和flgA基因与对照相比显著降低,其相对表达量分别减少了42.65%和32.80%,而luxR基因变化不显著,以上结果也验证了分子对接技术的结果。
3 结论
通过探究从米曲霉的代谢产物中分离得到的环二肽的群体感应抑制活性,并测定其对水产腐败菌——荧光假单胞菌胞外蛋白酶的产生、生物被膜的分泌等的影响,发现其对荧光假单胞菌的群体感应表型具有很好的抑制效果。由此表明,从真菌的代谢产物中筛选出具有较强群体感应抑制活性的QSIs是完全可行的,环二肽可能是一种新的、有潜力的群体感应抑制剂。
此外,通过分子对接技术和RT-qPCR技术分析环二肽的抑制机制,发现环二肽对荧光假单胞菌的QS系统的抑制作用很可能是因为环二肽结合到了LuxI型蛋白中,阻断了AHLs的产生,导致其不能与LuxR型蛋白结合,从而阻断了其QS通路以及相关基因的表达,最终导致荧光假单胞菌的QS表型的表达受阻,引起一系列QS调控的表型如群集性、泳动性、生物被膜等的抑制现象。通过同源建模所构建的荧光假单胞菌的QS系统的LuxI和LuxR蛋白模型可能成为发现新的食品防腐剂的潜在靶点。

表2 荧光假单胞菌LuxI型蛋白和LuxR型蛋白同源建模结构和得分Table 2 Structures and scores of template proteins of acyl-homoserine-lactone synthase and LuxR family transcriptional regulator of P.fluorescens

图6 荧光假单胞菌LuxI型蛋白(a~c)和LuxR型蛋白(d~f)模型评价结果Fig.6 Assessment of the acyl-homoserine-lactone synthase (a-c) and Lux R family transcriptional regulator (d-f) proteins of P.fluorescens

图7 环二肽与荧光假单胞菌LuxI型蛋白和LuxR型蛋白分子对接结果Fig.7 Molecular docking of the cyclic dipeptide and other ligands with acyl-homoserine-lactone synthase and Lux R family transcriptional regulator models of P.fluorescens

表3 环二肽、C4-HSL、furanone C-30和荧光假单胞菌的LuxI型蛋白和LuxR型蛋白分子对接结果Table 3 Docking results of acyl-homoserine-lactone synthase and Lux R family transcriptional regulator models of P.fluorescens with cyclo-(L-phenylalanyl-L-prolyl),C4-HSL and furanone C-30
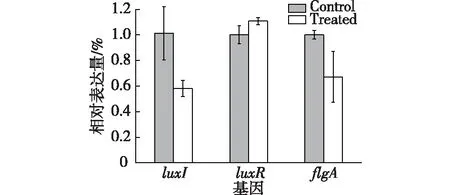
图8 环二肽对荧光假单胞菌基因表达的影响Fig.8 Effects of the cyclic dipeptide on gene expression in P.fluorescens

